亚麻木酚素通过调控TXNIP/NLRP3信号通路改善CIH小鼠心肌损伤
任 静,郭亚净,刘 寒,周 健,吉恩生
(河北中医学院基础医学院生理教研室,低氧生理与病理生理实验室,河北 石家庄 050020)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)主要表现为夜间睡眠过程中反复出现的上气道不完全或完全阻塞[1]。其特有的病理过程慢性间歇性低氧(chronic intermittent hypoxia,CIH),是引发心血管疾病的独立危险因素[2]。近年来国内外研究证实,氧化应激是在众多心血管疾病中的主要因素,如心肌肥大、心力衰竭、动脉粥样硬化和缺血性心脏病[3]。有研究表明,与间歇性低氧缺氧/再氧合过程类似的心肌缺血/再灌注损伤诱发心肌细胞氧化应激,大量产生的活性氧(reactive oxygen species,ROS)促使硫氧还蛋白结合蛋白(thioredoxin interaction protien,TXNIP)与核苷酸结合寡聚化结构域样受体蛋白3( the pyrin domain containing 3,NLRP3) 相互结合,并激活NLRP3受体,促进NLRP3炎性复合体形成,激活半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase,caspase-1),进而使白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素18(interleukin-18,IL-18)等炎性因子表达水平升高,进而造成小鼠心肌损伤[4-6]。
亚麻木酚素 (secoisolariciresinol diglucoside,SDG)为亚麻籽的主要生物成分,其含量约为其他植物的75~800倍[7]。SDG具有抗氧化、抗炎、抗凋亡、抗血小板聚集、抗癌以及清除自由基的作用[1]。有研究证明,在离体缺血/再灌注模型中,SDG具有促进血管生成和抗凋亡的特性,起到心脏保护作用[8]。且研究显示,SDG可以直接清除自由基,抑制ROS的生成[9]。因此,本研究探讨SDG是否通过调控ROS-TXNIP-NLRP3信号通路,从而改善CIH诱发的小鼠心肌损伤,旨在为临床防治OSA提供新思路。
1 材料与方法
1.1 动物健康成年♂ C57BL/6小鼠18只,6~8周龄,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK[京]2016-0006。动物饲料购自江苏协同医药生物工程股份有限公司。动物在特定的无致病性条件下饲养,12 h光照/12 h暗周期,自由饮水,室内温度控制在(25±1) ℃。
1.2 主要试剂与设备
1.2.1主要药品与试剂 SDG(爱必信生物科技有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程研究所);ELISA检测试剂盒TNF-α、IL-6、IL-1β(武汉华美生物工程有限公司);抗TXNIP、抗NLRP3、抗caspase-1、抗IL-1β和抗IL-18抗体(ABclonal公司);抗含CARD的凋亡相关颗粒样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)抗体(Abcam公司);兔抗鼠Tublin单克隆抗体(武汉赛维尔生物科技有限公司);Tween-20、PIPA裂解液和苯甲基磺氟(phenylmethylsulfonylfluoride,PMSF)(北京索莱宝科技有限公司)。
1.2.2仪器设备 CIH氧舱(Oxyeycler Model 84,BioSpherix公司,美国);正置显微镜(DMEB,Leica公司,德国);全自动酶标分析仪(EPOCH,Thermo Fisher公司,美国);多功能成像系统(Vilber Fusion FX5 Spectra,Vilber Lourmat,法国)
1.3 主要方法
1.3.1造模与分组 将C57BL/6小鼠(n=6)随机平均分为3组:常氧组、CIH组和CIH+SDG组。小鼠自由饮食,适应性饲养1周,在日间进行造模。将CIH组和CIH+SDG组小鼠置于CIH舱中,前1.5 min向舱内充入100%氮气,使氧气浓度降至9%,后1.5 min充入纯氧,使氧气浓度升至21%,每一循环3 min。与此同时,将常氧组置于相同规格的舱内,但向舱内冲入空气。每天8 h(9 AM~5 PM)上舱,每周7 d,持续5周,共35 d。每天造模前,CIH+SDG组给予SDG溶液灌胃(用药量30 mg·kg-1),以药理研究方法学的小鼠与临床人用药量折算方法折算,CIH与常氧组灌服同等体积的生理盐水。
1.3.2动物标本采集 ① 一般信息采集:每天观察小鼠行为和生理变化,造模35 d后,取材前,称量小鼠体质量(body weight,BW)。② 血液采集:造模35 d后,1%戊巴比妥钠,按体重100 μL·g-1,腹腔注射。并进行目内眦取血,存放于促凝管中,室温放置30 min后,4 ℃、1 500 r·min-1、离心15 min后取上清液置于-80 ℃保存。③ 造模结束(35 d)后,1%戊巴比妥钠腹腔注射麻醉后,小鼠仰卧位固定于手术操作板上,暴露胸腔。迅速摘取心脏并移去多余组织,并称心脏质量(heart weight,HW),计算小鼠心脏质量(HW)/体质量(BW)的比值。心脏组织,用生理盐水冲洗,放于无菌无酶冻存管内,置于-80 ℃保存,待Western blot检测。心尖放于4%多聚甲醛固定,石蜡包埋、切片。
1.3.3小鼠心肌损伤情况检测 HE染色,光镜下观察各组小鼠心肌组织病理学变化,每张切片随机选取4个视野进行拍照。检测各组小鼠血清生化指标LDH、CK的水平,按照试剂盒说明书检测。
1.3.4TBA、NBT法检测心肌组织中氧化应激指标 取小鼠心肌组织匀浆,离心后取上清检测MDA、SOD含量,按照试剂盒说明书进行操作。
1.3.5酶联免疫吸附测定(ELISA)法测定小鼠血清中炎症因子TNF-α、IL-6、IL-1β的含量 用ELISA法测定血清中TNF-α、IL-6、IL-1β含量,促凝血3 000~4 000 r·min-1,离心10 min,取上清,4℃冰箱存放,待测。
1.3.6Western blot检测小鼠心肌组织中TXNIP、NLRP3、caspase-1、ASC、IL-18和IL-1β的蛋白表达情况 小鼠心肌组织20 mg左右,每100 mg组织加入裂解缓冲液(磷酸蛋白酶抑制剂A ∶B ∶cocktail ∶PMSF=1 ∶1 ∶2 ∶1)1 mL置于冰上,随之进行机械破碎和超声破碎,使组织充分裂解。12 000 r·min-1、4 ℃、离心15 min,取上清。采用BCA法进行蛋白样定量,测好蛋白浓度后根据蛋白样体积:4×buffer=3 ∶1的比例加入4×buffer,剩余用水补充,上样量至10 μL。封口,于沸水中煮沸5 min,使蛋白充分变性,-20 ℃保存备用。

2 结果
2.1 亚麻木酚素对CIH小鼠心肌损伤的改善作用
2.1.1亚麻木酚素对CIH小鼠心肌组织病理学表现的影响 HE染色结果,常氧组小鼠心肌细胞排列整齐,胞核居中,呈完整的圆形或椭圆形,胞间内无水肿,未见心肌纤维化等明显的病理损伤;CIH组小鼠心肌细胞排列紊乱,胞核坏死,细胞明显肿胀,胞间隙增大,严重颗粒变性、空泡变性,同时还有炎症细胞浸润,心肌纤维断裂溶解、坏死,纤维化等病理改变;CIH+SDG组与CIH组相比,心肌组织纤维化程度明显减轻,细胞形态大致完整,见Fig 1。从病理切片来看,CIH对心肌细胞造成了实质性损伤,此外,亚麻木酚素可以明显减轻CIH诱导的小鼠心肌损伤。
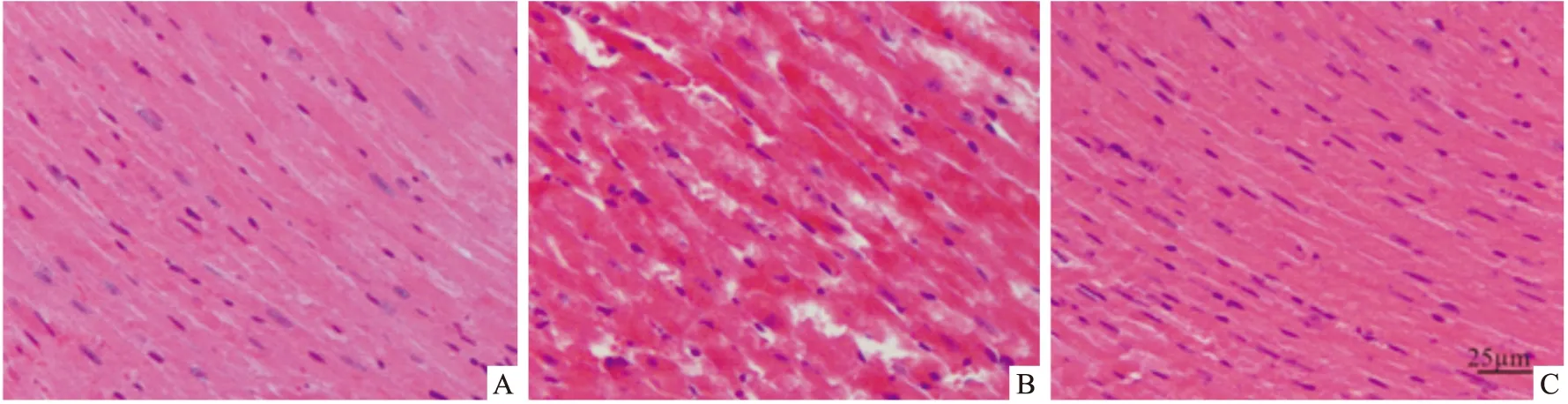
Fig 1 HE staining of mouse myocardium in each groupA:control;B:CIH;C:CIH+SDG
2.1.2亚麻木酚素对CIH小鼠心质量/体质量比值的影响 3组小鼠造模完成后的心质量/体质量比值计算结果。可见CIH处理组小鼠心质量低于常氧组,CIH组小鼠体质量明显低于常氧组(P<0.01),而与常氧组相比CIH处理组小鼠心质量/体质量比值明显升高(P<0.05),给予SDG后小鼠心质量/体质量比值下降(P<0.05),见Tab 1。
Tab 1 Comparison of heart weight,body weight,heart weight / body weight of mice in each
2.1.3亚麻木酚素对CIH小鼠血清生化指标的影响 与常氧组相比,CIH组血清中LDH、CK的浓度明显升高(P<0.01),而CIH+SDG组与CIH组相比明显降低(P<0.05),见Tab 2。说明CIH造成了心肌细胞的破坏,LDH、CK释放入血,亚麻木酚素处理组小鼠血清中LDH、CK明显减低。
Tab 2 Measurement results of LDH and CK concentrations in mouse
2.2 亚麻木酚素对CIH小鼠心肌氧化应激的作用分别检测3组小鼠心肌组织匀浆中MDA、SOD的含量。与常氧组相比,CIH组小鼠心肌组织中MDA含量明显升高(P<0.01),SOD含量明显降低(P<0.01)。SDG干预可见MDA含量明显下降(P<0.05),SOD含量明显升高(P<0.01),见Tab 3。说明CIH可以引起小鼠心肌氧化应激,且给予SDG后改善了CIH小鼠诱导的氧化应激。
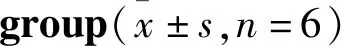
Tab 3 Contents of MDA and SOD in myocardial tissues of rats in each
2.3 亚麻木酚素对CIH小鼠心肌炎症的作用
2.3.1亚麻木酚素对CIH小鼠血清中炎性因子的影响 3组炎症因子的比较,CIH组与常氧组相比,血清中TNF-α、IL-6、IL-1β均明显升高(P<0.05),而CIH+SDG组与CIH组相比TNF-α有非常明显的下降(P<0.01),IL-6明显下降(P<0.05),IL-β含量降低,见Tab 4。这说明CIH可造成小鼠血清中炎症因子升高,给予SDG后可以改善CIH诱导的小鼠全身性炎症反应。
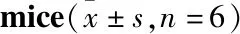
Tab 4 Measurement results of serum inflammatory factors TNF-α,IL-6 and IL-1β in
2.3.2Western blot检测TXNIP、NLRP3、caspase-1、ASC、IL-18和IL-1β蛋白表达情况
2.3.2.1SDG对CIH小鼠心肌组织中TXNIP、NLRP3、caspase-1、ASC、IL-18和IL-1β蛋白表达情况的影响 结果见Fig 2,模型组与常氧组相比,小鼠心肌中TXNIP、NLRP3炎性小体(NLRP3、caspase-1和ASC)蛋白表达均明显升高(P<0.05),给药组与模型组相比,TXNIP、NLRP3炎性小体(NLRP3、caspase-1和ASC)蛋白的表达均明显下降(P<0.05)。
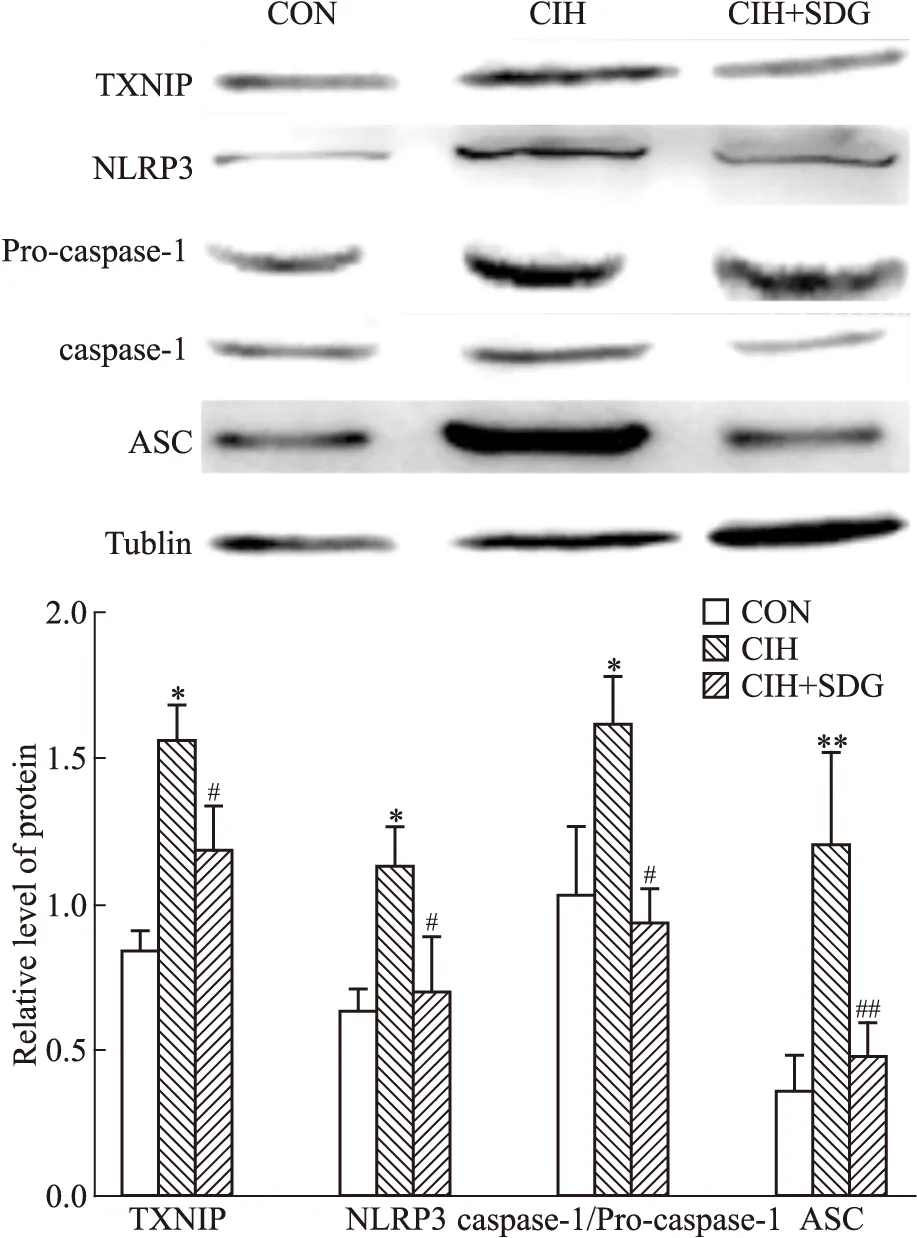
Fig 2 The protein expression levels of TXNIP and NLRP3 inflammasomes in myocardial tissuesdetected byWestern blot in each *P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs CIH
2.3.2.2SDG对CIH小鼠心肌组织中炎性因子IL-18和IL-1β蛋白表达情况的影响 结果见Fig 3,模型组与常氧组相比,IL-18、IL-1β蛋白表达明显升高(P<0.01),给药组与模型组相比,IL-18明显降低(P<0.01),IL-1β蛋白表达降低。

Fig 3 Expression of IL-18 and IL-1β protein in myocardial tissuesdetected by Western blot in each **P<0.01 vs control;##P<0.01 vs CIH
3 讨论
OSA是一种常见的慢性睡眠呼吸障碍性疾病,全球2%的中年女性和4%的男性受其影响[10]。现代医学对OSA一般采用药物治疗、口腔矫治器治疗、呼吸机持续气道正压通气治疗、外科手术治疗等。然而到目前为止,各种治疗措施疗效不十分理想。姚亮等根据中医理论将鼾症分为肺脾气虚型、血虚性、肾阴虚行、肾阳虚型,其中临床上以肺脾气虚证常见[11]。《本草图经》《本经逢原》《滇南本草》等医籍中提到亚麻籽 “味甘辛、性平、无毒,具有补虚、补阴、养血祛风” 的作用。现代研究中表明亚麻籽提取物SDG具有心血管保护作用[12-13],且具有抗氧化、抗炎、抗凋亡、抗血小板聚集、抗癌以及清除自由基的作用[1]。
CIH作为OSA的主要病理特征[14],是引发包括心室重构、心肌缺血、心力衰竭在内的心肌损伤的独立危险因素。近年来有研究证实[15],与间歇性低氧缺氧/再氧合过程类似的,心肌缺血/再灌注损伤导致氧化应激并产生大量的ROS释放,促使 TXNIP 与 NLRP3 相互结合激活心肌组织中NLRP3炎性小体促使IL-1β、IL-18表达水平升高,降低心脏功能,扩大梗死面积。然而,CIH是否通过ROS-TXNIP-NLRP3信号通路诱发心肌损伤,以及SDG是否通过调节ROS-TXNIP-NLRP3信号通路改善CIH诱发的小鼠心肌损伤目前尚不清楚。此外,氧化应激反应在CIH 诱发的心肌损伤中起着关键作用,一般通过检测脂质过氧化物的终产物MDA以及SOD反映氧化应激水平以及细胞损伤程度[15]。其中TXNIP在无应激状态时,TXNIP是抗氧化剂硫氧还蛋白(thioredoxin-1,Trx-1)的负调节因子,TXINP与Trx在胞核内结合。而在氧化应激条件下,Trx1-TXNIP复合物解离,TXNIP从胞核转位到胞质,进而与NLRP3受体结合并活化NLRP3受体,促进NLRP3炎性小体形成[6,16]。将小鼠暴露于间歇性低氧环境中35 d 后,监测到其MDA水平较正常对照组明显增加,其SOD水平明显下降,心肌组织中TXNIP蛋白表达明显升高。给予SDG后,与CIH组相比,MDA水平下降,SDG水平有所上升,心肌TXNIP蛋白表达降低。以上结果显示,CIH可以引起小鼠心肌氧化应激及TXNIP蛋白的表达升高,给予SDG后改善了CIH小鼠诱导的氧化应激反应,提示SDG可通过抑制ROS的产生从而减弱TXNIP在心肌组织中的表达。其中NLRP3炎性小体是由NLRP3、衔接蛋白ASC(凋亡相关的斑点样蛋白)和pro-caspase-1组合而成的一种多蛋白复合体,在细胞碎片和微生物产物等促炎因子刺激下组装而成,其可触发固有免疫防御并且与无菌的炎症反应有关。NLRP3炎性小体可通过活化caspase-1诱导促炎因子IL-1β和IL-18的成熟、释放,从而引起组织炎症反应[17]。我们研究发现,CIH 小鼠心肌组织中NLRP3炎性小体、IL-1β和IL-18蛋白表达增多,SDG可使CIH小鼠NLRP3炎性小体、IL-1β和IL-18蛋白表达降低,减轻了CIH小鼠心肌损伤。这些结果均表明SDG可通过调节ROS-TXNIP-NLRP3信号通路改善了CIH诱导的小鼠心肌损伤。