鸡豆黄素A抑制血管紧张素Ⅱ诱导的小胶质细胞活化及其机制的研究
韩俊辉,杨 丽,俞益桂,薛海霞,吴文宁,李维祖,尹艳艳
(安徽医科大学基础医学院药理学教研室,合肥 安徽 230032)
帕金森病(Parkinson’s disease,PD)是一种以中老年人为主体的神经退行性疾病,其病理学特征为黑质致密部(substantia nigra pars compacta,SNpc)多巴胺(dopamine,DA)能神经元的凋亡和丧失[1]。迄今为止该疾病的发病机制尚不明确,在临床上没有可靠有效的治疗方法。研究表明:肾素-血管紧张素系统(renin-angiotensin system,RAS)可以通过血管紧张素1受体(angiotensin type 1 receptor,AT1R)在神经炎症、氧化应激和多巴胺能变性的发展中发挥重要作用[2]。不同的致病因素如衰老、神经毒素、促炎因子都可以导致RAS的激活,局部或旁分泌的RAS是尼克酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotidephosphate,NADPH)氧化酶的激活剂,并且参与氧化应激和炎症反应。这提示血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导小胶质细胞活化介导的神经炎症与PD的病程有密切的关系。
鸡豆黄素A(biochaninA,Bioch A)是异黄酮类植物雌激素,具有抗高血压[3]、抗细胞凋亡[4],对AD小鼠模型具有保护作用[5]。课题组前期研究结果发现,Bioch A能抑制LPS诱导的BV2活化,主要是通过抑制氧化应激,减少炎症因子的释放。但是,关于鸡豆黄素A抑制小胶质细胞活化的机制尚未完全明确,本研究通过建立AngⅡ诱导小胶质细胞活化的体外模型,观察Bioch A抑制AngⅡ诱导小胶质细胞活化的机制。
1 材料
1.1 细胞株小鼠小胶质细胞(BV2)株(来自于中国医学科学院协和医科大学基础细胞中心细胞室)。
1.2 药品与试剂DMEM培养基:美国Gibco公司;胎牛血清(FBS):杭州四季青公司;二甲基亚砜(DMSO)、噻唑蓝(MTT)、血管紧张素Ⅱ(AngⅡ)、鸡豆黄素A(Bioch A)、过硫酸铵(AP):美国Sigma公司;磷酸盐缓冲液(PBS):北京中杉金桥生物技术有限公司;胰蛋白酶(Trypsin)、NO检测试剂盒、ROS检测试剂盒(DCFH-DA荧光探针法)、RIPA裂解液(弱)、青霉素-链霉素溶液、SDS-PAGE蛋白上样缓冲液、BCA蛋白浓度测定试剂盒:江苏碧云天生物技术研究所;PVDF膜:美国Millipore公司;甲醇:上海化学试剂公司;超敏感底物发光试剂盒:北京全品速生物科技有限公司;鼠抗β-actin抗体(AF5001):北京中杉金桥生物技术有限公司;兔抗P47phox抗体(BS1846)、兔抗gp91phox抗体(BS9035):美国Bioworld公司;兔抗ASC抗体(67824S)、兔抗Caspase-1抗体(NB100-56565)、兔抗IL-1β抗体(12426S)、兔抗TNF-α抗体(11948S)、兔抗IL-6抗体(12912S):英国Abcam公司;兔抗NLRP3抗体(15101S):美国CST公司。
1.3 主要仪器GR600A立式全自动蒸汽灭菌器:致微(厦门)仪器有限公司;CHL2FM3型倒置显微镜:日本Olympus公司;SpectraMax190型全波长酶标仪:美国Molecular Device公司;DHG-9070型恒温烘箱:三发(上海)科学仪器有限公司;4600 Mini型化学发光成像系统:殴翔科学仪器有限公司;IC 1000型Countstar自动细胞计数仪:睿钰(上海)生物科技有限公司;TGL-20M型全自动高速低温离心机:黑马(珠海)医学仪器有限公司;HealForce100型恒温培养箱:力康(香港)生物医疗科技有限公司;WH2型漩涡混合仪:泸西(上海)分析仪器厂。
2 方法
2.1 BV2细胞株的培养将BV2细胞接种于含10%血清(FBS)和1%青霉素和链霉素溶液的DMEM培养基中,然后将该培养瓶放置在5% CO2,37 ℃的恒温培养箱中培养。每隔2~3 d更换一次。待显微镜下观察到细胞占据培养瓶面积90%以上或细胞铺满瓶底时,即可进行细胞传代。使用Countstar自动细胞计数仪检测细胞数目。待在显微镜下观察到细胞长满80%~90%时,提前配制冻存液对处在对数生长期的增殖能力强的BV2细胞进行冻存。细胞复苏过程要尽量加快速度,以免冻存液中的DMSO在常温下杀伤细胞,影响实验结果。
2.2 AngⅡ剂量的筛选为了选择合适的AngⅡ造模浓度。试验将BV2细胞分成6组,分别为AngⅡ(0、25、50、100、200、400 nmol·L-1)组,除对照组外,其余每组加入相应浓度的AngⅡ,恒温箱中孵育24 h,再加入新鲜配制的MTT(0.5 g·L-1)37 ℃孵育4 h,4 h后用移液器吸去培养板中的上清液,将100 μL的DMSO加入每个孔中,振摇10 min,保证室温避光,使甲瓒充分溶解于DMSO中,用全自动酶标仪进行检测,波长为490 nm,应重复至少3次以上的实验。
2.3 NO的测定使用Griess法检测红色重氮化合物从而间接测定NO,试验将BV2细胞分成6组,分别为AngⅡ(0、25、50、100、200、400 nmol·L-1)组;除Control组外,其余各组均加入AngⅡ(100 nmol·L-1)恒温箱中培养24 h。最后收集每组细胞上清。用Griess试剂盒测定吸光度,并计算出各组NO含量。
2.4 ROS检测使用DCFH-DA探针法检测Bioch A对BV2激活后的ROS的表达水平。试验将BV2细胞分为7组,分别为Control组,AngⅡ(100 nmol·L-1),Losartan(1 μmol·L-1)组,AngⅡ(100 nmol·L-1)+Losartan(1 μmol·L-1)组,AngⅡ+Bioch A(1.25 μmol·L-1)组,AngⅡ+Bioch A(2.5 μmol·L-1)组,AngⅡ+Bioch A(5 μmol·L-1)组,分别加上以上药物预处理2 h,除Control组和Losartan(1 μmol·L-1)外,其余各组均加入AngⅡ(100 nmol·L-1)孵育24 h。并在正置荧光显微镜下用DCFH-DA探针法采集相应图像,利用Image-Pro Plus 6.0软件进行分析,检测各组平均荧光强度。
2.5 酶联免疫吸附测定(ELISA)收集细胞上清液:离心,去除颗粒和聚合物,按一次用量分装,冻存于-80 ℃冰箱中,避免反复冻融,确保样品在室温下解冻均匀。标准品的稀释:设置标准品孔和样本孔,标准品孔各加不同浓度的标准品,每个浓度设两个空;加样:在酶标仪包被板上待测样本孔先加待测样本,再加样本稀释液;温箱温育:依次标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记过的检测抗体并盖上封板膜,37 ℃恒温箱温育60 min。洗涤:揭掉封板膜,弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,弃去洗涤液,吸水纸上拍干,重复洗板5次,拍干。避光孵育显色:每孔分别加入底物A、B各50 μL,振摇混匀,37 ℃避光孵育15 min。终止测定:每孔加入终止液50 μL,空白孔调零,在450 nm波长处测定各孔的OD值。用ELISA试剂盒,分别测量TNF-α、IL-1β炎症因子的含量。
2.6 蛋白免疫印记法(Western blot)在培养好的细胞中加入含有蛋白酶抑制剂的细胞裂解液提取蛋白。BCA试剂盒定量后各组取适量样品按样品和蛋白上样缓冲液4 ∶1比例进行变性。将变性后蛋白加入进行SDS-PAGE凝胶电泳,转膜,后用含5%的脱脂奶粉的TBST溶液进行室温封闭1 h,封闭好的膜用TBST洗3次,后将膜至于相应的一抗中4 ℃过夜。次日,TBST洗3次后,室温孵二抗1 h,结束后用TBST洗3次,再用增强化学发光法(ECL),放入化学成像系统进行拍摄。蛋白条带用ImageJ软件检测光密度。

3 结果
3.1 AngⅡ剂量的筛选为了选择合适的AngⅡ造模浓度,我们采用MTT法检测细胞活力。Fig 1结果显示,当AngⅡ的浓度低于100 nmol·L-1时,实验组细胞的MTT值有逐渐升高的趋势;当AngⅡ的浓度大于100 nmol·L-1时,对MTT值进行比较,实验组低于Control,差异具有统计学意义(P<0.05)。此时AngⅡ对BV2细胞作用转变为损伤作用而不是激活作用,因此我们选取AngⅡ(100 nmol·L-1)诱导BV2细胞活化。

Fig 1 Effects of different concentrations of AngⅡ on BV2 cells *P<0.05 vs control group.
3.2 不同浓度的AngⅡ诱导小胶质细胞产生NO的影响采用Griess法检测各组细胞上清液中NO的含量,结果如Fig 2所示,与对照组相比较,当AngⅡ浓度为100 nmol·L-1时,细胞上清液的NO含量增加最多,且差异具有统计学意义(P<0.01);当AngⅡ浓度大于100 nmol·L-1时,细胞上清液的NO含量出现下降,这时的AngⅡ对BV2细胞表现出严重的损伤,引起细胞凋亡。
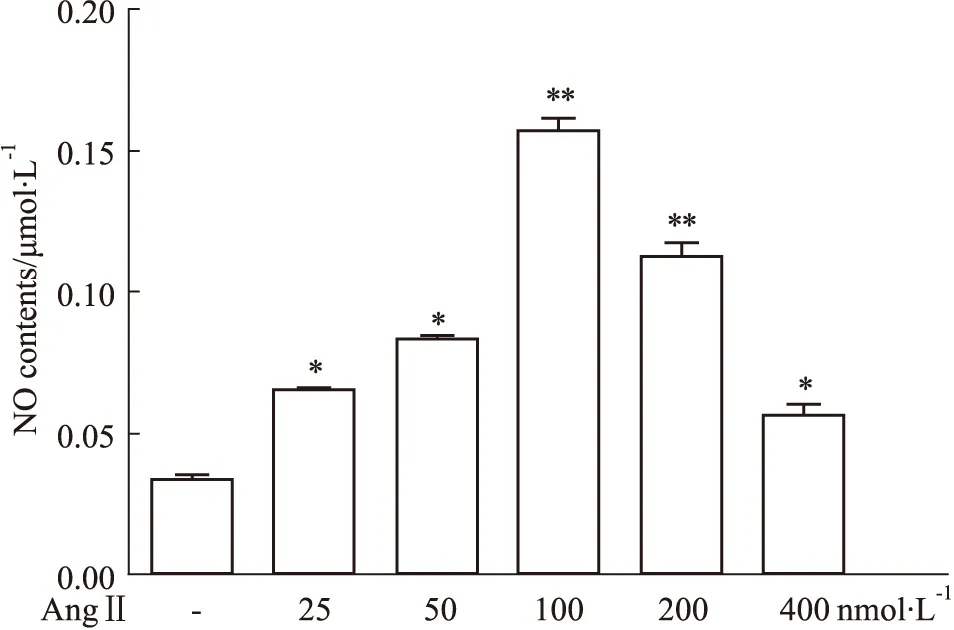
Fig 2 Effects of different concentrations of AngⅡ on NO production in BV2 *P<0.05,**P<0.01 vs control group.
3.3 Bioch A对AngⅡ诱导小胶质细胞活化产生ROS的影响采用DCFH-DA探针法,检测AngⅡ诱导的BV2细胞内的ROS荧光强度,并分析统计各组平均荧光强度,结果如Fig 3所示,与对照组相比较,AngⅡ组ROS荧光强度升高(P<0.01);与AngⅡ组相比,Bioch A (5.0 μmol·L-1)组和losartan组ROS表达量降低(P<0.01),Bioch A (1.25、2.5 μmol·L-1)组ROS的表达量变化差异无统计意义;Losartan组ROS表达水平未出现明显变化(P>0.05);结果表明,加入Losartan阻断AT1R后可以降低细胞内ROS的表达水平,Bioch A能抑制AngⅡ诱导的BV2细胞内的ROS水平升高。
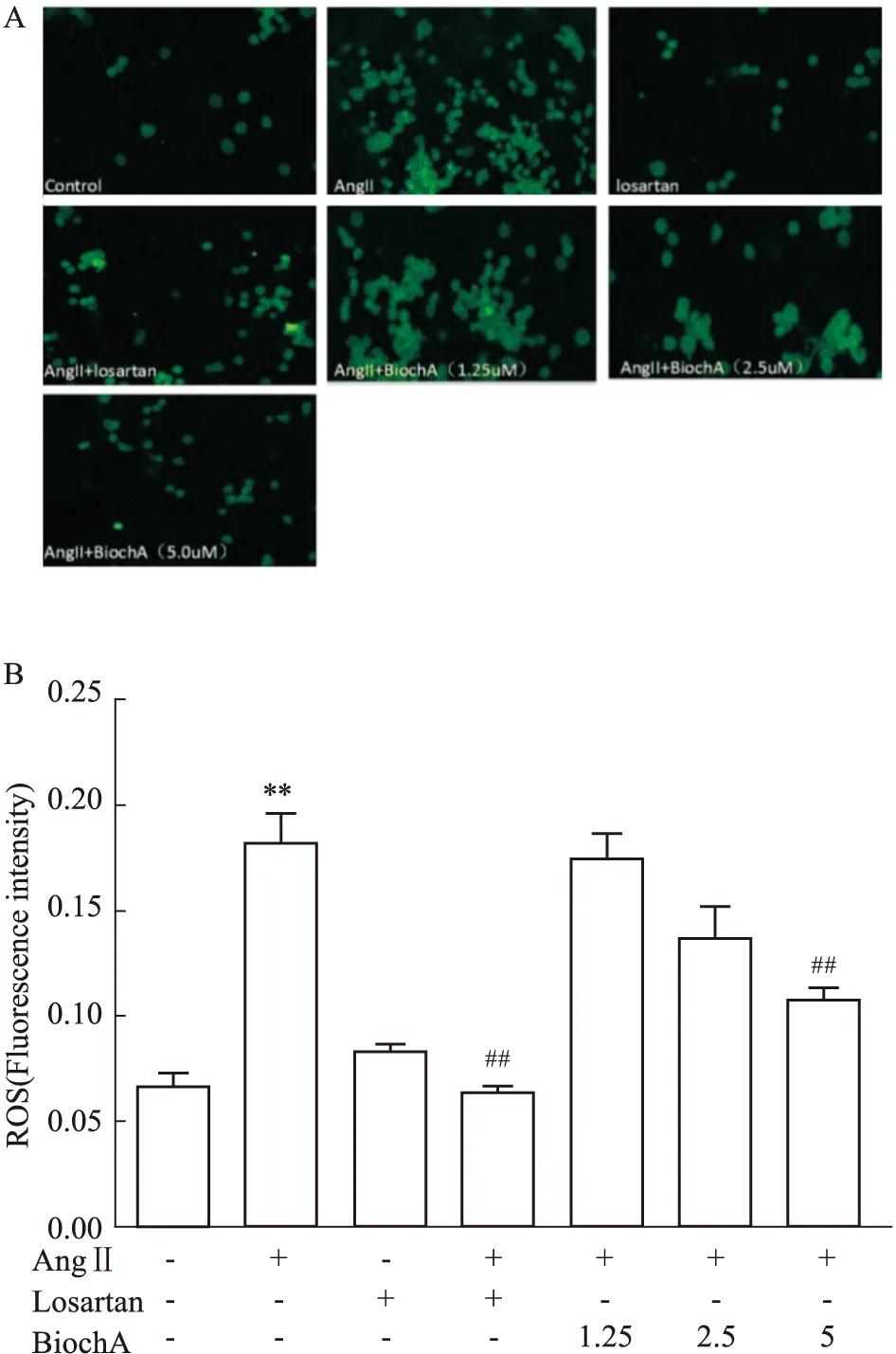
Fig 3 Effects of Bioch A on ROS production in
3.4 Bioch A对AngⅡ诱导小胶质细胞上清中TNF-α,IL-1β释放量的影响采用ELISA法检测AngⅡ诱导小胶质细胞激活后上清液中的炎性因子TNF-α、IL-1β的含量。结果如Fig 4所示,与Control组比较,AngⅡ组上清液中TNF-α、IL-1β含量上调(P<0.01);与AngⅡ组比,Losartan组TNF-α、IL-1β含量下调(P<0.01),Bioch A组(2.5 μmol·L-1)TNF-α、IL-1β含量下调(P<0.05),而Losartan组TNF-α、IL-1β含量未出现明显差异(P>0.05);上述结果表明,Bioch A可以抑制活化的小胶质细胞上清液中炎性因子TNF-α、IL-1β含量的表达。
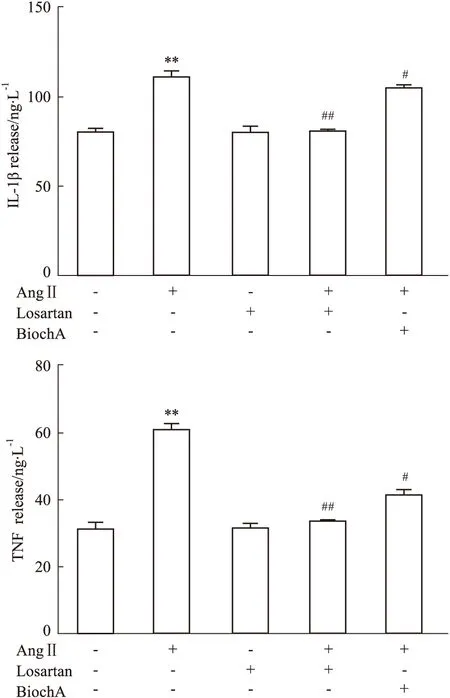
Fig 4 Effects of Bioch A on release of IL-1β and TNF-α **P<0.01 vs control group;#P<0.05,##P<0.01 vs AngⅡ group.
3.5 Bioch A对AngⅡ诱导小胶质细胞AT1R的影响结果如Fig 5所示,与对照组相比,AngⅡ组细胞的AT1R蛋白表达量增多,且差异具有统计学意义(P<0.01);与AngⅡ组相比较,Bioch A (1.25、2.5、5.0 μmol·L-1)组的AT1R蛋白的表达量未出现明显变化(P>0.05)。
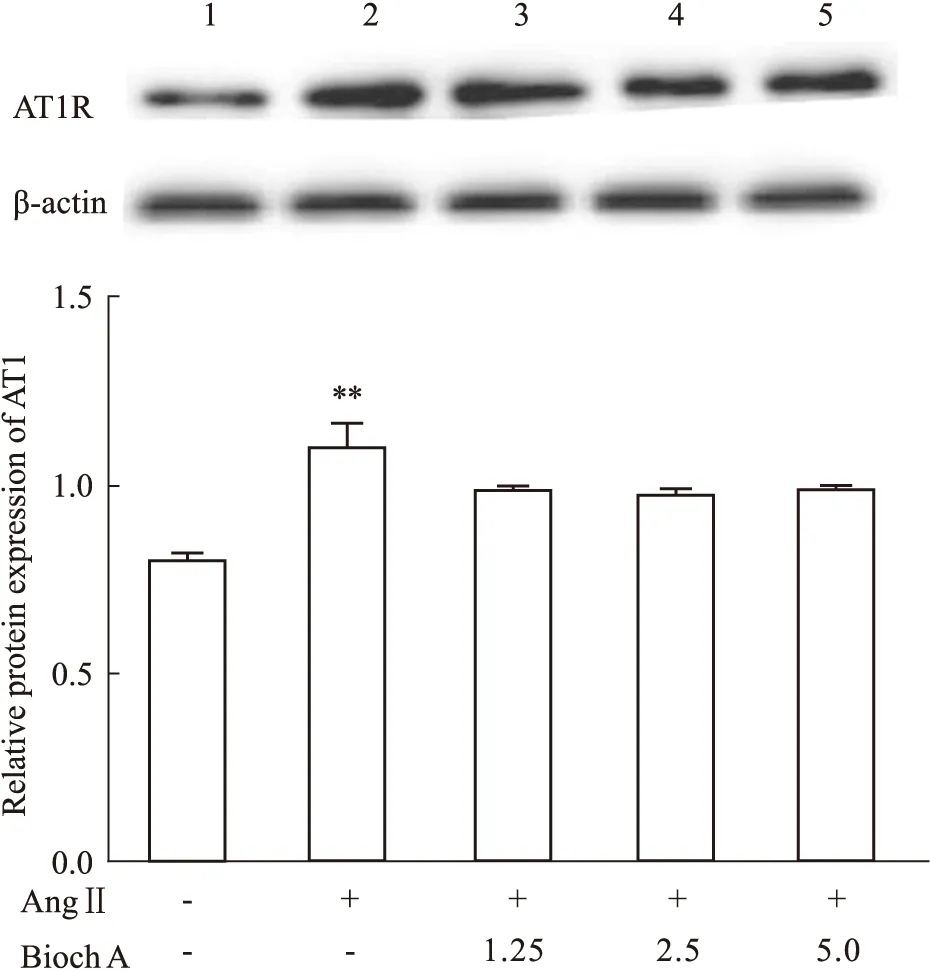
Fig 5 Effects of Bioch A on the expression of AT1R in AngⅡ-induced BV2 cells1.Control group;2.AngⅡ(100 nmol·L-1)group;3.AngⅡ+Bioch A(1.25 μmol·L-1)group;4.AngⅡ+Bioch A(2.5μmol·L-1);5.AngⅡ+Bioch A(5 **P<0.01 vs control group.
3.6 Bioch A对AngⅡ诱导小胶质细胞gp91phox、P47phox蛋白的影响结果如Fig 6所示,与Control组比较,AngⅡ组蛋白表达水平上调(P<0.01);与AngⅡ组比较,Losartan组蛋白水平下调(P<0.01),Bioch A(2.5 μmol·L-1组蛋白水平下调(P<0.05)。结果表明,Bioch A能抑制AngⅡ诱导的小胶质细胞gp91phox、P47phox蛋白表达。
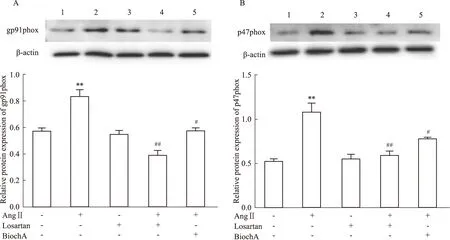
Fig 6 Effect of Bioch A on gp91phox,P47phox induced by AngⅡ in A:gp91phox protein expression B:P47phox protein expression.**P<0.01 vs control group;#P<0.05,##P<0.01 vs AngⅡ group.
3.7 Bioch A对AngⅡ诱导小胶质细胞促炎因子TNF-α、IL-1β、IL-6蛋白表达的影响结果如Fig 7所示,与Control组比较,AngⅡ组蛋白表达水平含量上调(P<0.01);与AngⅡ组比,Losartan组TNF-α、IL-1β、IL-6蛋白水平下调(P<0.01),Bioch A组蛋白水平下调(P<0.05),而Losartan组TNF-α、IL-1β、IL-6蛋白表达未出现明显差异。结果表明,Bioch A可以抑制活化的小胶质细胞炎性因子TNF-α、IL-1β、IL-6蛋白的表达。

Fig 7 Effect of Bioch A on IL-1β,IL-6,TNF-α protein expression in microglial cells induced by A:IL-1β protein expression;B:IL-6 protein expression;C:TNF-α protein expression.**P<0.01 vs control group;#P<0.05,##P<0.01 vs AngⅡ group.1:Control;2:AngⅡ;3:Losartan;4:AngⅡ Losartan;5:AngⅡ Bioch A
3.8 Bioch A对AngⅡ诱导小胶质细胞ASC、Caspase-1及NLRP3蛋白表达的影响结果如Fig 8所示,与Control组比较,AngⅡ组蛋白表达水平上调(P<0.01);与AngⅡ组比,Losartan组ASC、Caspase-1及NLRP3蛋白水平下调(P<0.01),Bioch A组ASC、Caspase-1及NLRP3蛋白水平下调(P<0.05);结果表明,Bioch A可以抑制活化的小胶质细胞中,ASC、Caspase-1及NLRP3蛋白的表达。
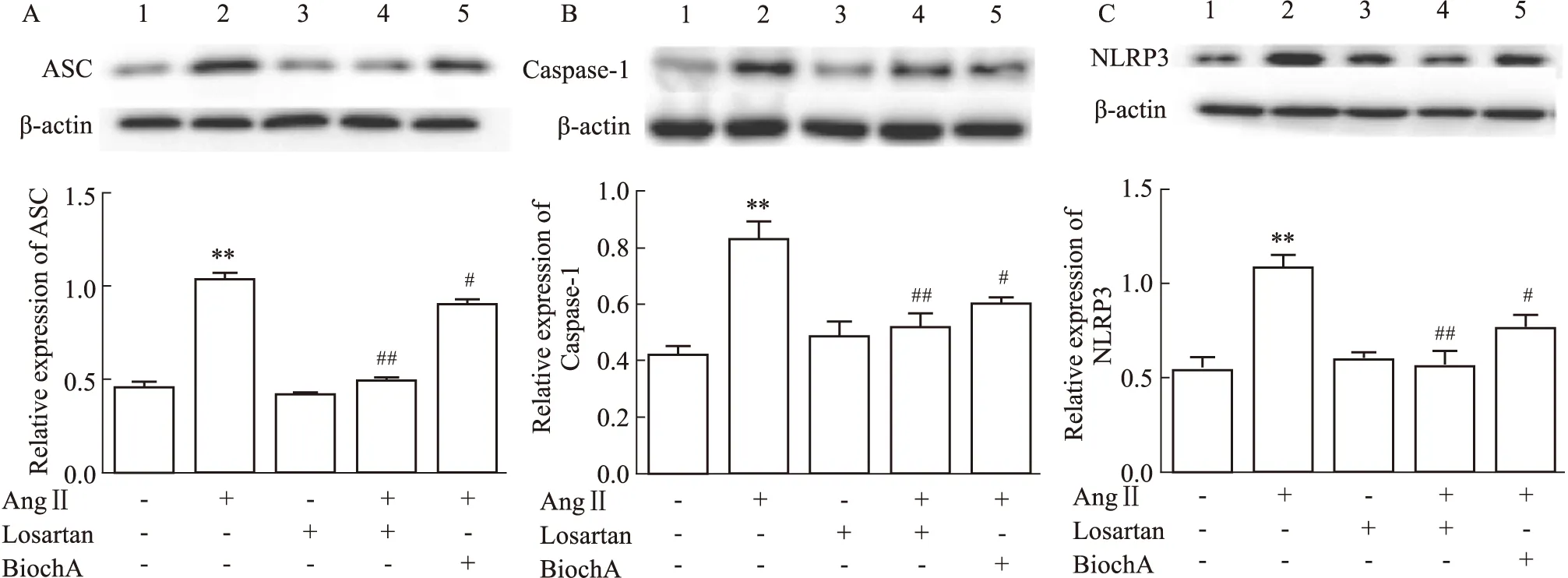
Fig 8 Effects of Bioch A on the levels of ASC,Caspase-1 and NLRP3 in AngⅡ-induced BV2 A:ASC protein expression;B:Caspase-1 protein expression;C:NLRP3 protein expression.**P<0.01 vs control group;##P<0.05,#P<0.01 vs AngⅡ group.1:Control;2:AngⅡ;3:Losartan;4:AngⅡ Losartan;5:AngⅡ Bioch A
4 讨论
研究发现,PD患者的黑质致密部血管紧张素Ⅱ水平高,提示DA能神经元的凋亡可能与AngⅡ水平高有关。RAS主要存在于循环系统,调节血容量和水盐平衡。本实验中采用AngⅡ诱导小胶质细胞活化的体外模型,观察Bioch A抑制AngⅡ诱导小胶质细胞的活化的机制。不同浓度AngⅡ处理细胞,结果显示,AngⅡ(100 nmol·L-1)诱导BV2细胞活力最强,因此本实验选用AngⅡ(100 nmol·L-1)用于后续造模。
神经炎症在PD的病理进程中起着重要的作用[6],它参与线粒体损伤、氧化应激等过程,甚至是PD相关蛋白基因的表达。小胶质细胞在受到免疫炎性因素等刺激或者微环境因子发生变化时,迅速地被激活,同时活化的小胶质细胞释放大量包括NO、ROS、TNF-α和IL-1β等促炎因子或毒性物质,如果这些促炎因子或毒性物质不停地释放,将会导致神经元变性甚至死亡。
AngⅡ作为RAS最重要的效应物,与AT1R相互作用,激活NADPH氧化酶复合物,进而介导氧化应激和炎症的几个关键环节。在PD动物模型中,我们观察到AngⅡ通过AT1R提高了黑质NADPH氧化酶的活性[7-8]。此外,其他研究表明,小胶质细胞激活和NADPH衍生自由基在多巴胺能神经损伤中起主要作用,可能在PD中起重要作用[9-10]。小胶质细胞的激活可能在AngⅡ诱导的PD模型中增强多巴胺能细胞死亡中起关键作用[11-12]。
NLRP3炎症小体的激活主要通过3种模式,其中一种模式和NADPH氧化酶相关的ROS的生成增加有关。有相关研究表示,线粒体中的ROS是调控NLRP3炎症小体活化的关键信号[13-15]。在本实验中,AngⅡ诱导小胶质细胞活化,产生ROS,进而增加NLRP3、ASC和Caspase-1蛋白的表达。NLRP3炎症体的激活可以调控炎症因子(如TNF-α、IL-1β和IL-6等)的增加。说明AngⅡ可能跟通过NLRP3炎症小体促进小胶质细胞的活化,促进炎症因子的释放,参与神经炎症的发生发展。当给予Bioch A后,小胶质细胞的活化被抑制,NLRP3炎症体的活化被抑制,炎症因子的释放也被抑制。
综上所述:Bioch A可以有效抑制AngⅡ诱导小胶质细胞活化,且Bioch A可能通过NLRP3炎症小体抑制小胶质细胞的活化,也为以后植物雌激素治疗PD提供新的研究方向。