调脉饮颗粒抗心律失常的多种离子通道靶点作用研究
李璐 赵明 魏执真 苏敬泽 李英骥
调脉饮是北京中医医院魏执真教授从长期临床实践中总结出来的治疗快速性心律失常的有效方剂[1],全方以益气养心、理气通脉、凉血清热为法,并进行了调脉饮治疗实验性心律失常的经典药效学实验[2-3]、心肌细胞电生理学实验[4]、心脏形态学实验[5]、神经体液内分泌实验[6]以及细胞分子生物学实验[7-9]等涉及整体、系统、器官、细胞和分子的不同层次、大量深入的实验研究,结果显示,调脉饮治疗实验性心律失常有肯定、良好的疗效,具有多途径、多层面、多靶点的作用机制[10]。本研究旨在利用膜片钳技术观察调脉饮对全部心脏离子通道的作用,进一步深入探讨调脉饮抗心律失常的分子机制。
心肌细胞离子通道与心律失常的发生、发展有密切关系,也是心律失常药物开发的重要靶点。本研究采用全细胞膜片钳技术观察调脉饮对快速延迟整流钾通道(rapidly activating delayed rectifier potassuim channel,Ikr,hERG)、钠通道1.5亚型(sodium channel subtype 1.5,NaV1.5)、钙通道1.2亚型(calcium channel subtype 1.2,L-type,CaV1.2)、慢激活延迟整流钾通道(slowly activating delayed rectifier potassuim channel,Iks, KV7.1)、超快延迟整流钾通道(ultra-rapid delayed rectifier potassium channel,IKur,KV1.5)、瞬时外向钾通道(transient outward potassium channel,Ito,KV4.3)、内向整流钾通道(inward rectifier potassium channel,Kir2.1)、ATP敏感性钾通道(ATP sensitive potassium channel,KATP)、钙通道3.2亚型(calcium channel subtype 3.2,T-type,Cav3.2)、乙酰胆碱敏感性钾通道(acetylcholine-sensitive potassium channel,KAch)、超极化激活的阳离子电流亚型2(hyperpolarization-activated cyclic nucleotide-gated ion channel subtype 2,HCN2)和HCN4以及多能干细胞诱导分化心肌细胞(induced pluripotent stem cell dericed cardiomyocyte,IPSC-CM)动作电位和心脏钠钙交换电流(Na+-Ca2+-exchanger,NCX)的作用,旨在观察调脉饮对上述离子通道的干预作用,探讨调脉饮抗心律失常作用的机制。
1 材料与方法
1.1 药物配制与分组
调脉饮配方颗粒由北京康仁堂药业有限公司生产,组成:太子参30 g、麦冬15 g、五味子10 g、香附10 g、香橼10 g、佛手10 g、乌药10 g、丹参10 g、川芎15 g、丹皮15 g、赤芍15 g。取10 mg的中药配方颗粒加入10 mL细胞外液中震荡溶解,40℃超声后,用0.22微米滤膜过滤,配置成高剂量组(1 mg/mL),再将1 mg/mL浓度的待测液体进行10倍稀释配置成低剂量组(0.1 mg/mL),药品在溶液中全部溶解,没有肉眼可见的沉淀。
1.2 细胞培养
1.2.1 离子通道稳定表达的HEK293细胞和CHO细胞系 hERG、CaV1.2、NaV1.5、KV7.1、CaV3.2、 KV1.5、 KV4.3、 Kir2.1、KAch、KATP、HCN2、HCN4等心脏离子通道均通过基因克隆方式,在HEK293和CHO细胞系中进行过表达。过表达的细胞系和基因信息见表1。所有细胞系由北京爱思益普生物科技股份有限公司提供。
稳定表达上述离子通道的HEK293或CHO细胞系在含有10%胎牛血清的培养基中培养,简言之,除去旧培养基并用PBS洗细胞后,然后加入1 mL 0.25%-Trypsin-EDTA溶液 (hERG-HEK293细胞消化使用TrypLETMExpress),37℃孵育1 分钟,将细胞接种于6 cm细胞培养皿,每个细胞培养皿,接种细胞量为2.5×105(最终体积:5 mL)。为维持细胞的电生理活性,细胞密度必须不能超过80%。实验之前细胞用0.25%-Trypsin-EDTA分离,将5×103细胞铺到盖玻片上,在24孔板中培养(最终体积:500 μL),18 小时后,进行实验检测。

表1 各离子通道稳定表达的细胞系
1.2.2 干细胞诱导分化心肌细胞 调脉饮对心肌细胞动作电位及钠钙交换(NCX)电流在干细胞诱导分化心肌细胞上进行,干细胞诱导分化心肌细胞购买于南京柏寿生物科技有限公司(Cauliscell,批号:2016-4-5),按照Cauliscell的心肌细胞处理标准流程进行。程序如下:干细胞诱导分化心肌细胞不可传代培养, 每次检测需从液氮中复苏;将冻存的干细胞诱导分化心肌细胞从液氮中取出,置于37℃水浴中快速溶解,将细胞管移到超净工作台中,用移液器将细胞轻轻转移至5 mL培养基中;200 g室温下离心五分钟, 去掉上清后有培养基重悬细胞;提前24小时用0.1% Gelatin铺板,细胞接种于铺12 mm细胞爬片的24孔板内,密度62500个/孔;将种植细胞的24孔板放回37℃并含有5%CO2的细胞培养箱中,每隔2天换一次培养液,大约1周后可观察到自发跳动的细胞,此时可以将细胞用于电生理记录。
1.3 电生理记录[11]
用微电极拉制仪(P97,Sutter Instruments)将毛细玻璃管(BF150-86-10,Sutter Instruments)拉制成记录电极。在倒置显微镜(IX71,Olympus&AE31E,Motic)下操纵微电极操纵仪(MP285,Sutter Instruments&86PW420600&,MCI ),将记录电极接触到细胞上,给予负压抽吸,形成G欧姆封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻,不给予漏电补偿。当全细胞记录的电流稳定后开始从低浓度到高浓度梯度给药,每个药物浓度作用至5分钟后检测下一个浓度,在记录期间独立重复检测多个细胞。所有电生理实验均在室温下进行。按已发表文献配置需要检测离子通道的细胞外液及电极液,具体溶液组成及通道电流刺激程序见表2。
1.4 数据分析


表2 各种通道使用细胞内外液以及检测方法

续表
1.5 统计学处理
2 结果
2.1 调脉饮颗粒对心脏多种离子通道的作用
结果显示,0.1 mg/mL调脉饮颗粒显著抑制CaV3.2(18.94%±2.19%)和NCX(28.46%±9.74%)电流,1 mg/mL调脉饮颗粒显著抑制hERG(43.29%±0.09%)、CaV3.2(34.72%±0.61%)、KATP(38.44%±2.67%)、HCN4(30.64%±1.94%)和NCX(64.25%±25.29%)电流,并显著增加缓慢延迟复极钾通道KV7.1(34.49%±4.53%),差异有统计学意义(P<0.05),见表1和图1。
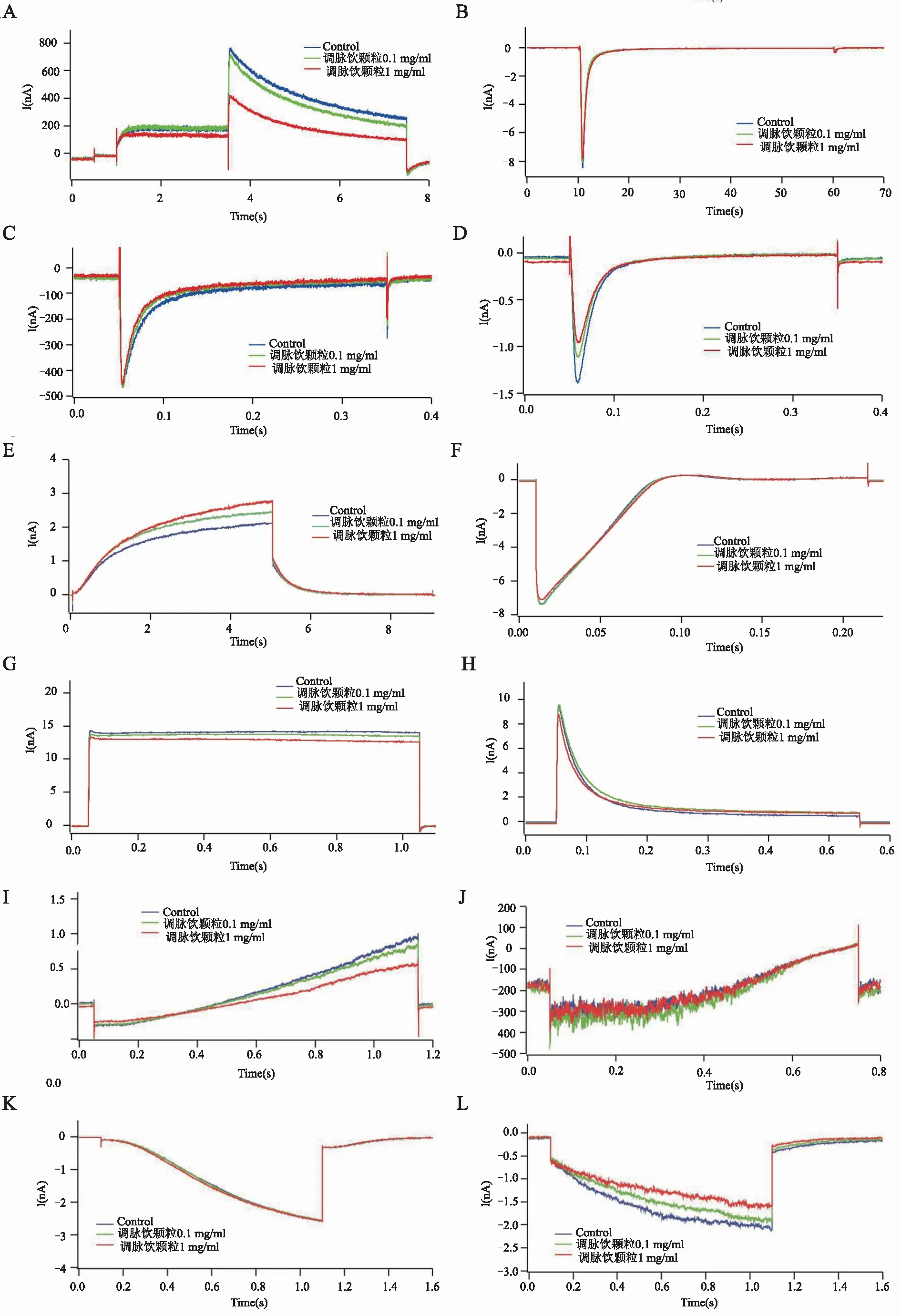

注:(A)hERG钾通道、(B) 钠通道(NaV1.5)、(C)L-型钙通道(CaV1.2)、(D)T型钙通道(Cav3.2)、(E)慢激活延迟整流钾通道(KV7.1)、(F)内向整流钾通道(Kir2.1)、(G)超快激活延迟整流钾通道(KV1.5)、(H)瞬时外向钾通道(KV4.3)、(I)ATP敏感钾通道(KATP)、(J)乙酰胆碱依赖钾通道(KAch)、(K)超极化激活的阳离子流HCN2、(L)超极化激活的阳离子流和HCN4、(M)干细胞诱导分化心肌细胞NCX电流。
图1 调脉饮颗粒对心脏离子各通道作用的原始电流图
2.2 调脉饮颗粒对干细胞诱导分化心肌细胞动作电位的作用
0.1 mg/L和1 mg/L调脉饮颗粒对心脏动作电位幅度(APA)和最大去极化速度(dv/dtmax)均无显著影响。0.1 mg/L调脉饮颗粒对APD30、APD50和APD90无显著影响,但是1 mg/L调脉饮颗粒显著延长动作电位时程APD30、APD50和APD90。调脉饮颗粒引起的心肌动作电位时程延长,可以延长心脏的有效不应期,从而产生抗心律失常效应。0.1 mg/L和1 mg/L调脉饮颗粒对心脏静息电位(RMP)无显著影响,轻微增加心肌细胞搏动频率,P>0.05。
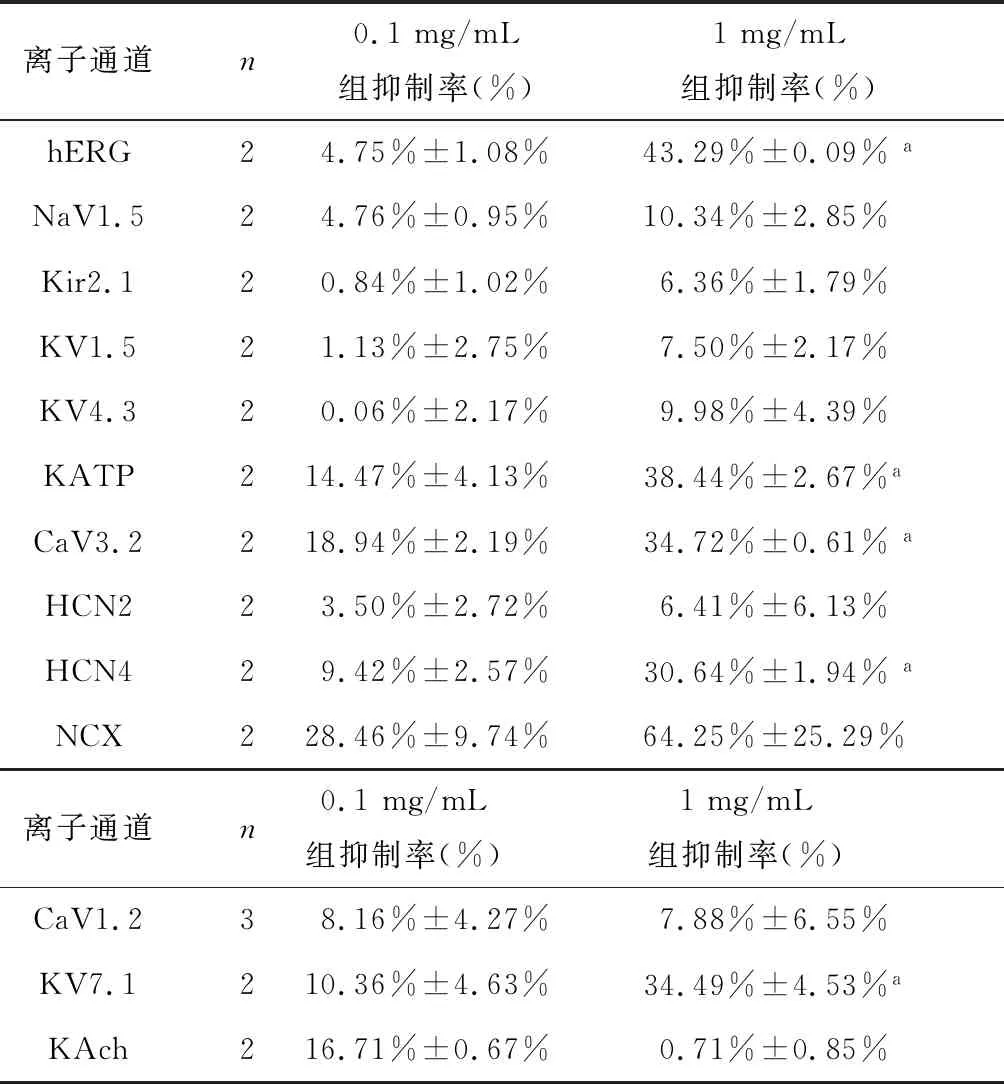
表3 0.1 mg/mL及1 mg/mL调脉饮颗粒对各离子通道的作用

表4 不同浓度调脉饮颗粒对IPSC诱导分化心肌细胞动作电位的影响
3 讨论
调脉饮是长期临床实践中总结出来的治疗快速性心律失常的有效方剂,其在动物模型和心肌细胞的作用已经得到充分的验证[1,2,4],但是,其抗心律失常的作用靶点和作用机制尚未得到充分的研究。本研究首次运用膜片钳技术,重组心脏离子通道表达技术和人IPSC诱导分化心肌细胞技术,筛选了调脉饮抗心律失常作用的靶点,并研究了调脉饮对人IPSC诱导分化心肌细胞的影响,从而深入探讨调脉饮的抗心律失常机理。
心脏离子通道参与动作电位的形成,目前明确的与心肌动作电位发生相关的离子通道包括钠通道(电压门控钠通道亚型—NaV1.5)、钙通道(电压依赖性L型钙离子通道—CaV1.2、T型钙通道—CaV3.2)以及多种钾通道(心肌细胞超快延迟整流钾通道(ultra-rapid delayed rectifier potassium channel,IKur,KV1.5)、瞬时外向钾通道(transient outward potassium channel,Ito,KV4.3)、内向整流钾通道(inward rectifier potassium channel,Kir2.1)、ATP敏感性钾通道(ATP sensitive potassium channel,KATP)、钙通道3.2亚型(calcium channel subtype 3.2,T-type,Cav3.2)、乙酰胆碱敏感性钾通道(acetylcholine-sensitive potassium channel,KAch)等。心脏动作电位的产生是心脏离子通道顺序活动产生的结果,因此,调节心脏离子通道的活动,是多数抗心律失常药物最主要的作用机理。本研究利用膜片钳技术,发现调脉饮对hERG (IKr)钾通道、NCX钠钙交换电流具有明显的抑制作用;对ATP敏感钾电流、CaV3.2钙电流和HCN4窦房结起搏电流具有中度的抑制作用;同时可以增加缓慢延迟复极钾电流IKs (KV7.1)。课题组推测调脉饮抗心律失常主要通过抑制Na-Ca交换蛋白(NCX)和抑制hERG通道发挥作用。由于其抑制hERG电流的同时显著增加IKs电流,IKs电流的增加可能抵消抑制hERG通道引起的过度动作电位时程延长和QT间期延长。因此,从作用机制上,相对于一般的III类抗心律失常药物(钾通道阻断剂),调脉饮可能具有更好的安全性。由于其抑制CaV3.2电流和HCN4电流,可能引起心率降低,对心力衰竭患者可能有帮助作用。另外,调脉饮对KATP的抑制作用,可能还具有心肌缺血的保护作用。本研究中观察调脉饮对IPSC-CM动作电位的直接作用,结果显示调脉饮颗粒可引起心肌动作电位时程延长,延长心脏有效不应期,从而产生抗心律失常效应。
本研究中应用的人源性干细胞诱导分化心肌细胞(IPSC-CM)研究,是评价药物对心肌细胞作用的新技术,其特点是人源性细胞,没有种属差异,因此更加能够预测药物对心律失常的作用;同时IPSC-CM比较容易获得,不受细胞来源限制,因此正在被广泛的用于心脏药物筛选及早期心脏复极毒性评价[13]。结果提示,1mg/L调脉饮颗粒显著延长动作电位时程APD30、APD50和APD90。延长动作电位时程和动作电位有效不应期,是很多III类抗心律失常药物如多菲利特、胺碘酮等的主要作用机理,也可能是调脉饮发挥抗心律失常作用的机制。但是,III类抗心律失常药物如多菲利特,由于强烈抑制hERG通道,因此同时具有较强的致QT延长及尖端扭转性室性心动过速的风险。而调脉饮颗粒是通过多离子通道靶点发挥作用,其抑制hERG通道的同时,增加缓慢延迟复极钾电流(KV7.1),从而可能抵消hERG通道引起的尖端扭转性室性心动过速的风险。
总之,传统方剂抗心律失常的靶点和机理发现,一直是一个研究难题。本研究发现调脉饮延长IPSC-CM动作电位时程和对NCX、hERG通道电流的抑制作用可能是其抗心律失常作用的主要机制,抑制CaV3.2钙电流和HCN4窦房结起搏电流,可能引起降低心率的作用,增强KV7.1电流可能抵消抑制hERG通道引起的过度动作电位时程延长和QT间期延长,其对KATP的抑制作用可能起到心肌缺血的保护作用。本研究进一步证明了调脉饮是通过抑制心肌多种离子通道,延长动作电位时程,延长有效不应期,从而发挥抗心律失常作用,为调脉饮的抗心律失常作用和临床应用提供了重要的理论依据。

