重组结核杆菌融合蛋白(EC)产品质量标准的建立
张凯 沈小兵 陶立峰 韦芬 陈保文 仇晶晶 陈伟 卢锦标 朱银猛 程兴 钟再新 赵爱华 蒲江
质量标准的建立、研究及评估是新药研究的主要内容之一。新药研发过程中需要结合产品特性,对其质量进行系统和深入的研究,并由此制定出合理和可行的质量标准,以确保药品质量的稳定、安全及有效性。重组结核杆菌融合蛋白(EC)[该制品名称是国家药典委员会确定的药品中文通用名称,“EC”为重组融合蛋白“结核分枝杆菌早期分泌性抗原靶6(ESAT-6)和培养滤液蛋白10(CFP-10)”](简称“EC”)是安徽智飞龙科马生物制药有限公司生产的一种新型皮肤试验体内诊断试剂,可以用于检测结核分枝杆菌感染、辅助结核病临床诊断、鉴别卡介苗(BCG)接种与结核分枝杆菌感染。同时,可与结核菌素纯蛋白衍生物联合用于不同免疫与感染背景BCG接种者筛选。本研究建立了重组EC原液及成品的质量控制(简称“质控”)方法和质量标准,并对EC原液和成品进行了检定,现报告如下。
材料和方法
一、材料及试剂
1.实验材料:EC原液及成品均由安徽智飞龙科马生物制药有限公司研制,其中,EC原液共6批次,批号分别为M20170902、M20170903、M20171001、M20171101、M20171102、M20171201;EC成品共11批次,0.3 ml/瓶(15 U)规格的批号分别为20171102、20171205、20171208、20180102;0.5 ml/瓶(25 U)规格的批号分别为20171101、20171204、20171205、20180101;1.0 ml/瓶(50 U)规格的批号分别为20171203、20171206、20171209。
2.实验动物:无特定病原体(specific pathogen free,SPF)级白色豚鼠,体质量300~400 g,共21只,其中雌性豚鼠18只,购自北京维通利华实验动物技术有限公司。
3.实验菌株:BCG活菌菌液,浓度为1 mg/ml,由安徽智飞龙科马生物制药有限公司制备。结核分枝杆菌减毒株H37Ra活菌菌液,浓度为2 mg/ml,由复旦大学三级安全防护实验室提供。
4.主要试剂:TB-PPD购自北京祥瑞生物制品有限公司;EC原液效力评价用参考品、EC成品效力评价用参考品及EC原液理化检定用参考品均由安徽智飞龙科马生物制药有限公司提供;增强型辣根过氧化物酶(HRP-DAB)底物显色试剂盒为天根生化科技(北京)有限公司产品;滤纸和硝酸纤维素膜为德国Millipore公司产品;EC兔多抗由中国食品药品检定研究院提供;辣根过氧化物酶标记山羊抗兔IgG为北京中杉金桥生物技术有限公司产品;大肠埃希菌宿主残留蛋白检测试剂盒购自美国Cygnus公司;卡那霉素残留量检测试剂盒购自北京勤邦生物技术有限公司。
二、质量标准的建立
(一)EC原液质量标准的建立
EC原液中“残余抗生素活性”“致敏效应试验”“效价测定”及“动物法鉴别实验”方法及标准为本研究自建方法,其余检测项依据《中国药典》2015年版(三部)建立。
1.残余抗生素活性检测:分别吸取卡那霉素残留量检测试剂盒中标准品和EC原液20 μl加至酶标板的微孔中,标准品和EC原液均做2个平行孔,然后加入酶标二抗50 μl/孔,再加入抗体工作液80 μl/孔,振荡混匀,25 ℃避光反应40 min。洗涤液洗板5次。分别以50 μl/孔加入底物液A液、底物液B液,25 ℃避光反应15 min。若显色颜色较浅,可适当延长反应时间到20 min,但不得超过25 min,反之则减短反应时间。以50 μl/孔加入终止液终止反应。用酶标仪在双波长450/630 nm处测定吸光度值(A值),以标准品溶液的A值为纵坐标,以标准品相应的浓度为横坐标制备标准曲线,求得参数拟合曲线方程。
采用连续3批EC原液对上述建立的方法进行专属性、线性与范围、准确性、重复性、中间精密度和耐用性等验证。(1)专属性实验:分别应用EC原液的稀释剂[磷酸盐缓冲溶液(PBS)]和0.0 ng/ml的标准品,按照上述建立的方法进行检测,比较两者之间的A值。(2)线性与范围实验:取试剂盒中浓度为0.0 ng/ml、0.5 ng/ml、1.5 ng/ml、4.5 ng/ml、13.5 ng/ml、40.5 ng/ml的卡那霉素标准品进行试验,所得数据进行回归分析并计算拟合优度的判定系数R2。(3)准确性实验(回收率):取EC原液,首先将本品原液等体积加入13.5 ng/ml卡那霉素标准品,作为加入卡那霉素标准品的样品,每个样品重复测定2次A值;将A值的平均值代入标准曲线回归方程求得卡那霉素浓度,计算回收率,回收率=(加入卡那霉素标准品(13.5 ng/ml)的EC原液样品的卡那霉素浓度测定值×2-EC原液的卡那霉素浓度测定值)/加入卡那霉素标准品理论浓度值(13.5 ng/ml)×100%。(4)重复性实验:取EC原液,按照上述建立的方法对每批原液重复测定6次,根据每批原液测得的A值进行数据分析。(5)中间精密度实验:同一名实验员不同时间,以及不同实验员分别取EC原液按照上述建立的方法进行实验,得到不同条件下EC原液中卡那霉素的浓度,对此数据进行分析。(6)耐用性实验:取连续3批EC原液按照上述建立的方法进行实验;在双波长450/630 nm处测定A值时,连续检测3次,每次间隔5 min,根据不同条件下标准曲线的拟合优度的判定系数R2及EC原液中卡那霉素的浓度进行数据分析。
2.致敏效应实验:实验组与对照组分别选用体质量300~400 g SPF级白色豚鼠各3只(雌雄不限),实验组每只豚鼠皮内注射0.1 ml 含5 μg 蛋白的EC原液稀释溶液,共3次,每次间隔5 d。在第3次注射后15 d,实验组与对照组每只豚鼠各皮内注射0.1 ml含5 μg 蛋白的EC原液稀释溶液,连续观察3 d,比较两组动物全身反应及注射部位局部反应。
3.效价测定:选取2批次EC原液参考品(批号分别为M20101202和M20160301),分别稀释至1 μg/ml(5 U/ml)、2.5 μg/ml(12.5 U/ml)、5 μg/ml(25 U/ml)及10 μg/ml(50 U/ml)等4个稀释度,根据剂量效应曲线确定合适的稀释度建立效价测定的方法。建立的检测方法为:取6只经TB-PPD皮肤试验阴性的300~400 g SPF级雌性豚鼠,于每只豚鼠大腿腹股沟内侧皮下注射结核分枝杆菌减毒株H37Ra活菌菌液0.5 ml,致敏5周后备用;将EC原液效力评价用参考品稀释为2.5 μg/ml(12.5 U/ml)、5 μg/ml(25 U/ml)及10 μg/ml (50 U/ml),将EC原液稀释为2.5 μg/ml、5 μg/ml及10 μg/ml;取上述6只经结核分枝杆菌减毒株H37Ra活菌致敏5周后的豚鼠,去毛后每只豚鼠于背部脊柱两侧以轮圈法分别皮内注射上述3种稀释度EC原液及参考品各0.2 ml,于注射后24 h测量局部反应硬结或红晕的纵径和横径(以硬结或红晕反应大者为准)。统计6只豚鼠每个稀释度注射后24 h硬结或红晕平均直径总和,并求每个稀释度EC原液与相应稀释度参考品的硬结或红晕平均直径总和的比值。
4.动物法鉴别实验:取4只经TB-PPD皮肤试验阴性的体质量300~400 g SPF级雌性豚鼠,于每只豚鼠大腿腹股沟内侧皮下注射BCG菌液0.2 ml,致敏4周后备用;取上述致敏4周后的豚鼠背部脊柱两侧去毛,以轮圈法于豚鼠去毛部位皮内分别注射0.2 ml 20 μg/ml稀释后的EC原液与50 IU/ml TB-PPD,于注射后48 h观察并测量TB-PPD皮肤试验的硬结平均直径和EC原液的硬结或红晕平均直径(以硬结或红晕反应大者为准),根据48 h的反应结果进行判定。
5.其他检测项目:EC原液外观、蛋白质含量、纯度(电泳法)、纯度(高效液相色谱法)、分子量、等电点、紫外光谱、肽图、N-端氨基酸序列、外源性DNA残留量、宿主菌蛋白质残留量、鉴别实验(免疫印迹法)、细菌内毒素检查、无菌检查的质控方法和标准按照《中国药典》2015年版(三部)内容建立。
(二)EC成品质量标准的建立
EC成品中“鉴别实验”及“效价测定”方法及标准为本研究自建方法,其余检测项依据《中国药典》2015年版(三部)建立。
1.鉴别实验:取4只经TB-PPD皮肤试验阴性的体质量300~400 g SPF级雌性豚鼠,于每只豚鼠大腿腹股沟内侧皮下注射BCG菌液0.2 ml,致敏4周后备用;取上述致敏4周后的豚鼠背部脊柱两侧去毛,以轮圈法于豚鼠去毛部位皮内分别注射0.2 ml EC成品与50 IU/ml TB-PPD,于注射后48 h 观察并测量TB-PPD皮肤试验的硬结平均直径和EC成品的硬结或红晕平均直径(以硬结或红晕反应大者为准),根据48 h的反应结果进行判定。
2.效价测定:参照EC原液效价测定方法。
3.其他检测项目:EC成品外观、可见异物、装量、渗透压摩尔浓度、不溶性微粒检查、pH值、苯酚含量、无菌、异常毒性检查的质控方法和标准参照《中国药典》2015年版(三部)建立。
(三)质量标准的验证
应用建立的质量标准,对连续6批次EC原液和11批次EC成品进行检测,验证其适用性和可行性。
三、统计学处理
结 果
一、EC原液质量标准的建立和验证
(一)残余抗生素活性检测
1.专属性实验:PBS溶液的A值为1.736,卡那霉素标准品(0.0 ng/ml)的A值为2.178。
2.线性与范围实验:卡那霉素标准品在0.5~40.5 ng/ml范围内,连续3次实验回归方程拟合优度的判定系数R2均大于0.99。
3.准确性实验:连续3批EC原液的卡那霉素残留量回收率分别为112.163%、117.285%、103.527%,回收率均在80%~120%之间。
4.重复性实验:连续3批EC原液分别测定6次,A值分别为1.754±0.098、1.783±0.164、1.781±0.144,重复性试验A值相对标准偏差(RSD)分别为5.59%、9.18%、8.07%,RSD均小于20%。
5.中间精密度实验:同一实验员不同时间及不同实验员检测连续3批EC原液,卡那霉素残留量均小于定量限0.5 ng/ml,为限量测定。
6.耐用性实验:改变读板时间(0、5、10 min)对EC原液卡那霉素残留量检测无影响,3批原液各个读板时间检测的卡那霉素残留量均小于定量限0.5 ng/ml。
7.质量标准的验证:连续6批次EC原液卡那霉素残留量的检测结果见表1,检测结果均低于定量限0.5 ng/ml,为限量测定,表明该方法适合用于EC原液卡那霉素残留量的测定。

表1 连续6批次EC原液残余抗生素检测结果
(二)致敏效应实验
根据已建立的质量标准,对连续6批次EC原液进行致敏效应试验,皮肤试验后连续3 d实验组及对照组动物注射部位局部反应无明显区别,两组动物也无全身反应。
(三)效价测定
1.质量标准的建立:2批次EC原液参考品的每个稀释度皮肤试验的硬结或红晕平均直径均≥8 mm,当稀释度为2.5 μg/ml(12.5 U/ml)、5 μg/ml(25 U/ml)及10 μg/ml(50 U/ml)时,批次间差异无统计学意义;2个批次EC原液参考品每个稀释度皮肤试验的硬结或红晕平均直径总和比值均在1.0±0.2范围之内,见表2。
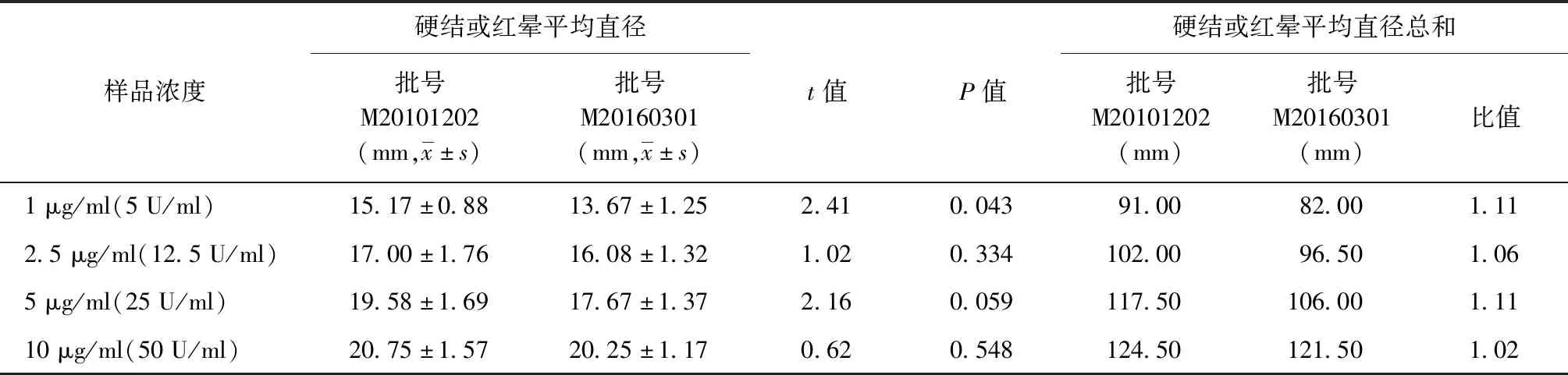
表2 不同浓度各批次EC原液效价测定结果的比较
2.质量标准的验证:对连续6批次EC原液效价进行测定,结果表明2.5 μg/ml(12.5 U/ml)、5 μg/ml(25 U/ml)及10 μg/ml (50 U/ml)每个稀释度在注射后24 h所产生的局部反应硬结或红晕的平均直径均≥8 mm;每个稀释度本品与相应稀释度参考品的局部硬结或红晕反应平均直径总和的比值为0.9±0.1,均在1.0±0.2范围内。
(四)动物法鉴别实验
1.质量标准的建立:连续3个批次重组EC原液的动物实验结果(硬结或红晕平均直径)为0,TB-PPD 硬结平均直径为(15.13±5.06) mm。
2. 质量标准的验证:连续6批次EC原液对BCG活菌致敏组豚鼠的皮肤试验均呈阴性反应(硬结或红晕平均直径<5 mm),而TB-PPD对BCG活菌致敏组豚鼠的皮肤试验呈阳性反应(硬结平均直径≥5 mm)。
(五)其他项目检测
对连续6批次EC原液进行其他检项的验证,结果见表3。

表3 理化、生化、纯度、安全等指标检测EC原液的结果
二、EC成品质量标准的建立和验证
1.质量标准建立:连续3批次EC成品的动物皮肤试验结果(硬结或红晕平均直径)为0,TB-PPD硬结平均直径为(16.50±2.65) mm。
2.质量标准的验证:连续3种不同规格11批次EC成品对BCG活菌致敏组豚鼠的皮肤试验均呈阴性反应(硬结或红晕平均直径<5 mm),而TB-PPD 对BCG活菌致敏组豚鼠的皮肤试验均呈阳性反应(硬结平均直径≥5 mm)。
3.其他项目检测:根据已建立的质量标准,对3种不同规格连续11批次EC成品进行其他项目的检定,结果见表4。

表4 成品理化、生化、纯度等指标检测EC的结果
讨 论
药品的质量研究和质量标准的制定是药物研发的主要内容之一。科学、合理、可行的质量标准直接关系到药品质量的安全性、有效性和可控性[1]。确定质量研究内容时应根据产品的特性,采用多批次生产工艺稳定的样品进行,使得质量研究的内容能够充分反映药品的特性及质量变化情况。
EC是一种新型皮肤试验体内诊断试剂,属于国家一类新药,目前已获得药品注册批件。在质量标准的制定过程中,由于尚无相应的检定标准,本品质量标准的建立不仅参考了《中国药典》2015年版(三部)、《生物制品质量控制分析方法验证技术一般原则》等文件;而且,也结合了本产品的特性,从安全性、有效性等方面自建了部分检测项目。由于本品在种子液的制备过程中加入了卡那霉素,故从安全性角度考虑,在EC原液检测项中新建了“残余抗生素活性测定”方法。EC为单一重组的相对分子质量为23 000的蛋白产品,并且属于体内注射生物制品。根据该蛋白性质,理论上存在可能的致敏效应,可能会影响到受试者的生命健康。故从安全性角度考虑,在EC原液检测项中新建了“致敏效应实验”方法。本品的特性类似于结核菌素纯蛋白衍生物等产品,是通过皮肤试验的局部反应来进行结果判断的,故从有效性方面考虑,在EC原液及成品检测项中又新建了“效价测定”及“鉴别实验”的方法。
在对本品自建的质量标准中,EC原液检测项中“残余抗生素活性测定”和“效价测定”则经过了相关方法学的验证。其中,“残余抗生素活性测定”方法,通过了专属性、线性与范围、准确性试验、重复性、中间精密度和耐用性等验证。专属性验证,结果表明EC原液的稀释剂——PBS溶液不会影响到该方法测定的结果。线性与范围验证结果表明本法线性较好,EC原液卡那霉素残留量在0.5~40.5 ng/ml范围内可定量测定,即定量限为0.5 ng/ml;当卡那霉素残留量低于0.5 ng/ml时应为限量测定,表示为小于0.5 ng/ml。准确性验证结果表明本品对卡那霉素残留量的检测没有影响。重复性验证结果表明重复性良好。中间精密度验证结果表明同一实验员不同时间和不同实验员检测连续3批次样品卡那霉素残留量均低于定量限0.5 ng/ml,实验的中间精密度良好。耐用性验证结果表明改变读板时间对重组EC原液卡那霉素残留量检测无影响,耐用性良好。综上,通过卡那霉素残留量测定方法的验证,表明该方法适合用于EC原液残余抗生素活性的测定。另外,EC皮肤试验可诱导结核分枝杆菌感染者产生局部特异性红晕或硬结反应,阳性者中存在红晕大于硬结或硬结大于红晕现象,不能单独以红晕或者单独以硬结作为阳性判定标准。因此,EC宜以注射部位的红晕或硬结反应大者为阳性反应判断标准。在本研究中,笔者选取2批次EC原液参考品的4个稀释度进行了效价测定方法的建立。结果表明,每个稀释度在皮内注射后24 h所产生的局部硬结或红晕平均直径均≥8 mm,且2批次EC原液参考品的每个稀释度在注射后24 h所产生的硬结或红晕平均直径总和的比值均在1.0±0.2范围内;但稀释度为1 μg/ml(5 U/ml)时,两批次EC原液参考品在注射后24 h所产生的硬结或红晕平均直径的差异有统计学意义,考虑实验结果的敏感度最终选择EC原液效价测定的稀释度为2.5 μg/ml(12.5 U/ml)、5 μg/ml(25 U/ml)及10 μg/ml (50 U/ml)等3个稀释度。
EC是由高效表达结核分枝杆菌ESAT-6与CFP-10基因的大肠埃希菌,经发酵、分离和纯化后获得的。由于BCG不含有ESAT-6和CFP-10这2个基因片段,而皮肤试验用试剂TB-PPD又存在于BCG及结核分枝杆菌中,因此,EC原液及成品的“鉴别实验”均选取BCG活菌进行动物的致敏,并最终通过TB-PPD的皮肤试验反应进行鉴别。在此方法的建立过程中,笔者选取连续3个批次EC原液及连续3个批次的EC成品进行动物实验,结果表明EC原液及成品对BCG活菌致敏组豚鼠的皮肤试验均呈阴性反应,而TB-PPD对BCG活菌致敏组豚鼠的皮肤试验均呈阳性反应。EC成品的“效价测定”方法是参照EC原液“效价测定”方法建立的,由于EC原液“效价测定”选取了2.5 μg/ml(12.5 U/ml)、5 μg/ml(25 U/ml)及10 μg/ml (50 U/ml)3个稀释度;而EC成品的浓度为10 μg/ml (50 U/ml),故该浓度适合成品的“效价测定”。
为了验证已建立的质量标准检测方法科学、合理及可行性,笔者依据已建立的方法,又进行了连续6批次EC原液和3种不同规格连续11批次成品的检定,所有检测结果均符合制定的质量标准,表明建立的质量标准适用于该产品的检定。

