重组结核杆菌融合蛋白(EC)临床应用专家共识
中国防痨协会 中国防痨协会学校与儿童结核病防治专业分会 《中国防痨杂志》编辑委员会
结核分枝杆菌(MTB)感染和菌阴肺结核的准确诊断是结核病防控的两个难点和重要问题。重组结核杆菌融合蛋白(EC)[该制品名称是国家药典委员会确定的药品中文通用名称,“EC”为重组融合蛋白“结核分枝杆菌早期分泌性抗原靶6(ESAT-6)和培养滤液蛋白10(CFP-10)”](简称“EC”)是通过基因工程方法表达MTB特异的ESAT-6和CFP-10两种蛋白的融合蛋白,这两种蛋白在卡介苗菌株中缺失,可诱导特异的迟发型变态反应(DTH)以鉴别MTB感染状态。在传染病国家科技重大专项支持下自主研发的EC,已作为新型MTB感染皮肤试验的检测试剂通过了国家药品监督管理局药品审批而准予上市。在当前我国结核病疫情防控形势下,EC对MTB感染和菌阴肺结核的诊断具有重要的应用价值。经广泛征求有关结核病防控、临床和研究等领域的专家意见,在系统总结相关技术、方法和应用特点的基础上,结合EC的临床试验结果,形成《重组结核杆菌融合蛋白(EC)临床应用专家共识》。
一、全球结核病疫情形势
结核病是由MTB感染引起的慢性传染病,严重威胁人类健康,位列全球十大死因之一,是单一传染病中的头号杀手[1]。据WHO[1]发布的2019年全球结核病报告,在2018年,全球估算有1000万例新发结核病患者,结核病平均发病率为130/10万。耐药结核病仍然是一项全球公共卫生危机。2018年全球新增约48.6万例利福平耐药结核病患者(其中78%为耐多药结核病)。2018年估算全球因结核病死亡患者共有149.1万例。在全球范围内,2000—2018年间,结核病发病率的平均下降率每年仅为1.6%,2015—2018年间累积下降率为6.3%,该下降速度与终止结核病战略设定的2015—2020年间实现发病率下降20%的目标还相差甚远。
中国是结核病高负担国家之一。据WHO[1]估算,2018年中国结核病发病患者例数为86.6万(发病率为60/10万),占全球发病例数的8.7%,位于全球第二位;估算耐利福平患者为6.6万例,占全球的14%;因结核病而死亡患者为3.7万例,死亡率为2.6/10万。2000年全国结核病流行病学抽样调查对66 456名调查点人群进行结核菌素皮肤试验(TST)检查,硬结平均直径≥10 mm者占28.3%[2],按照国际上将硬结平均直径≥10 mm与γ-干扰素释放试验(interferon gamma release assays,IGRA)阳性作为潜伏性结核感染(latent tuberculosis infection,LTBI)的诊断标准[3],估算全国结核感染人数为3.6亿。Gao等[4]在2013年对21 022名5岁以上农村常住人口进行LTBI的流行病学研究,调查对象中IGRA检测的阳性率为18.9%,据此估算全国结核感染人数为3.5亿。为此,研究结核感染诊断新技术、新方法对加速结核病疫情下降、实现终止结核病目标具有十分重要的意义。
二、结核感染与发病
LTBI的定义是一种对MTB抗原刺激具有持续免疫反应的状态,但没有活动性结核病的临床表现证据,有时也叫结核感染[5]。LTBI没有病原学诊断依据,只能通过检测机体的免疫反应来诊断[6]。LTBI人群是一个庞大的潜在患者库,LTBI者中平均5%~10%的人会在一生中发生活动性结核病;对于HIV感染阳性的LTBI患者,其每年进展为活动性结核病的发病率约为10%,一生中约有50%的概率会发生活动性结核病[7]。这些新发患者再进一步传播产生新的感染者。2015年WHO[8]提出终止结核病策略,其目标是到2035年全球结核病发病率下降到10/10万以下,首次提出了要在高危人群中系统开展LTBI的检测和预防性干预,减少结核发病;并指出如果LTBI问题不解决,终止结核病目标不可能实现。《中国结核病预防控制工作技术规范(2020年版)》[9]将结核感染检测和预防纳入结核病预防治疗的重要内容。
结核病诊断的另一个瓶颈是菌阴肺结核的诊断,而儿童结核病多表现为菌阴肺结核。据统计,菌阴肺结核约占所有肺结核患者的70%左右[10]。我国发布的《WS 288—2017 肺结核诊断》[11]中,将TST、IGRA和血清抗体检测都纳入了肺结核辅助诊断的方法,其目的是通过提供结核感染证据提高菌阴肺结核的诊断水平。EC是主要针对解决LTBI诊断和菌阴肺结核的辅助诊断等问题而研发的新产品。
三、 现行结核感染的免疫学检测方法
人体是否感染了MTB,因没有检查方法和技术证实在机体隐匿的MTB,故一般说LTBI的诊断缺乏“金标准”[12]。通常,对LTBI的诊断,是通过检测机体对结核感染的特异性免疫,来反映机体是否受MTB感染。现行检测LTBI的免疫学诊断技术包括TST、IGRA和抗原抗体检测等。各种检测方法因其检测反应的原理不一致,临床使用特点也不相同。
(一) TST
TST是基于Ⅳ型DTH的一种皮肤试验,常用的反应原是纯蛋白衍生物(purified protein derivative,PPD)。TST的特点是操作简单,不需要特殊设备和实验室,是临床上广泛使用的辅助诊断的免疫学方法,是WHO[13]发布的对LTBI的筛查指南和我国发布的《儿童结核分枝杆菌潜伏感染筛查和预防性治疗专家共识》[14]均推荐的技术。我国1979—2000年进行的4次全国结核病流行病学调查都采用TST作为儿童结核感染筛查的手段[2,15-17]。在我国2017年公布的《WS 288—2017 肺结核诊断》[11]中,TST也作为菌阴肺结核的辅助诊断方法。由于PPD有200多种抗原成分,与卡介苗和非结核分枝杆菌(nontuberculous mycobacterium,NTM)有大量相同或相似的抗原成分,导致TST很容易发生交叉反应[18]。因此,TST出现假阳性的可能性较大,特别是在NTM的高流行地区。有专家认为,前次进行TST可能导致再次检查时出现假阳性结果[19],因此TST被认为不适合用于结核感染的连续监测。
(二)IGRA
机体感染MTB以后,血液中存在着特异的效应T 淋巴细胞。当机体再次接触MTB特异性抗原时,效应T 淋巴细胞将特异性地产生和分泌γ干扰素(IFN-γ),通过定量检测释放的IFN-γ的水平或计数,来判定患者是否存在LTBI[20]。IGRA检测采用分枝杆菌蛋白质的多肽抗原(包括ESAT-6、CFP-10和TB7.7),刺激效应淋巴细胞分泌IFN-γ,检测并定量分析IFN-γ的浓度,判断是否存在MTB特异性细胞免疫反应[21]。所有卡介苗菌株和绝大部分的NTM 都不含有这3种蛋白质[22],因此保障了其良好的检测特异度。该试验为体外免疫诊断试验,需要收集人体外周全血在实验室特定的仪器上进行检测;需要一定的实验室条件支撑,且高通量检测受限,基层大规模筛查存在一些困难;同时价格昂贵,在一定程度上限制了其使用。由于其特异度较高,在临床菌阴肺结核和肺外结核的个体确认方面具有较高的应用价值。有些国家在LTBI筛查中先用TST检测,对TST 阳性者再进行IGRA检测[23]。
(三) 抗原抗体检测
自1898年Arloing等检测血清结核抗体获得成功以来,人们一直没有停止对结核抗原抗体检测技术的研究[24]。结核抗体检测的基本原理是采用已知的结核特异性抗原,来检测待检标本中所含的特异性抗体。由于检测结核抗体的方法不同,仪器设备也不同,各产品的敏感度和特异度也不同[25]。该方法也已纳入我国《WS 288—2017肺结核诊断》[11],作为菌阴肺结核的辅助诊断技术。
四、EC临床试验研究
对EC研究的目的,旨在目前使用的免疫学诊断技术的基础上,研发出敏感度高、特异度强、操作简单、可用于LTBI和菌阴肺结核诊断的新产品和新技术。
(一) EC的生物学特征
EC系由大肠埃希菌高效表达MTB的ESAT-6与CFP-10的融合蛋白基因,经发酵、分离和纯化后获得的融合蛋白(EC蛋白)制成。ESAT-6蛋白和CFP-10蛋白具有良好的免疫活性,可以刺激T细胞增殖,诱导T细胞释放IFN-γ,诱发DTH。Lalvani[26]和Chapman等[27]对不同人群进行了ESAT-6蛋白的表位研究,结果发现ESAT-6具有多个T淋巴细胞表位,且大多为CD4表位。Spencer等[28]分析CFP-10抗原表位,按氨基酸序列合成18条肽段(P1~P18),相邻2个肽段重叠5个氨基酸,实验发现人类识别的T淋巴细胞表位较多。Lewinsohn等[29]的另一项研究表明,CFP-10蛋白还含有2个CD8+T细胞表位,即CFP-1085-94和CFP-102-11,这2个识别表位分别严格受限于人类白细胞抗原(HLA)-B14和HLA-B44型。抗原表位的研究表明ESAT-6和CFP-10蛋白均具有多个T细胞表位。
(二)EC制剂成分
本品主要成分为EC,含适宜稳定剂,不含抗生素。每1 ml含50 U重组EC的稀释制剂。辅料成分包括磷酸氢二钠、磷酸二氢钾、氯化钠、苯酚、聚山梨酯80。
(三) EC临床试验研究设计
根据《中华人民共和国药典(2010年版)》[30]有关要求,参照《人用重组DNA制品质量控制技术指导原则》[31]及相关标准,临床试验研究设计与评价基于以下原则:(1)该试剂应能诱导结核病患者产生DTH;与非结核病患者阳性检出率差异应有统计学意义,与功能相同的IGRA检测结果差异无统计学意义。(2)对EC、PPD、IGRA三种手段检测阴性人群接种卡介苗或安慰剂后,该试剂应不诱导产生DTH;对其中的卡介苗接种者,该试剂与PPD诱导产生DTH的阳性反应率差异有统计学意义,该试剂与功能相同的IGRA检测结果差异无统计学意义。(3)该临床研究入组人群与丹麦血清研究所(Statens Serum Institut,SSI)同类产品临床研究入组人群基本一致。包括结核病患者、卡介苗接种者与健康志愿者,评价标准也以临床诊断为基本标准,以TB-PPD和T-SPOT.TB检测为对照。
(四)不同方法检测的阳性结果判断标准
1. EC:0.1 ml(5 U),采取孟都法注射于前臂掌侧皮内,注射后48~72 h检查注射部位反应,测量并记录红晕和硬结的横径及纵径的长度(mm),以红晕或硬结大者为准,反应平均直径[(横径+纵径)/2)] ≥5 mm为阳性反应。凡有水疱、坏死、淋巴管炎者均属强阳性反应。
2. TST:采用TB-PPD 0.1 ml(5 U),采取孟都法注射于前臂掌侧皮内,注射后48~72 h检查注射部位反应,测量记录硬结的横径及纵径的长度(mm),以硬结为准,反应平均直径[(横径+纵径)/2)] ≥6 mm为阳性反应。凡有水疱、坏死、淋巴管炎者均属强阳性反应。
3. IGRA:采用T-SPOT.TB检查,根据抗原A和(或)抗原B孔的反应判断结果(抗原A:ESAT-6;抗原B:CFP-10);检测结果为“有反应性(阳性)”应参照以下标准判定:空白对照孔斑点数为 0~5 个时,且抗原A或抗原B孔的斑点数减去空白对照孔斑点数≥6;空白对照孔斑点数为6~10个时,且抗原 A 或抗原B孔的斑点数≥2倍空白对照孔斑点数。如果上述标准不符合且阳性对照孔符合质量控制标准时,检测结果为“无反应性(阴性)”。
五、EC临床试验研究结果
前期开展了Ⅰ、Ⅱ期临床试验评估EC的安全性,以及在人群中的耐受性研究,并在中国人群中进行了初步的剂量探索。在Ⅱ期临床试验中发现,EC的主要不良反应是局部瘙痒(8.3%,12/144)和疼痛(18.1%,26/144),没有严重不良反应发生。据此得出结论:EC用于诊断结核感染时受检者耐受性尚可且安全[32-33],在此基础上,进一步开展了Ⅲ期临床试验。
(一)健康人群流行病学筛查的阳性检出率
采用EC、TB-PPD和T-SPOT.TB对1559名健康受试者进行临床流行病学筛查对照试验,阳性检出率分别为10.46%(163/1559)、53.69%(837/1559)和19.11%(298/1559)。3种试剂检测结果两两一致率比较分析:EC与T-SPOT.TB、EC与TB-PPD,以及TB-PPD与T-SPOT.TB结果之间的阴性符合率分别为88.77%(1384/1559)、55.23%(861/1559)和58.24%(908/1559)。EC与T-SPOT.TB对健康人群筛查结果具有较高的一致性;TB-PPD受卡介苗接种和NTM影响,阳性率高。
(二)结核感染的敏感度试验
791例临床诊断为结核病患者的研究结果显示:EC的诊断敏感度为90.64%(717/791),T-SPOT.TB的诊断敏感度为91.15%(721/791),TB-PPD的诊断敏感度为90.90%(719/791)。EC与T-SPOT.TB间敏感度的差值(95%CI)为-0.51%(-2.39%~1.36%);EC与TB-PPD间敏感度的差值(95%CI)为-0.26%(-2.36%~1.80%),95%CI下限均大于-10%(表1)。3种方法均具有良好的敏感度,且3种方法相互之间一致性高。

表1 不同结核感染患者对3种检测方法的敏感度
(三)结核感染阴性结果的一致性检验
1564名健康受试者分别进行EC、T-SPOT.TB、TB-PPD检测。将479名3种方法检测均为阴性的人员作为未感染结核者;对318名接种卡介苗(2例结果缺失),161名接种卡介苗安慰剂。161名卡介苗安慰剂接种者重复检测的临床研究结果显示:EC 2次检测阴性结果的一致率为88.20%(142/161),T-SPOT.TB为93.17%(150/161),TB-PPD为60.87%(98/161)。EC与T-SPOT.TB间2次检测一致率的差值(95%CI)为-4.97%(-9.32%~-0.62%),95%CI下限大于-10%。EC与TB-PPD间特异度的差值(95%CI)为27.33%(19.25%~35.40%),95%CI下限大于0.00%。EC与T-SPOT.TB在未感染结核人群的阴性符合率高(特异度高),且两者之间的一致性高;受卡介苗接种和NTM感染的影响,在未感染结核人群中,TB-PPD的阴性符合率低(特异度低),TB-PPD与T-SPOT.TB、TB-PPD与EC的一致性差。
(四)卡介苗接种后诊断结核感染的特异度试验
将1564名健康受试者分别进行EC、T-SPOT.TB、TB-PPD检测,其中479名3种方法检测均为阴性人员中,有318名接种了卡介苗(2例结果缺失),161名接种了卡介苗的安慰剂。3个月后再次分别进行EC、T-SPOT.TB、TB-PPD检测,结果显示:EC在该人群中的阴性符合率为92.72%(293/316),T-SPOT.TB的阴性符合率为95.25%(301/316),TB-PPD的阳转率为73.42%(232/316),阴性符合率为26.58%(84/316)。EC与T-SPOT.TB阴性符合率的差值(95%CI)为-2.53%(-5.06%~0.00%),95%CI下限大于-10%。EC与TB-PPD间阴性符合率的差值(95%CI)为66.14%(60.76%~71.52%),95%CI下限>0.00%。该研究结果显示,EC、T-SPOT.TB基本不受卡介苗接种的影响;TB-PPD在卡介苗接种后阳转率高,在检测结核感染时特异度差,但是TB-PPD可用来监测卡介苗接种的效果。
(五)非结核性其他疾病患者的阴性符合率
394例临床诊断为非结核性其他疾病患者的临床研究结果显示:EC检测的阴性符合率为73.10%(288/394);T-SPOT.TB检测的阴性符合率为78.68%(310/394);TB-PPD检测的阴性符合率为59.64%(235/394)。
以上研究显示:EC、TB-PPD和T-SPOT.TB在进行结核病的辅助诊断及其他非结核性疾病的鉴别诊断时,EC和T-SPOT.TB特异度较TB-PPD高,且EC与T-SPOT.TB的一致性较好。
六、EC的临床应用建议
(一)使用对象
EC皮肤试验结果不受卡介苗接种的影响,适用于结核感染和辅助结核病的临床诊断。按照说明书推荐,适用于≥6月龄婴儿、儿童及<65周岁成人。
(二)使用方法
1.EC单独使用:吸取本品0.1 ml(5 U),采取孟都法注射于前臂掌侧皮内。注射后48~72 h检查注射部位反应,测量记录红晕和硬结的横径及纵径的长度(mm),以红晕或硬结大者为准,反应平均直径[横径+纵径)/2]≥5 mm为阳性反应。凡有水疱、坏死、淋巴管炎者均属强阳性反应。
2.EC与PPD联用:分别吸取EC 0.1 ml(5 U)与PPD 0.1 ml(5 IU),先采取孟都法于左前臂掌侧皮内注射EC,观察5 min无异常后在右前臂掌侧皮内注射PPD。于注射后48~72 h检查双臂注射部位反应。EC以红晕或硬结大者为准,PPD以硬结为准。测量记录红晕和硬结的横径和纵径的长度(mm),以红晕或硬结平均直径≥5 mm为阳性反应。凡有水疱、坏死、淋巴管炎者均属强阳性反应。
(三)结果判读和临床意义
1. 单独使用EC检测结果的临床意义:见表2。

表2 单独使用EC检测结果的临床意义
2. 同体双臂使用EC及PPD检测结果的临床意义:见表3。

表3 同体双臂使用EC和PPD检测结果的临床意义
(四)使用范围
1. LTBI筛查和流行病学调查:(1)结核病患者密切接触者(家庭、学校、医疗机构、社区、聚集性疫情等)的LTBI筛查。(2)在结核病高风险人群、重点人群[HIV感染人群、肿瘤坏死因子(TNF)拮抗剂使用人群、器官移植人群、血液透析人群、尘肺人群、糖尿病患者、风湿病患者、羁押人员、流浪者、外来务工人员、社区中老年人群、其他免疫力低下人群等]中的LTBI筛查。(3)全人群中LTBI的流行病学调查。
2. 肺结核和肺外结核的辅助诊断:EC检测的特异度高,对肺结核和肺外结核的辅助诊断具有较好的参考价值。因操作快速简便,适宜于各级医疗卫生机构开展肺结核诊断和鉴别诊断使用,提高肺结核诊断的准确性。
3. EC在预防性干预技术路径中的应用价值:通过联用EC与PPD,可以根据皮肤试验结果区分人群的MTB感染状态,解决了当PPD阳性时无法区分阳性是由于接种了卡介苗还是感染了MTB的弊端;这在结核病的预防人群分类中有较好的作用。这些人群包括卡介苗接种后仍然维持阳性者、阴转者和LTBI者。对结核病高发的卡介苗接种地区进行LTBI的筛查,需要简单易行的方法将结核病预防目标人群精准区分,为构建完整的结核病免疫预防治疗体系提供科学依据、创造可行性。
不同人群的结核感染状态不同,可通过EC+PPD的联合检测结果加以区分:(1)EC结果呈阳性、PPD阳/阴性者,将可通过化学药品预防和(或)使用已获批用于治疗LTBI的疫苗进行预防,防止结核感染者进一步发展成结核病;(2)对于EC结果呈阴性且PPD阴性者,使用成人卡介苗进行预防;(3)对于EC结果呈阴性且PPD阳性者,使用加强免疫用疫苗防止再感染MTB(图1)。
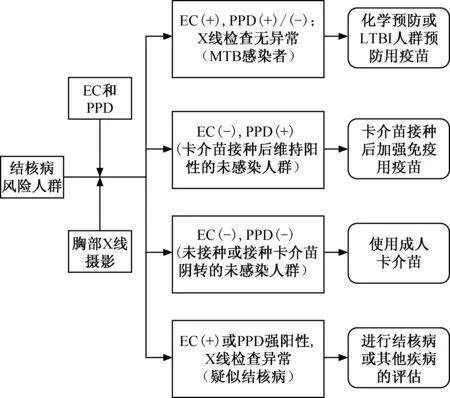
图1 预防结核病的人群分类及干预方法
七、展望
EC作为新型MTB感染皮肤试验的检测试剂,在人群中使用具有良好的安全性,诊断结核感染的敏感度和特异度均较高,检测技术成本较低、操作简单,可用于LTBI和菌阴肺结核的诊断。EC具备了其他结核感染检测方法的优点,同时作为一种皮肤检测试剂,不仅降低了LTBI筛查和流行病学调查的成本,而且易于在基层推广,这对结核病的控制有重大意义,在预防性干预技术路径中具有广阔的应用前景。EC上市是中国结核病防控体系的一个重大突破。但EC作为新产品和新技术在人群中的安全性和应用价值有待进一步观察和评估。同时EC在LTBI高危人群和<6月龄婴儿中的应用数据缺乏,在各种临床或其他因素造成免疫功能低下的人群,以及与肺结核患者密切接触的人群,其安全性和有效性尚有待进一步考证。
执笔者201508 上海市公共卫生临床中心(卢水华);210009 南京,江苏省疾病预防控制中心(陆伟)
参与讨论与撰写本共识的单位与作者(排名不分先后) 102629 北京,中国食品药品检定研究院(徐苗); 100176 北京,中国医学科学院病原生物学研究所(金奇、高磊);101149 首都医科大学附属北京胸科医院(初乃惠);100069 首都医科大学附属北京儿童医院(申阿东);200051 上海市疾病预防控制中心(沈鑫);200433 同济大学附属上海市肺科医院(沙巍);201508 上海市公共卫生临床中心(李涛、范小勇);300350 天津大学天津市海河医院(吴琦);210009 南京,江苏省疾病预防控制中心(朱凤才);410013 长沙,湖南省结核病防治所(白丽琼);230001 合肥,安徽省立医院(梅晓冬);400016 重庆医科大学附属第一医院(郭述良、黎友伦);430000 武汉金银潭医院(张定宇、黄朝林、魏明);430030 武汉市肺科医院(王卫华、袁保东);214073 江苏省无锡市第五人民医院(黄利华、欧勤芳);350008 福建省福州肺科医院(陈晓红);518112 深圳市第三人民医院(邓群益);212021 江苏省镇江市第三人民医院(潘洪秋);710100 西安,陕西省结核病防治院(仵倩红、贺晨艳)
学术秘书201508 复旦大学附属上海市公共卫生临床中心(杨恒)
指导专家肖和平 王国治

