结核分枝杆菌糖代谢的研究进展
屈孟锦 梁正敏 王元智 周向梅
结核病是由结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex),特别是结核分枝杆菌(Mycobacteriumtuberculosis,MTB)引起的慢性消耗性人畜共患病,是世界上最重要的致死性传染病之一[1]。尽管卡介苗(BCG)及抗结核药品如链霉素、异烟肼、利福平等相继问世,但是MTB与HIV双重感染,以及MTB耐药菌株的出现使得结核病的发病率和病死率仍然处于较高水平。据WHO[2]估算,2018年全世界约有145万例患者死于结核病,结核病已经成为世界范围的公共卫生问题。
MTB是一种胞内寄生菌,主要寄生在宿主的巨噬细胞中,早先人们普遍认为MTB依靠巨噬细胞的脂质和胆固醇建立和维持慢性感染[3-4];但是随着研究的逐渐深入,人们发现MTB的代谢网络可以对多种碳底物同时进行分解代谢,并且这种代谢方式作为致病机制促进MTB应对不断变化的微环境[5-6],越来越多的证据表明糖代谢在MTB的发病机制中占据重要地位,笔者以MTB糖代谢为线索将现有的研究进展进行综述。
一、MTB糖代谢
MTB通过传染性气溶胶进入宿主,巨噬细胞吞噬吸入MTB后穿过肺泡上皮细胞到达肺中,被感染的巨噬细胞募集其他的巨噬细胞和免疫细胞形成肉芽肿结构,肉芽肿中的巨噬细胞在低氧状态下生长速度和迁移大大降低,呈现相对静止的状态[7]。为了适应巨噬细胞内部的低氧环境,MTB的代谢方式从有氧转变为厌氧模式,糖酵解途径相关基因的表达被上调,MTB所需能量的70%来自于糖酵解[8]。由此看来,糖酵解对于MTB在宿主体内的存活至关重要。早在1998年Cole等[9]将MTB代表菌株H37Rv进行全基因组测序,结果表明MTB除了具有脂质代谢的酶外,还具有糖酵解、磷酸戊糖途径(pentose phosphate pathway,PPP)、三羧酸(tricarboxylic acid,TCA)和乙醛酸循环所需要的酶;而后Titgemeyer等[10]分析H37Rv基因组发现,MTB具有5种碳水化合物转运蛋白。Sassetti和Rubin[11]发现碳水化合物转运与代谢相关基因是MTB在小鼠建立感染的过程中必不可少的基因。这些研究表明,碳水化合物是MTB不可或缺的能量来源,糖代谢在MTB生长与感染中发挥着重要的作用。
二、MTB中糖的转运与合成
(一)糖转运蛋白
在耻垢分枝杆菌基因组中共评估出28种糖转运蛋白,而在MTB基因组中仅预测出5种,这表明宿主很难为MTB提供富含多种糖类的环境,也解释了MTB在仅含有糖类的培养基中生长缓慢的原因。这5种糖转运蛋白分别是UgpABCE、LpqY-SugABC、UspABC、Rv2038c-Rv2041c和SugI,前4种属于三磷酸腺苷(adenosine triphosphate,ATP)结合盒式(ATP-binding cassette,ABC)蛋白家族,最后1种属于主要易化子超家族(major facilitator superfamily,MFS)蛋白。这些转运蛋白与其他细菌物种的同源性较低,因此并不能清楚地对它们的底物进行预测[10,12],MTB如何利用转运蛋白转运碳水化合物仍有待研究。
MTB的ABC糖转运蛋白对于MTB的生理与致病性具有重要作用,可以用于研发新型抗结核药品与疫苗(表1)。MTB UgpABCE转运蛋白与大肠埃希菌的麦芽糖转运蛋白结构相似,同属于碳水化合物摄取转运蛋白1亚家族,但是却不能和大肠埃希菌的UgpB亚基一样与3-磷酸甘油酯(sn-glycerol-3-phosphate,G3P)特异性结合,而是与甘油磷酸胆碱结合,这是因为大肠埃希菌UgpB亚基的169位的色氨酸被证明与G3P结合必不可少,而MTB UgpB中的169位的色氨酸被205位的亮氨酸取代。此外,MTB UgpB也是双精氨酸易位途径的底物,对于病原体的致病性至关重要[13]。LpqY-SugABC转运蛋白可以高度特异性地识别海藻糖,并且对于MTB在巨噬细胞和小鼠中建立感染至关重要,当阻断这种功能时MTB的致病性降低[14]。需要指出的是,海藻糖在哺乳动物中并不存在,并且摄入的海藻糖也会被海藻糖酶分解为葡萄糖,这说明宿主内部环境中的糖类很难进入MTB。UspABC在不同的分枝杆菌物种中是相对保守的,其UspC亚基偏向结合C2或者C3处带有氨基的糖,并且该转运系统被证明对于MTB体外生长也是必不可少的[15]。Rv2038c-Rv2041c尚未确定其确切的底物,但是研究发现Rv2041c可以增强宿主的免疫应答反应,它可以促使巨噬细胞中促炎细胞因子分泌增多,对感染MTB的小鼠及活跃的结核病患者产生积极的抗体反应,可用于MTB感染的血清学诊断[16]。至于MTB SugI转运蛋白并没有相关文献介绍,科研人员需要继续开展相关研究。

表1 结核分枝杆菌ABC糖转运蛋白主要发现
(二)糖异生
糖异生不仅可以将脂质或氨基酸转化为葡萄糖满足MTB自身的需要,而且还会影响MTB的致病性。糖异生对于MTB致病性的作用最早源于异柠檬酸裂合酶(isocitrate lyase,ICL)(图1)的研究,ICL是乙醛酸循环中重要的限速酶,乙醛酸循环的产物可以作为糖异生的底物,因此ICL可以促进碳源向糖异生途径的流动。编码ICL基因的缺失减弱了MTB在小鼠中的致病性和持久性,这说明糖异生途径对MTB的致病性和持久性产生了影响[17]。
磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)、1,6-二磷酸果糖醛缩酶(fructose-1,6-bisphosphate aldolase,FBA)和磷酸三糖异构酶(triosephosphate isomerase,TPI)(图1)是糖异生和糖酵解中重要的功能酶。其中,编码PEPCK的基因pckA在MTB感染巨噬细胞和小鼠的过程中均被诱导表达,pckA敲除的MTB突变体不能在小鼠肺中建立和维持感染[18-19]。另外,编码FBA和TPI基因的缺失会导致MTB在小鼠感染模型中被迅速清除[20-21]。尽管这些研究表明上述3种功能酶对于MTB的致病性具有重要影响,但是由于这些酶具有回补活性,因此并不能完全说明糖异生对于MTB致病性的作用。二磷酸果糖磷酸酯酶(fructose bisphosphatase,FBP)是糖异生中重要的限速酶;MTB中有2种FBP,当这两个FBP功能缺失时,糖异生途径被阻断,MTB在小鼠肺脏中被清除[22]。FBP催化的反应仅单向进行,因此FBP活性的消除只会破坏糖异生,而不会使糖酵解受到干扰,从而直接肯定了糖异生在MTB致病性中的特定作用。
三、MTB糖分解代谢中的功能酶
MTB可以通过多种方式进行糖代谢(图1),包括糖酵解途径、PPP及TCA循环,在这个过程中有许多重要的限速酶发挥着不可或缺的作用,这些功能酶可能成为新型抗结核药物的理想靶标。

NADPH:烟酰胺腺嘌呤二核苷酸磷酸;NADP+是NADPH的氧化形式;PPGK:多磷酸葡萄糖激酶;GLKA:葡萄糖激酶;PFKA:磷酸果糖激酶A;FBP:二磷酸果糖磷酸酯酶;FBA:1,6-二磷酸果糖醛缩酶;TPI:磷酸三糖异构酶;PYK:丙酮酸激酶;PEPCK:磷酸烯醇式丙酮酸羧激酶;ICL:异柠檬酸裂合酶;“+”代表该物质对于PYK为正反馈,“-”代表该物质对于PYK为负反馈图1 MTB糖代谢示意图
(一)葡萄糖激酶
葡萄糖磷酸化是糖酵解的第一个反应,也是极其重要的一个限速步骤。MTB表达两种功能性葡萄糖激酶,即多磷酸葡萄糖激酶(polyphosphate glucokinase, PPGK)与葡萄糖激酶(glucokinase,GLKA);它们可以将葡萄糖催化生成6-磷酸葡萄糖(glucose-6-phosphate,G6P),其中PPGK包含5个葡萄糖结合位点和2个ATP结合域,GLKA仅包含3个葡萄糖结合位点和1个ATP结合域,这意味着PPGK与GLKA相比可以结合更多的底物,催化效率也更高,因此PPGK发挥主要作用。当从MTB基因组中同时敲除编码PPGK和GLKA的基因后,MTB则无法使用外部葡萄糖作为生长或代谢的底物,令人惊讶的是,该突变体在小鼠肺中丧失了生存能力,不能在慢性感染阶段持续存在,这样的结果表明MTB在小鼠中建立MTB慢性感染依赖于葡萄糖磷酸化,MTB的代谢灵活性对其致病机制至关重要,病原体并不完全依赖宿主脂质的代谢[23]。
(二)磷酸果糖激酶
6-磷酸果糖的磷酸化是糖酵解的关键步骤,该步骤可由磷酸果糖激酶(phosphofructokinase,PFK)催化。已知pfkA和pfkB两个基因编码PFK,这两种基因不仅核苷酸序列上具有差异,并且编码蛋白的功能也有很大不同,PFKA属于PFK蛋白家族,而PFKB属于核酸激酶超蛋白家族。仅PFKA 在MTB中发挥PFK活性[24],而PFKB属于休眠生存调节子,在缺氧和活化的巨噬细胞中会被上调表达[25]。研究表明,PFKA和PFKB都不是MTB体外和体内生存的必要条件,但是当葡萄糖作为MTB唯一的碳来源时,PFKA对于MTB糖酵解是必不可少的,另外,在缺氧条件下MTB的生存需要PFKA[11,24]。
(三)FBA
FBA催化1,6-二磷酸果糖裂解为磷酸二羟基丙酮(dihydroxyacetone phosphate,DHAP)和G3P。FBA分为Ⅰ类与Ⅱ类,MTB FBA属于Ⅱ类,需要借助二价金属阳离子(例如Zn2+)来稳定烯醇盐中间体。在体外标准培养条件下不能分离出编码FBA基因的转座子突变体,也不能通过同源重组从MTB染色体上删除编码FBA的基因[26],这些研究表明编码FBA的基因是MTB的必需基因。MTB在含有葡萄糖或糖异生底物的单一碳源培养基中的正常生长需要FBA,这表明FBA是糖酵解和糖异生过程中必不可少的酶。在小鼠感染MTB期间,肺脏中MTB FBA被诱导表达,并且在缺氧期间FBA表达增强,MTB需要FBA活性才能在急性感染以及慢性感染阶段维持正常生长。另外,MTB分泌的FBA可以与宿主纤维蛋白溶酶结合,这表明FBA可能参与宿主与病原体的相互作用[20,26]。
(四)TPI
TPI催化DHAP和G3P的相互转化,该反应对于糖酵解和糖异生是十分重要的。TPI是一种高度保守的酶,MTB TPI与其他细菌具有极高的结构相似性。TPI的活性会受到磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)的调控,PEP可以竞争性地抑制DHAP和G3P的相互转化,从而导致PPP通量增加,使得MTB在氧化应激的情况下满足对烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的需求,维持正常的生理状态[27]。TPI缺失突变体不能在单一的碳底物下存活,但是当糖酵解和糖异生的底物同时存在时会像野生型MTB一样正常生长。并且通过同位素示踪技术发现TPI缺失时TPI底物会不断积累,这说明不存在其他TPI和代谢旁路反应,这也反映出TPI对MTB糖酵解和糖异生的重要地位。此外,当使用TPI缺失突变体感染小鼠后,TPI缺失菌株迅速在小鼠体内消除,小鼠的脾脏和肺脏均无任何病理变化,这说明在小鼠中建立MTB感染需要TPI[21]。
(五)丙酮酸激酶(pyruvate kinase,PYK)
PYK催化糖酵解最后一步,将PEP转化为丙酮酸进而进入TCA循环,是碳通量分布的中心转换点。PYK是调节糖酵解与糖异生转换的关键点,可防止二者之间的无效循环。PYK对于MTB在含有葡萄糖以及短链脂肪酸培养基中的生长都是必不可少的,但是在MTB小鼠感染模型中PYK并不是必不可少的[28]。当编码PYK的基因缺失时,牛分枝杆菌中心代谢发生显著变化,蛋白质组学的结果显示糖异生相关蛋白下调,并且脂肪酸分解代谢相关蛋白上调,牛分枝杆菌将利用脂肪酸作为能源[29]。在MTB中PYK的活性受到多种代谢产物的影响,糖酵解代谢产物G6P和1,6-二磷酸果糖均可以作为变构活化剂激活PYK,而糖酵解代谢产物G3P和PPP产物单磷酸戊糖抑制PYK的活性状态,通过PYK精细又复杂的变构调节机制,促进MTB迅速适应变化的宿主环境[29-31]。
四、糖代谢是MTB维持稳态的重要机制
MTB在宿主中从最初的肺泡巨噬细胞感染到肉芽肿的发展,以及肺外扩散的过程中会遇到一系列不同的微环境,宿主细胞会采取各种措施抵制MTB的生存与繁殖[32-34]。MTB则会不断地调整自身基因转录与表达来应对不断变化和不利的生存环境,其中代谢方式的调整与适应是一种重要的应对方式[35-36],糖代谢就是一种重要的维稳机制。
(一)糖代谢可短期缓解贝达喹啉(bedaquiline,Bdq)的杀菌作用
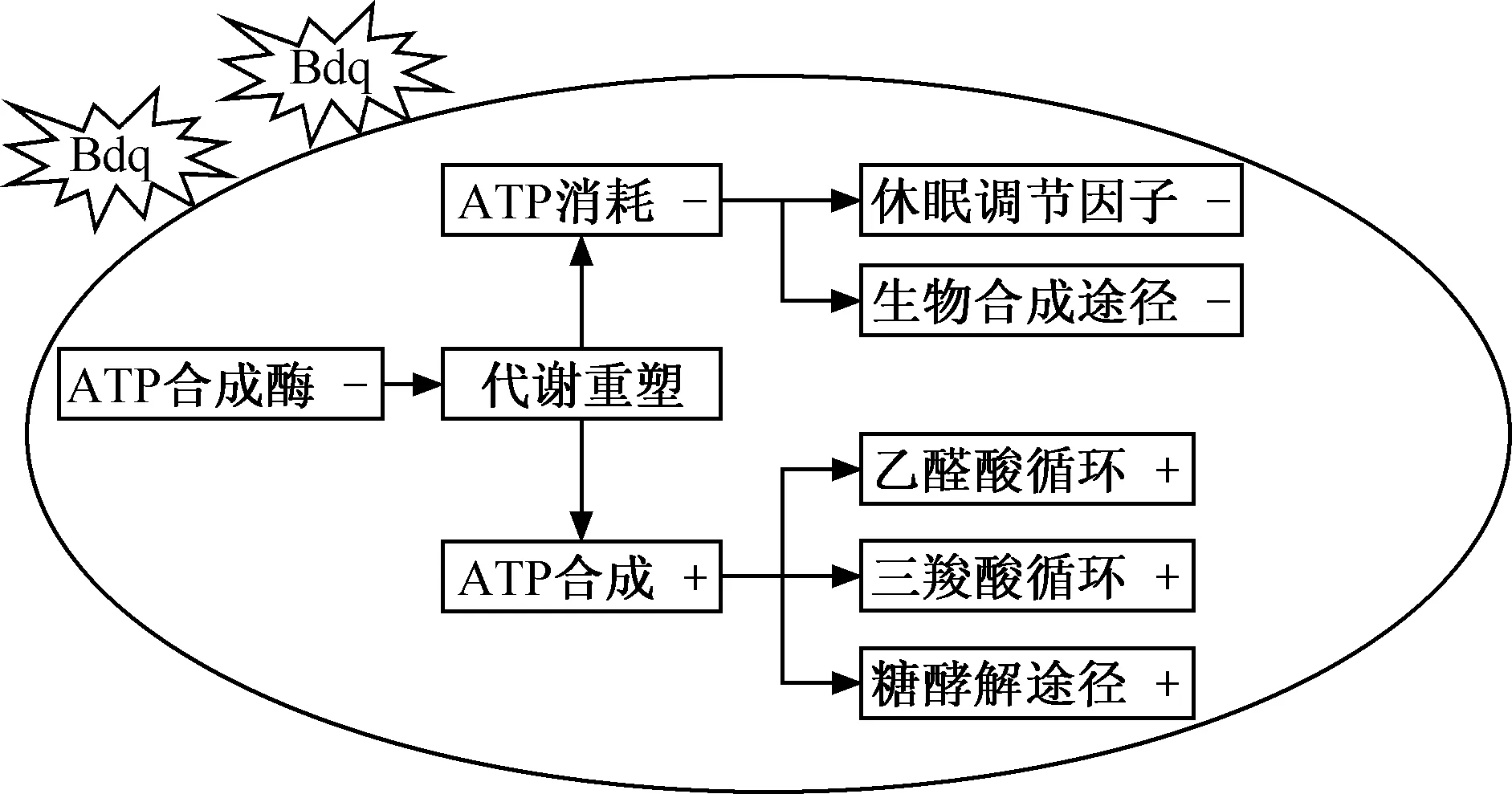
Bdq:贝达喹啉;ATP:三磷酸腺苷;“+”代表上调,“-”代表下调图2 MTB受到Bdq刺激的相关反应模式图
Bdq是ATP合成酶抑制剂,是数年来首个被批准用于治疗耐药结核病的药物,但是在临床应用中Bdq用药3~4 d却没有明显的溶菌作用,MTB的这种防御机制与MTB代谢重塑相关联(图2)。在Bdq的刺激下氧化磷酸化受到限制,MTB迅速做出反应,上调休眠调节因子并且下调生物合成途径,最大程度地降低ATP消耗。同时,MTB会增强ATP的生成途径,蛋白质组学的结果显示,乙醛酸循环以及TCA循环的关键酶显著上调,MTB将碳源通过乙醛酸循环引至TCA循环产生能量。此外,当MTB使用不可发酵的能源(例如脂肪酸)培养时,Bdq诱导的杀菌作用会显著增强,但是当使用可发酵能源(例如葡萄糖、甘油)培养时,Bdq诱导的杀菌作用则会减弱,这表明糖酵解途径对于MTB的存活显然必不可少。糖酵解产生的ATP足以维持细菌活力数天,并同时防止杀伤,只是在持续抑制ATP合成酶后,这种替代途径显然是不够的[37-38]。类似的延迟效应也出现在PA-824、Q203等抗结核候选药品中[39-40],这些药品直接或间接的靶向了MTB的呼吸链,影响了ATP的合成,代谢重塑是否也在其中发挥作用,这需要科研人员继续深入研究。
(二)糖酵解可限制低氧状态下有毒代谢产物的积累
在体外低氧的条件下,MTB进入非复制状态,此时葡萄糖对于MTB具有毒性作用,当培养基中缺少葡萄糖时,MTB可以在非复制状态下维持更久的时间。当糖酵解途径被阻断时,葡萄糖对于MTB的毒性作用则会加剧[24]。这可能与糖酵解途径中积累的有毒代谢中间产物有关,糖磷酸盐对菌体有毒并不断积聚损害细胞的生存能力,有报道称糖磷酸盐会降低MTB的细胞活力最终导致细菌死亡[41]。除此以外,糖酵解途径的阻断可能影响其他代谢途径从而降低了细菌的生存能力。总之,维持MTB完整的糖酵解会在一定程度上缓解这些有毒代谢产物的积累,从而适应不利的微环境。
(三)PPP可缓解低氧环境对MTB的损伤
为了应对低氧带来的不利影响,MTB调整代谢程序,降低糖酵解速率并且增强乙醛酸循环和糖异生活性,从而克服糖酵解使碳源重新流向PPP[42]。PPP是将葡萄糖直接氧化脱羧产生磷酸戊糖和NADPH的代谢方式,在这个过程中,磷酸戊糖和G6P利用构象动力学中的差异精细地调节PYK的活性,降低通过PYK的碳通量,减少碳逆流至TCA循环以二氧化碳的形式散失[30,43]。PPP中间产物可以为核苷酸、芳香族氨基酸等多种物质提供原料,这些产物的积累是预期代谢调节反应的结果,是MTB重新进入细胞周期所必需的[42,44]。另一方面,低氧会导致MTB内部自由基(reactive oxygen species,ROS)代谢紊乱,对机体造成损伤;而PPP产生大量的NADPH,它以其强大的还原能力迅速清除ROS,实现氧化还原平衡,并且修复ROS造成的损伤[45]。总之,PPP可有效缓解低氧环境给MTB造成的损伤,并且为重新进行复制状态做好准备。
五、展望
MTB的代谢网络可以有效地对多种碳底物同时进行分解代谢[5],通过不断地自我调节以适应不断变化的微环境,实现MTB最佳生长状态。代谢的多功能性已经日益被认为是一种重要的致病机制,如何在多变的环境下建立和维持慢性感染决定了MTB的致病性[46]。 MTB完整的糖代谢途径对于维持MTB稳态起着重要作用,对于这其中某一环节进行干预,可能会成为预防或治疗结核病的有效途径,为抗结核药物的研发带来了新的靶点。目前国内外对MTB进行糖代谢的研究仍然较少,这需要我们不断的关注与探索。

