澳洲宝石鲈热休克蛋白90-β基因(HSP90-β)的cDNA克隆与表达*
高凇泽,孙彩云,吴金英,叶航宇,李文笙
(中山大学生命科学学院/水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室/广东省重要经济鱼类健康养殖工程技术研究中心,广东广州510275)
热休克蛋白(heat shock proteins,HSPs)广泛存在于细菌,哺乳动物和植物中,是一类高度保守的应激蛋白,在应对环境压力等方面发挥着关键作用[1-2]。根据表观相对分子质量,HSPs可分为几个家族:HSP110,HSP90,HSP70,HSP60 和低相对分子质量HSP[3-4]。在所有HSP 家族中,HSP90 是一种高度保守、蕴含量丰富的细胞蛋白,占非应激条件下大多数组织中总细胞蛋白的1% ~2%[5]。HSP90 主要在细胞质中表达,分为HSP90-α(诱导型)和HSP90-β(组成型)两种[6]。其中HSP90-β 的N 末端缺乏富含谷氨酰胺的序列(QTQDQ),并且相对分子质量大于HSP90-α。有研究指出这两种蛋白有着不同的分子伴侣功能[7]。HSP90在细胞增殖、分化和凋亡等多种细胞过程中发挥着关键作用[8]。通过活性的改变它可以调节蛋白质折叠,诱导多种恶性肿瘤和神经系统疾病状态下错误折叠及突变蛋白质的水解[9-12]。目前,HSP90抑制剂已在肿瘤化疗领域进行了人体临床试验[10]。HSP90 还参与免疫反应,它是主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类和Ⅱ类分子进行抗原加工和呈递的调节剂[13-14]。对MHC Ⅰ类分子途径的研究表明,HSP90-α可指导抗原加工或选择表位用于呈递[15]。而在MHC Ⅱ类分子途径中,HSP90-α 和HSP90-β均参与谷氨酸脱羧酶(glutamate decarboxylase,GAD) 抗原的呈递,并调节T细胞对自身和潜在外来抗原反应的发展进程[6]。另外,HSP90具可诱导性,热休克[16-17]、细菌感染[18]和重金属[19]等刺激均可诱导、调节HSP90的表达。
水体环境是一个复杂多变的系统,水生动物通常面临热休克、细菌、病毒和缺氧等各种环境压力[20]。而HSP90 有助于水生动物抵抗各种环境压力,以适应复杂多变的环境。这在海湾扇贝(Argopecten irradias)[21]、 鲤 鱼 (Cyprinus car⁃pio)[22]、塞内加尔鳎(Solea soled)[23]、虹鳟(On⁃corhynchus mykiss)[24]、宽 体 沙 鳅(Botia reeves⁃ae)[25]和鮸鱼(Miichthys miiuy)[26]中已有相关报道。然而,硬骨鱼类HSP90 基因的功能研究仍然有限,有待于进一步丰富和完善。澳洲宝石鲈(Scortum barcoo)隶属于鲈形目(Perciformes)、鯻科(Terapontidae)、革鯻属(Scortum),原产于澳大利亚的艾尔湖,是澳大利亚众多石鲈之一。因其生长速度快,抗病能力强,耐低氧,肉质鲜嫩口感好,经济效益高,于2004 年被成功引入我国[27]。澳洲宝石鲈非常适合在循环水产养殖系统(recirculating aquaculture system,RAS)中集约化养殖,因而极具养殖推广价值[28]。然而,养殖的集约化和养殖规模的扩大给病原体的传播提供了便利,澳洲宝石鲈出现的病害也越来越多。例如,由海豚链球菌(Streptococcus iniae)[29]引起的出血性败血症,爱德华氏菌(Edwardisella tarda)[30]引起的爱德华氏菌病,嗜水气单胞菌(Aeromonas hy⁃drophila)[31]引起的体表溃烂病等。近年来,澳洲宝石鲈也开始出现无乳链球菌感染[32],但其疾病防治等方面的研究却鲜有报道,免疫相关基因的研究仍然空白。
为了探究澳洲宝石鲈HSP90-β 在细菌引起的免疫反应中的作用,我们运用cDNA 末端快速扩增技术(rapid amplification of cDNA ends,RACE),首次从澳洲宝石鲈的肝脏中克隆得到了HSP90-β的全长cDNA 序列;将其氨基酸序列与其他鱼类、两栖类、鸟类,以及哺乳动物进行了同源性分析,并构建了分子系统树;分析了澳洲宝石鲈HSP90-β mRNA 在不同组织的表达情况,以及无乳链球菌感染后其在不同时间段、不同组织的表达差异,为进一步研究HSP90-β 的功能及在免疫方面的应用提供了参考资料。
1 材料与方法
1.1 实验鱼
实验所用的澳洲宝石鲈购于广东海洋与水产高科技园,体质量(76±16) g。实验前于120 L塑料缸中暂养,水温24 ~26 ℃,持续充气,每日定时饱食性投喂2次,并换水1/3体积。3周后,选取健康的澳洲宝石鲈进行实验。
1.2 澳洲宝石鲈HSP90-β的克隆
实验材料为健康澳洲宝石鲈。40 ℃水温热激4 h 后取肝脏组织,依照TRNzol Universal 总RNA 提取试剂(天根,中国)说明书提取肝脏总RNA,使用超微量分光光度计NanoDrop 2000c(Thermo Scientific,美国)检测其浓度,并通过w=1%琼脂糖凝胶电泳检验其完整性。 使用逆转录试剂盒FSQ-101(TOYOBO,日本)进行逆转录PCR(re⁃verse transcription-polymerase chain reaction,RTPCR)。反应条件为37 ℃,15 min;50 ℃,5 min;4 ℃,5 min。
在NCBI(https://www. ncbi. nlm. nih. gov/nuc⁃core)中查找鲈形目鱼类HSP90-β 的编码序列,并用DNAssist(2.2)进行序列比对。找出保守序列,并参照简并引物替换表设计简并引物,使用高保真 酶KOD One PCR Master Mix-Blue (TOYOBO,日本)进行PCR。反应条件为95 ℃,1 min,1 个循环;98 ℃,10 s,1 个循环;(98 ℃,10 s;55 ℃,30 s;68 ℃,5 s),40 个循环;68 ℃,5 min,1 个循环;4 ℃,∞。将PCR 产物进行琼脂糖凝胶电泳,并将目的条带切胶回收,经测序得到核心片段序列,并参照该序列设计RACE 引物。使用TdT 转移酶法进行RACE,引物AP 用于3′RACE模板的制作,引物AAP 用于5′RACE 模板的制作。将5′ RACE、3′ RACE 扩增得到的序列与NCBI 数据库序列进行比对,确认得到目的序列后,将其与核心片段序列拼接得到完整的cDNA 序列,并从该序列上设计引物扩增得到完整的CDS。引物详见表1。

表1 本研究所用引物Table 1 Primers used in the study
1.3 序列分析及分子系统树的构建
将所得cDNA 序列导入ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/),点击“submit”,得到预期的ORF 的氨基酸序列。将氨基酸序列导入ProtParam(https://web. expasy. org/protparam/),点击“Compute parameters”,即可得到检测序列表达蛋白的相对分子质量、理论等电点(PI)、不稳定系数等基本信息;导入SignalP-5.0 Server(http://www. cbs. dtu. dk/services/SignalP/),选择“Organism group :Eukarya”和“Output format :Long output”,点击“submit”即可预测该蛋白是否含有信号肤;导入TMHMM Server v. 2.0(http://www. cbs. dtu. dk/services/TMHMM/),选 择“Out⁃put format:Extensive,with graphics”,点击“sub⁃mit”,预测该蛋白是否含有跨膜结构;导入NetN⁃Glyc 1.0 Server (http://www. cbs. dtu. dk/services/NetNGlyc/) 和NetPhos 3.1 Server (http://www.cbs. dtu. dk/services/NetPhos/),分别对该蛋白的糖基化位点和磷酸化位点进行预测。登录http://smart. embl-heidelberg. de/,在“Protein sequence”框中输入澳洲宝石鲈HSP90-β 氨基酸序列,勾选“HMMER searches of the SMART database occur by default. You may also find”下的“PFAM domains”选项,点击“Sequence SMART”进行结构域分析。在NCBI 上搜索其他物种的HSP90 氨基酸序列,保存为FASTA 文件。打开DNAMAN 7.0.2.176,选择“Sequence”菜单下子菜单“Alignment”中的“Multiple Sequence Alignment”选项。点击新弹出窗口中的“File”按钮,导入要进行序列比对的FASTA文件,选择序列下方的“Protein”选项。依次单击“下一步”,完成序列比对。其中涉及到的蛋白质详细信息见表2。将FASTA 文件导入MEGAX采用邻接法(neighbor-joining method,NJ)构建系统进化树。
1.4 组织分布
在NCBI 中查找鱼类β-actin 基因序列进行序列比对,设计简并引物克隆得澳洲宝石鲈β-actin 基因的部分序列,并从该序列上设计用来做荧光定量PCR (quantitative real-time PCR,qPCR) 的引物(见表1)。根据已获得的澳洲宝石鲈HSP90-β cDNA 序列设计并合成用于荧光定量PCR 的引物(见表1)。进行荧光定量PCR 实验所用的仪器为高通量实时荧光定量PCR 仪LightCycler480(Roche,美国),反应条件为:95 ℃,30 s,一个循环;(95 ℃,5 s;60 ℃,10 s;72 ℃,15 s),40 个循环;融解曲线分析(melting curve analysis)。分别取6条澳洲宝石鲈的心、肝、脾、肠、胃、肾、肌肉、皮肤、头肾、脑、鳃组织,使用TRNzol Uni⁃versal 总RNA 提取试剂(天根,中国) 提取总RNA ,并使用ReverTra Ace qPCR Rt Master Mix with gDNA Remover(TOYOBO,日本)进行反转录,使用SYBR Green Ⅰ(TOYOBO,日本)于高通量实时荧光定量PCR 仪LightCycler480 (Roche,美国)上完成qPCR。处理和取样前,用丁香酚麻醉。取样过程中所用到的塑料容器皆经过无RNase处理,取样金属器械经180 ℃处理4 h以上。
1.5 无乳链球菌感染实验
实验所用无乳链球菌由中山大学生命科学学院李安兴教授惠赠。实验前,挑取无乳链球菌单菌落于5 mL 脑心浸液肉汤(brain heart infusion broth,BHI)液体培养基中,30 ℃,200 r/min条件下培养24 h。然后按照1∶100 的比例扩培,即1 mL 菌液加入99 mL BHI 培养基,30 ℃,200 r/min条件下培养12 h。用分光光度计检测菌液的A 为0.6~0.8 时,3 000 ×g 离心5 min,去上清液。用PBS(pH 7.4)重悬菌体,3 000×g 离心5 min,重复该步骤2 次。以1/10 体系的PBS(pH 7.4)重悬菌体,并进行梯度稀释,涂板记录菌落个数,进而估计菌液浓度。参照预实验测得的半数致死量(median lethal dose,LD50) 上 限8.0×107CFU/kg,用无菌PBS (pH 7.4) 将菌液浓度调整为7.0×107CFU/mL用于正式的无乳链球菌感染实验。将澳洲宝石鲈随机分组,其中无乳链球菌感染组(S组)120尾,PBS对照组(P组)60尾。S组澳洲宝石鲈按照1 μL/g体质量的标准腹腔注射无乳链球菌菌液(7.0×107CFU/mL),P 组样本按照1 μL/g 体质量的标准腹腔注射无菌PBS。注射结束后,将澳洲宝石鲈养在120 L 塑料缸中,每日投喂2 次。水体持续充气,每日更换1/3 体积。水温保持在24 ~26 ℃。选取注射后6、12、24、48、72、96、120和144 h 这8 个时间节点,每个节点取6 尾鱼的肝、脾、头肾和脑4 个组织,用于后续的RNA 提取、RT-PCR和qPCR实验。
1.6 数据处理及作图方法
qPCR 数据分析,以β-actin 为内参,采用的数据统计方法为2-ΔΔCt。组织分布实验,以HSP90-β mRNA 在脾脏处的表达水平为基准将数据归一化,使用GraphPad Prism 8.0.1(224)进行数据的处理(单因素方差分析)及作图。无乳链球菌感染实验,以对照组HSP90-β mRNA 的表达水平为基准将数据归一化,使用GraphPad Prism 8.0.1(224)进行数据的处理(双因素方差分析)及作图。
2 结 果
2.1 澳洲宝石鲈HSP90-β序列分析
澳洲宝石鲈HSP90-β的全长cDNA为2 708 bp,其中5′非编码区(5′ untranslated region,5′ UTR)长86 bp,3′非编码区(3′ untranslated region,3′UTR)为444 bp,开放阅读框(open reading frame,ORF)为2 178 bp,编码725 个氨基酸,预测相对分子质量约为83 200,理论等电点为4.91,不稳定系数为40.42。澳洲宝石鲈HSP90-β的氨基酸序列含有5 个HSP90 家族的特征序列(NKEIFL⁃RELISN [S/A] SDALDKIR,LGTIA [K/R] SGT,IGQFGVGFYSA[Y/F]LVA[E/D],IKLYVRRVFI和GVVDS[E/D]DLPLN[I/V]SRE),但没有信号肤序列和跨膜结构域(图1)。

图1 澳洲宝石鲈HSP90-β cDNA的核苷酸及氨基酸序列Fig.1 Nucleotide and amino acid sequences of jade perch HSP90-β cDNA
澳洲宝石鲈HSP90-β 氨基酸序列在http://smart. embl-heidelberg. de/中的结构域分析结果(图2)显示,该序列包含一段长519个氨基酸残基的序列(190~708,519 AA)符合HSP90 蛋白家族特征。
2.2 同源性及进化树分析
澳洲宝石鲈与其他物种HSP90-β 的氨基酸序列同源性分析结果如表2所示。澳洲宝石鲈与其他鱼类HSP90-β 的氨基酸序列一致性皆在90%以上,与鮸鱼的一致程度最高,达到97.68%;与小体鲟(Acipenser ruthenus)的一致程度最低,为92.08%。与其他鱼类的一致性分别为:高体鰤鱼(Seriola dumerili),97.54%;翘嘴鳜(Siniperca chuatsi),97.40%; 欧 洲 狼 鲈 (Dicentrarchus labrax),96.99%;斑马鱼(Danio rerio),92.90%。除此之外,其与两栖动物、鸟类,乃至哺乳动物的一致性也较高:非洲爪蟾(Xenopus laevis),90.71%;褐家鼠(Rattus norvegicus),90.03%;智人(Ho⁃mo sapiens),89.89%;红 原 鸡(Gallus gallus),88.39%。可见HSP90-β 在进化上非常保守,不同物种的HSP90-β相似程度很高。
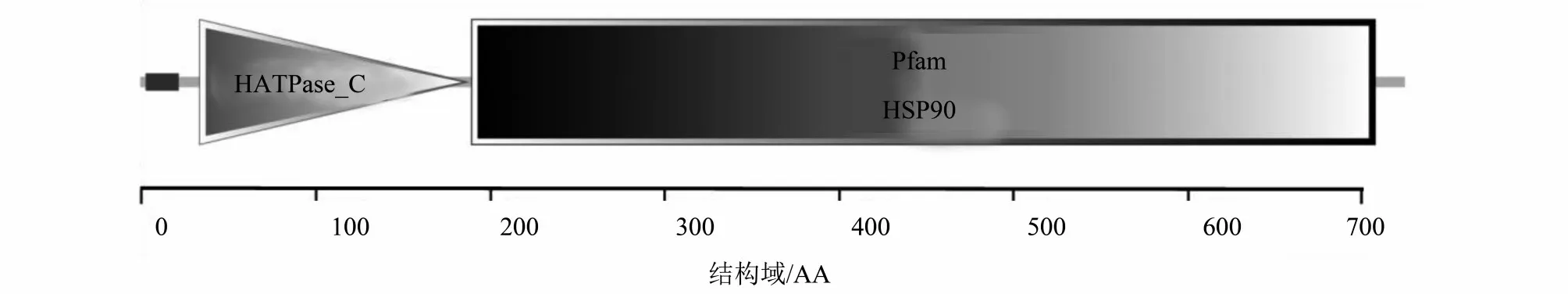
图2 澳洲宝石鲈HSP90-β结构域分析Fig.2 Analysis of the structure domain of jade perch HSP90-β

表2 澳洲宝石鲈HSP90-β氨基酸序列同源性分析Table 2 Analysis of amino acid sequence homology of jade perch HSP90-β
从系统发育进化树(图3)来看,所有的α 亚型蛋白和β亚型蛋白各自归为一支,其中鱼纲动物的HSP90-β 单独聚为一支,两栖纲、鸟纲、哺乳纲动物的HSP90-β 各自聚为一支。澳洲宝石鲈HSP90-β 与鲈形目红 笛鲷(Lutjanus sanguineus)的亲缘关系最近,翘嘴鳜次之,与鲟形目史氏鲟(Acipenser schrencki)的亲缘关系较远,与两栖纲、鸟纲、哺乳纲其他动物的亲缘关系更远。
2.3 澳洲宝石鲈HSP90-β在不同组织中的表达状况
如图4所示,以澳洲宝石鲈HSP90-β mRNA 在脾脏处的表达水平为基准将数据归一化,可见澳洲宝石鲈HSP90-β mRNA 在肝脏处高表达(表达量为脾脏的11.37 倍),其次在肠组织处较高表达(表达量为脾脏的5.83 倍),在心、肾、肌肉、皮肤、头肾、脑和鳃中低表达(表达量为脾脏的1.79~3.02倍),而在脾脏、胃组织表达较少。
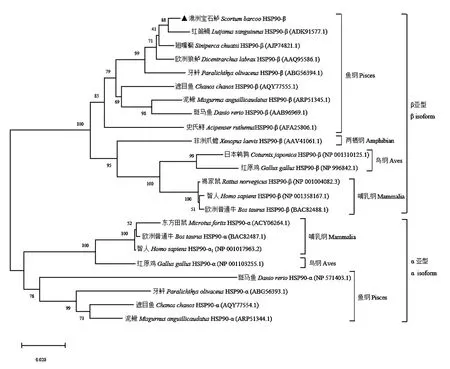
图3 澳洲宝石鲈与其他物种的HSP90-β氨基酸序列进化树分析Fig.3 Phylogenetic analysis of HSP90-β amino acid sequences of jade perch and other species

图4 澳洲宝石鲈HSP90-β mRNA在各组织的分布Fig.4 Expression of jade perch HSP90-β mRNA in various tissues
2.4 感染无乳链球菌后澳洲宝石鲈HSP90-β mRNA在不同组织中的表达状况
在探索HSP90-β mRNA 在澳洲宝石鲈感染无乳链球菌后表达量变化中,发现感染无乳链球菌后第6 ~96 h,澳洲宝石鲈的肝组织中HSP90-β mRNA 表达水平持续降低,随后表达水平升高,但表达量仍然显著低于对照组;感染后第12 ~144 h 澳洲宝石鲈HSP90-β mRNA 的表达水平降低显著,在这7 个时间点处的表达量分别为对照组的0.63、0.43、0.41、0.40、0.18、0.43 和0.44 倍(图5A)。如图5B 所示,感染无乳链球菌后第6 ~24 h,澳洲宝石鲈的脑组织中HSP90-β mRNA 表达水平呈下降趋势,但均未达显著性差异;随后表达增加,至感染后第72 h 表达量增加显著,为对照组的1.40 倍;尔后表达量下降,至感染后第96 h 达到最低值,表达量为对照组的0.91 倍;随后HSP90-β mRNA 表达量再次增加,至感染后第120 h 达到峰值,表达量为对照组的1.13 倍。总体而言,感染无乳链球菌后澳洲宝石鲈的脑组织中HSP90-β mRNA表达水平呈先下降,后上升,再下降,再上升的趋势,且在感染后第72 h 表达量显著增加。
如图6A 所示,感染无乳链球菌后第24 h 时,澳洲宝石鲈的脾脏组织中HSP90-β mRNA 表达水平显著升高,为对照组的1.90 倍;随后表达水平在感染后第48 h 显著下降,达到最低值,表达量为对照组的0.60 倍;尔后HSP90-β mRNA 表达水平再次升高,至感染后第120 h 达到峰值,表达量为对照组的1.01 倍,未达到显著差异。澳洲宝石鲈的脾脏组织中HSP90-β mRNA 表达水平整体呈现先上升,后下降,再趋于正常表达的趋势。如图6B 所示,感染无乳链球菌后第6~12 h,澳洲宝石鲈的头肾组织中HSP90-β mRNA 表达水平下降,随后表达水平升高,至感染后第24 h 达到峰值,表达量为对照组的1.25 倍,但未达到显著差异;随后HSP90-β mRNA 表达水平再次下降,至感染后第72 h 表达水平显著降低,表达量为对照组的0.69 倍;尔后HSP90-β mRNA 表达水平再次升高,至感染后第96 h 达到峰值,表达量与对照组相同;至感染后第144 h 澳洲宝石鲈的头肾组织中HSP90-β mRNA 表达水平再次显著降低,表达量为对照组的0.57 倍。澳洲宝石鲈的头肾组织中HSP90-β mRNA 表达水平整体呈现先下降,后升高,再下降,再升高,再下降的趋势。
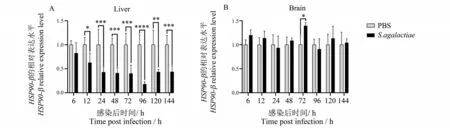
图5 注射无乳链球菌后澳洲宝石鲈HSP90-β mRNA在肝、脑组织的表达状况Fig.5 Expression of jade perch HSP90-β mRNA in tissue of liver and brain after injection of S. agalactiae
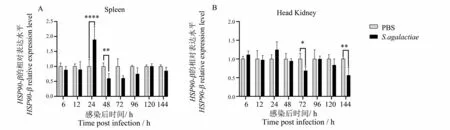
图6 注射无乳链球菌后澳洲宝石鲈HSP90-β mRNA在脾、头肾组织的表达状况Fig.6 Expression of jade perch HSP90-β mRNA in tissue of spleen and head kidney after injection of S. agalactiae
3 讨 论
3.1 澳洲宝石鲈HSP90-β氨基酸序列分析
热休克蛋白(HSPs)在鱼类的应激与免疫反应中起着重要的作用,而HSP90 是热休克蛋白家族的重要成员。目前,已有鲤鱼[22]、塞内加尔鳎[23]、虹鳟[24]、宽体沙鳅[25]和鮸鱼[26]等多种硬骨鱼类的HSP90 基因被克隆和分析。目前的研究发现,除了按蚊(Anopheles albimanus)含有两种HSP90外,其他无脊椎动物中只有一种HSP90。但在脊椎动物中存在两种HSP90 (HSP90-α 和HSP90-β) 的胞质异构体,其差异在于,通常HSP90-β亚型的氨基酸序列N-末端不具QTQDQ 序列[7]。而在本研究中,未发现澳洲宝石鲈HSP90-β 氨基酸序列的N 末端存在QTQDQ 序列。澳洲宝石鲈HSP90-β 氨基酸序列中有5 个保守的HSP90家 族 特 征(NKEIFLRELISN [S/A] SDALDKIR,LGTIA [K/R] SGT,IGQFGVGFYSA [Y/F] LVA[E/D],IKLYVRRVFI 和GVVDS [E/D] DLPLN[I/V]SRE),亦含有所有胞质HSP90蛋白C末端共同存的的EEVD 结构域特征,以及对结合ATP至关重要的保守ATP 结合结构域“GxxGxG” 基序[21,33-34](图1)。同源性分析结果显示,澳洲宝石鲈HSP90-β 氨基酸序列与其他鱼类的HSP90-β氨基酸序列一致性皆在90%以上;与两栖动物、鸟类,乃至哺乳动物HSP90-β 氨基酸序列的一致性也较高,皆在88%以上。从系统发育进化树来看,澳洲宝石鲈HSP90-β 与其他鱼类聚为一支。与鲈形目的红笛鲷的亲缘关系最近,翘嘴鳜次之,与软骨硬鳞亚纲鲟形目史氏鲟的亲缘关系较远,与两栖纲、鸟纲、哺乳纲其他动物的亲缘关系更远(图3)。综上所述,结构分析、同源性分析,以及分子系统树的结果支持我们得到的澳洲宝石鲈HSP90-β 属于HSP90 家族的β 亚型,而且该基因在不同物种中高度保守。
3.2 澳洲宝石鲈HSP90-β mRNA组织表达分析
从表达分布来看,澳洲宝石鲈HSP90-β mRNA高表达于肝脏,较高表达于肠,在心、肾、肌肉、皮肤、头肾、脑和鳃中低表达,而在脾脏、胃组织表达甚少(图4)。这与在宽体沙鳅、鮸鱼和团头鲂(Megalobrama amblycephala)[35]中的表达有相似之处。宽体沙鳅[25]HSP90-β mRNA 主要在肝脏、鳃、脾和肾组织中表达,并且这些组织中的表达水平显著高于所分析的其他组织(P<0.05)。鮸鱼[26]HSP90-β mRNA在肝组织中表达水平最高,在鳍、脑、脾、鳃和肌肉中适度地表达,在肠、肾、心脏和眼中表达较弱。上述几种鱼的HSP90-β mRNA 都在肝组织中较高表达,这可能与肝脏代谢活动活跃,参与解毒等功能有关。而团头鲂HSP90-β mRNA 主要在血细胞中表达,其次是脾脏、肠和脑,再次为肝脏、肾,在心脏和肌肉组织中表达较少,在鳃中几乎无表达[35],这可能是由于HSP90在不同物种的不同组织存在表达差异。
3.3 感染无乳链球菌后澳洲宝石鲈HSP90-β 组织表达分析
从组织表达分析结果来看,澳洲宝石鲈HSP90-β mRNA高表达于肝组织。而鱼类的脾脏和头肾组织与鱼类的免疫密切相关。且有研究表明,感染无乳链球菌的垂死病鱼100%出现脑组织被侵染的状况[35]。因此,本实验研究了感染无乳链球菌后澳洲宝石鲈HSP90-β mRNA 在肝脏、脾脏、头肾和脑组织的表达状况。实验结果显示,澳洲宝石鲈HSP90-β mRNA 在肝组织中的表达水平整体低于对照组,大体呈现先降低后增加的趋势(图5A)。说明无乳链球菌感染可能会抑制澳洲宝石鲈HSP90-β mRNA 在肝组织中的表达。在脑组织中HSP90-β mRNA 的表达有波动,并于感染后第72 h 表达水平显著升高,达到峰值,表达量为对照组的1.40 倍(图5B)。可推测,此时无乳链球菌已入侵并感染这些鱼的脑组织。感染无乳链球菌后第24 h,澳洲宝石鲈的脾脏组织中HSP90-β mRNA 表达水平显著升高,表达量为对照组的1.90 倍。表达水平整体呈现先上升,后下降,再趋于正常表达的趋势(图6A)。澳洲宝石鲈的头肾组织中HSP90-β mRNA 表达水平整体呈现先下降,后升高,再下降,再升高,再下降的趋势(图6B)。
这些结果与细菌感染后宽体沙鳅、鮸鱼和团头鲂中HSP90-β mRNA 的表达有相似之处,亦有不同。感染嗜水气单胞菌后,宽体沙鳅[25]HSP90-β mRNA 在肝组织的表达水平呈现先上升后下降的趋势,其中第6~96 h 表达水平显著升高,与本实验结果不同;在肾组织中的表达水平亦呈现先上升后下降的趋势,其中第12 h 达到峰值,但不显著。感染鳗弧菌(Vibrio anguillarum) 后,鮸鱼[26]HSP90-β mRNA 在肝组织的表达水平呈现先下降后上升的趋势,但整体显著降低,与本实验结果大体相同;在脾脏的表达水平呈现先下降后上升,再下降,再上升的趋势,其中第12、24 和72 h显著上升,达到峰值;在肾组织的表达水平波动,整体显著降低。在细菌感染后,澳洲宝石鲈和鮸鱼的HSP90-β mRNA 在肝组织中的表达有显著下降的趋势,且在观察时间范围内并未恢复到正常水平,与宽体沙鳅的表达不同。这可能是因为前两者的细菌感染浓度太高,造成了肝组织的严重损害;也可能因为前两者同属于鲈形目,而后者属于鲤形目,存在种属间的表达差异。感染嗜水气单胞菌后的第4 h,团头鲂[35]肝脏组织HSP90-β mRNA的表达量升高显著,随即在感染后的第24 ~120 h 表达量下降至对照组之下。团头鲂感染嗜水气单胞菌后第24 ~120 h肝脏组织HSP90-β mRNA 的表达水平波动,但表达量下降至对照组之下,与澳洲宝石鲈感染无乳链球菌后第6~144 h,以及鮸鱼[26]感染鳗弧菌后第6~72 h 肝脏组织HSP90-β mRNA的表达变化相似。感染嗜水气单胞菌后,团头鲂脾脏和头肾组织HSP90-β mRNA 的表达水平皆整体呈现先升高后下降,再升高的趋势,这也与本实验澳洲宝石鲈感染无乳链球菌的结果相似。在哺乳动物细胞中,HSP90 可以破坏NOD2-SGT-1 复合物,并通过NF-κB 诱导促炎性细胞因子的产生[36],而剧烈的炎症反应会对机体造成损伤,因而免疫相关基因的表达一般会先上调后下调。据此可以推测在无乳链球菌感染澳洲宝石鲈,以及鳗弧菌感染鮸鱼[26]后的第6 h 之前,它们肝脏组织的HSP90-β mRNA 表达水平也可能出现过显著升高的过程。细菌感染后,澳洲宝石鲈、宽体沙鳅、鮸鱼以及团头鲂不同组织HSP90-β mRNA 表达水平的波动变化可能也是机体协调免疫反应既抵抗病菌入侵,又保护机体免受炎症侵害的结果。整体而言,无乳链球菌感染导致了澳洲宝石鲈肝脏、脾脏、头肾和脑组织HSP90-β mRNA 表达水平的波动变化,这表明澳洲宝石鲈HSP90-β 可能参与了无乳链球菌感染引发的免疫反应。
随着养殖规模的逐渐扩大和养殖的高度集约化,澳洲宝石鲈的养殖面临着无乳链球菌病原的威胁。而2011 年暴发的大规模罗非鱼链球菌病造成的经济损失高达4 亿美元[37],这为澳洲宝石鲈的健康养殖和继续推广敲响了警钟。近年来有研究发现, HSP90 作为疫苗免疫佐剂在提高疫苗免疫效果方面有一定效果[38]。本研究开展了澳洲宝石鲈HSP90-β 基因克隆、生物信息学分析及功能初探工作,丰富了鱼类HSP90 在免疫领域的研究,为免疫佐剂开发提供了一定的理论基础,对于相关病害防治研究的推进有一定意义。

