NLR、hs-CRP及血脂指标与急性脑梗死患者颈动脉粥样硬化斑块稳定性的关系
林东,苏斌儒,冼云开,牛冰
(1.东莞市第八人民医院神经内科;2.东莞市第八人民医院B超室,广东 东莞 523321)
随着我国人口老龄化问题的日益凸显以及人们生活方式的不断改变,脑梗死的发病率正呈逐年升高趋势,且开始趋于年轻化[1]。急性脑梗死(ACI)是我国中老年人致残以及致死的重要原因之一,已受到广泛关注。相关研究报道显示[2],绝大部分患者发生ACI的根本原因为动脉粥样硬化斑块基础上的血栓形成,颈动脉粥样硬化斑块是导致ACI的危险因素之一,和脑梗死的发生、发展、复发密切相关。随着近年来相关研究的逐渐深入,越来越多的学者发现慢性炎症在颈动脉粥样硬化斑块进展过程中起着至关重要的作用,其中中性粒细胞与淋巴细胞比值(NLR)是近年来临床上所开展的一种快速炎症状态评估指标,亦是心脑血管疾病的新型预测指标[3]。超敏C反应蛋白(hs-CRP)是最具有代表性的非特异性验证敏感性指标之一,参与了动脉粥样硬化斑块形成、发展以及斑块破裂、血栓形成的全部病理生理过程。鉴于此,本文通过研究NLR、hs-CRP及血脂指标与ACI患者颈动脉粥样硬化斑块稳定性的关系,旨在为临床ACI的防治提供参考依据,现作以下报道。
1 资料与方法
1.1 一般资料
选取东莞市第八人民医院神经内科从2017年3月至2019年3月期间收治的ACI患者80例进行研究,记作ACI组。其中包含男性患者49例,女性患者31例,年龄52~80岁,平均年龄(61.33±8.22)岁;文化程度:初中及初中以下34例,高中及高中以上46例。另取同期于我院接受体检的健康人员80例作为对照组。包含男性50例,女性30例,年龄51~80岁,平均年龄(61.30±8.20)岁;文化程度:初中及初中以下33例,高中及高中以上47例。两组上述指标经比较无差异(P>0.05),均衡可比。纳入标准:(1)所有患者均与2018年中国急性缺血性脑卒中诊治指南以及第四届全国脑血管病会议所制定的相关诊断标准相符[4];(2)发病至入院就诊时间在48~72 h内;(3)均为首次发病;(4)均经头颅MRI确诊。排除标准:(1)心、肝、肾等重要脏器发生病变者;(2)因动脉炎以及烟雾病等原因导致的脑梗死者;(3)合并血液系统疾病或恶性肿瘤者;(4)心源性脑梗死;(5)意识障碍或伴有精神疾病者;(6)正参与其他研究者。研究对象均在知情同意书上签字,且医院伦理委员会已批准。
1.2 研究方法
(1)实验室相关指标检测:所有患者均于入院当日、健康体检者于体检当日采集空腹静脉血10 mL,采用血细胞分析仪检测血常规,主要指标为红细胞、白细胞、中性粒细胞数、淋巴细胞数,并计算NLR;以免疫比浊法检测hs-CRP水平;采用全自动生化分析仪检测血脂指标,主要包含总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C);(2)颈动脉超声检查:使用仪器为Philips IU22型彩色多普勒超声诊断仪,观察受试者颈动脉内膜中层形态、结构以及回声变化情况。于颈动脉分叉处近端后壁1.5 cm处测量IMT,重复测量3次取平均值,将颈动脉内膜局限性隆起且IMT≥1.3 mm记作动脉粥样硬化斑块形成。按照斑块回声的差异分成软斑、溃疡斑、扁平斑以及硬斑,将软斑和溃疡斑归为不稳定斑块组(n=44),将扁平斑以及硬斑归为稳定斑块组(n=36)。
1.3 观察指标
比较ACI组与对照组血脂指标以及NLR、hs-CRP水平,对比ACI不稳定斑块组、稳定斑块组血脂指标以及NLR、hs-CRP水平。
1.4 统计学方法

2 结 果
2.1 ACI组与对照组血脂指标以及NLR、hs-CRP对比
ACI组HDL-C水平低于对照组,而LDL-C、NLR、hs-CRP水平均高于对照组(均P<0.05),见表1。
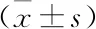
表1 ACI组与对照组血脂指标以及NLR、hs-CRP对比
2.2 ACI不稳定斑块组、稳定斑块组血脂指标以及NLR、hs-CRP对比
ACI不稳定斑块组LDL-C、NLR、hs-CRP水平均高于稳定斑块组(均P<0.05),见表2。
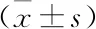
表2 ACI不稳定斑块组、稳定斑块组血脂指标以及NLR、hs-CRP对比
2.3 影响ACI患者斑块稳定性的多因素Logistic回归分析
经多因素Logistic回归分析可得:LDL-C、NLR、hs-CRP均是影响ACI患者斑块稳定性的危险因素(均P<0.05),见表3。
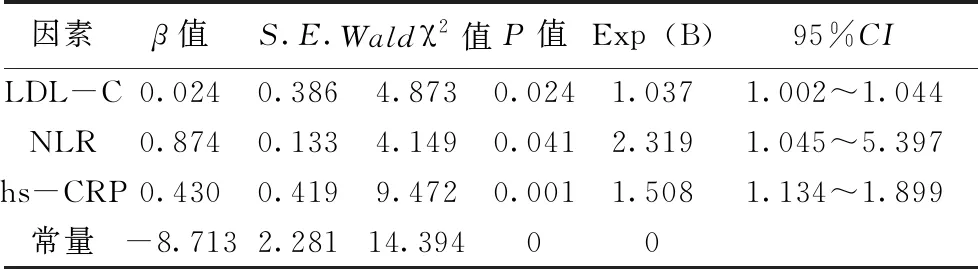
表3 ACI患者斑块稳定性的多因素Logistic回归分析
3 讨 论
ACI主要是指脑血管血流供应障碍引起的脑组织神经细胞缺血性坏死,从而导致中枢神经系统无法逆转的病理改变,主要表现为中枢以及部分外周神经功能丧失[5]。动脉粥样硬化是目前公认的缺血性脑血管疾病重要危险因素,其主要是由血管平滑肌细胞以及炎性细胞、细胞外脂质组成,其中易损斑块局部炎症细胞浸润较多,斑块基底部存在大量的新生微血管,斑块脆性大,纤维帽薄,破裂风险较大;而稳定性斑块的纤维帽较厚,炎性细胞较少,破裂风险较低[6]。另有文献证实,炎症反应于动脉粥样硬化进展的不同时期均扮演着重要角色[7]。NLR是颈动脉粥样硬化斑块存在的有力预测因子,且有相关研究报道显示,NLR水平升高、混合斑块、非钙化斑块的患者预后不良风险较高[8]。另有研究学者发现[9],在动脉粥样硬化斑块的形成过程中,CRP、泡沫细胞以及补体复合物等沉积于动脉壁内,继而激活补体系统,导致大量炎症介质以及自由基的合成、释放,进一步引起血管内膜损伤以及不稳定斑块脱落。
本文通过多因素Logistic回归分析发现:LDL-C、NLR、hs-CRP均是影响ACI患者斑块稳定性的危险因素,说明随着上述指标水平的不断升高,ACI患者颈动脉粥样硬化斑块稳定性越差,这与黄伟[10]等研究中指出NLR水平与ACI患者的颈动脉粥样硬化斑块稳定性之间存在密切联系的结论基本相符,而张辉[11]等人的报道亦显示hs-CRP主要与ACI患者的血管内炎症状态有关,这是因为NLR于动脉粥样硬化形成、发展、破裂的全过程中均存在着极其重要的作用,其是反映中性粒细胞升高-急性炎症反应的指标,淋巴细胞减少-生理应激的指标的相反作用,因此其水平的升高促进了颈动脉粥样斑块的破裂。hs-CRP是临床上应用较为广泛的炎症反应敏感指标,其表达水平的升高反映了机体炎症反应的加重,继而增加了血管内皮细胞损伤的风险,进一步导致血栓形成风险升高,最终提高了斑块易损性,hs-CRP可通过上调下游IL-6以及IL-8等炎症细胞因子的活性,通过参与炎症因子对机体的损伤过程影响斑块稳定性,而降低LDL-C水平可减轻机体的炎症反应,从而逆转颈动脉粥样硬化斑块形成,因此LDL-C水平的升高不仅提示机体炎症反应随之增强,也意味着不稳定性斑块形成的风险提高[12-13],张增平的研究中亦指出IL-8水平的升高可以影响斑块稳定性[14],耿彪等人的报道虽未明显指出hs-CRP及LDL-C与斑块的形成有关,但其也证实了hs-CRP和IL-6等指标协同性地影响了颈动脉粥样硬化型斑块的形成[15],因此推测LDL-C、NLR、hs-CRP的升高促进了ACI患者不稳定斑块的形成。
综上所述,ACI患者的LDL-C、NLR、hs-CRP水平显著升高,且均与颈动脉粥样硬化斑块的稳定性密切相关。临床工作中可对LDL-C、NLR、hs-CRP进行检测,能够尽早发现不稳定斑块形成的风险,从而进行早期干预以降低不稳定斑块形成带来的不利影响。

