SPINK1在肝细胞癌中的表达及临床价值研究
严荣荣,管世鹤,杨 凯,张 浩,汪玲妹,李 姣
肝细胞癌(hepatocellular carcinoma,HCC)是全球癌症相关死亡的第四大原因,也是我国癌症相关死亡的主要原因[1]。手术切除是HCC主要的治疗方式,但HCC起病隐匿,大多数患者发现即为中晚期,错过了最佳手术时机;且HCC易复发,术后5年生存率低,预后较差[2]。甲胎蛋白(alpha fetoprotein,AFP)是现今临床上诊断HCC最常用的血清学标志物,但有约30%的HCC患者血清AFP检测结果为阴性,且在早期和较小肿瘤(≤2 cm)中AFP诊断效能亦不理想[3]。因此,寻找对HCC敏感且特异性高的筛查指标,对慢性肝病患者进行定期监测、早期干预对改善患者预后具有重要意义。
丝氨酸蛋白酶抑制剂kazal1型(serine peptidase inhibitor Kazal type1,SPINK1)又称为肿瘤相关胰蛋白酶抑制剂(TATI)或胰腺分泌胰蛋白酶抑制剂(PSTI),是一种分泌性多肽。在正常机体中的主要功能是抑制胰蛋白酶原的过早激活[4]。有研究[5]显示,SPINK1具有生长因子和凋亡抑制剂的功能,在促进肿瘤进展中发挥重要作用。目前,血清SPINK1已被发现可用于前列腺癌、胰腺癌等多种肿瘤的诊断及预后评估[6],但其在HCC的诊断及预后监测中的作用尚不明确。该研究旨在分析SPINK1单独及联合AFP检测对HCC的诊断效能,同时探讨SPINK1对HCC短期预后评估的价值。
1 材料与方法
1.1 病例资料收集2016年1月~2018年1月安徽医科大学第二附属医院收治的住院患者或健康体检者血清及临床资料,分为3组进行研究:① 慢性肝病组患者73例,男54例,女19例,年龄17~78(43.75±15.87)岁;② HCC组患者87例,男77例,女10例,年龄为31~74(56.56±11.68)岁。③ 健康对照组志愿者45例,男25例,女20例,年龄24~75(37.00±9.22)岁。慢性肝病组患者符合《中华医学会(中国肝病学会和中国传染病学会)制定的标准6》[7],排除合并肝硬化或其他类型肝炎的病例;HCC组患者符合《中华人民共和国卫生部制定的原发性肝癌诊断和治疗标准(2012)》[8]。健康志愿者的各项实验室指标及腹部B超均正常。三组研究对象在性别、年龄组成上差异无统计学意义(P>0.05)。研究经安徽医科大学第二附属医院伦理委员会审批,所有研究对象均签署知情同意书。
1.2 SPINK1的检测收集研究对象治疗前空腹全血,采集后1 h内室温离心(3 500 r/min,10 min)制备高质量血清,并于-70 ℃下冻存。采用ELISA法检测血清中的SPINK1,ELISA试剂盒购自美国R&D Systems公司,产品批号DY 7496/DY 008,酶标仪KHB ST-360购自上海科华实验系统有限公司。
1.3 AFP及肝功能指标的检测应用罗氏Cobas E601全自动电化学发光免疫分析仪(瑞士罗氏诊断公司)检测血清AFP,西门子Dimension EXLTMwith LM全自动生化分析仪(德国西门子诊断公司)检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB)、总胆红素(TBIL)、直接胆红素(DBIL)等指标。
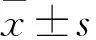
2 结果
2.1 SPINK1等血清学指标水平在各组中比较HCC组和慢性肝病组血清ALT、AST、DBIL、AFP和SPINK1水平较健康对照组均升高(P<0.05)。HCC组SPINK1及AFP水平与慢性肝病组及健康对照组相比差异均有统计学意义(χ2=87.28、72.55,P<0.01),慢性肝病组SPINK1水平与健康对照组差异无统计学意义(Z=2.27,P=0.07)。见表1。
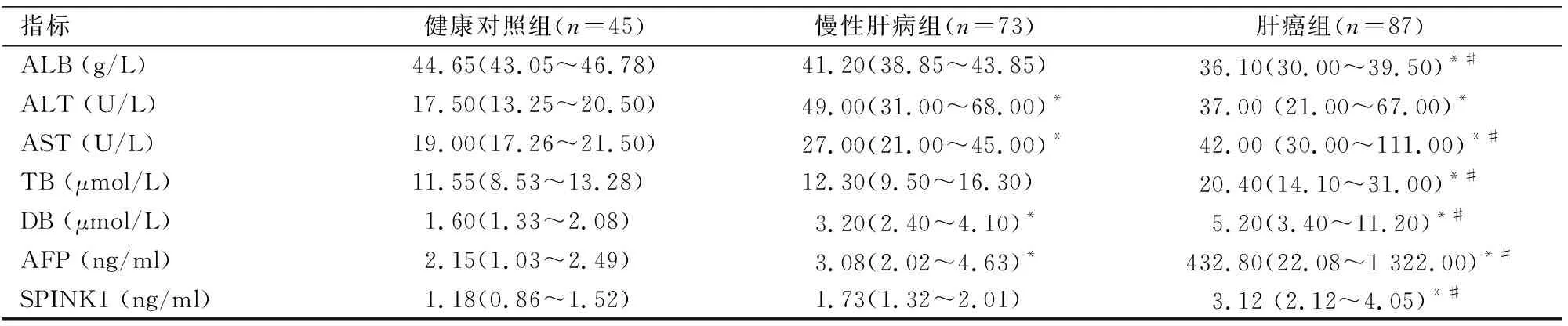
表1 3组患者的血清学指标比较[M(P25~P75)]
2.2 血清SPINK1与AFP对肝癌的诊断效能比较以非HCC组(健康对照组和慢性肝病组)或慢性肝病组为对照组绘制ROC曲线,均SPINK1诊断敏感度高于AFP,两指标曲线下面积差异无统计学意义(Z=1.234、0.739,P>0. 05)。联合检测时,均ROC曲线下面积高于SPINK1与AFP单独检测,差异有统计学意义(Z=2.543、2.262,P<0.05和Z=2.217、2.444,P<0.05)。以非HCC组(健康对照组和慢性肝病组)为对照组,AFP阴性(AFP≤20 ng/ml)HCC组为病例组,SPINK1的 ROC曲线下面积为81.70%(95%CI:0.74~0.88,P<0.01),取cut-off值为1.75 ng/ml时,特异度为71.18%,敏感度为95%。见图1及表2、3。

图1 应用ROC曲线分析血清SPINK1在HCC中的诊断价值

表2 血清SPINK1、AFP单独与联合检测对HCC诊断效能比较(以慢性肝病组为对照)

表3 血清SPINK1、AFP单独与联合检测HCC诊断效能比较(以健康对照组和慢性肝病组为对照)
2.3 血清SPINK1、AFP与HCC肝功能Child-Pugh分级的关系不同Child-Pugh分级HCC患者组间血清SPINK1、AFP水平不同,差异有统计学意义(H=26.82、10.17,P<0.01)。Grade C级患者血清SPINK1、AFP水平高于Grade A级患者(Z=2.91、4.95,P<0.01)。Grade B级患者血清SPINK1、AFP水平高于Grade A级患者(Z=2.36、3.02,P<0.05)。 Grade C级患者血清SPINK1、AFP水平高于Grade B级患者(Z=2.43、2.17,P<0.05)。见表4。

表4 不同 Child-Pugh 分级HCC患者血清 AFP、SPINK1指标比较
2.4 HCC患者DFS预测因素分析HCC患者均进行至少12个月随访,统计患者无病生存期(disease free survival,DFS)。患者中位生存时间为8个月,1年总生存率为38.1%。 Kaplan-Meier分析显示,SPINK1高表达组DFS低于SPINK1低表达组(P=0.001),见图2。Kaplan-Meier单因素生存分析提示血清SPINK1水平、血清AFP水平、肿瘤大小、Child-Pugh 分级对患者DFS均具有预测价值;多因素分析发现,血清SPINK1(HR=9.92,P<0.001),AFP(HR=2.41,P<0.05),肿瘤大小(HR=1.94,P<0.05)及Child-Pugh C级(HR=3.27,95%CI:1.15~9.26,P<0.05)均为HCC患者DFS的独立危险因素,见表5。

表5 HCC预后的单因素及多因素分析
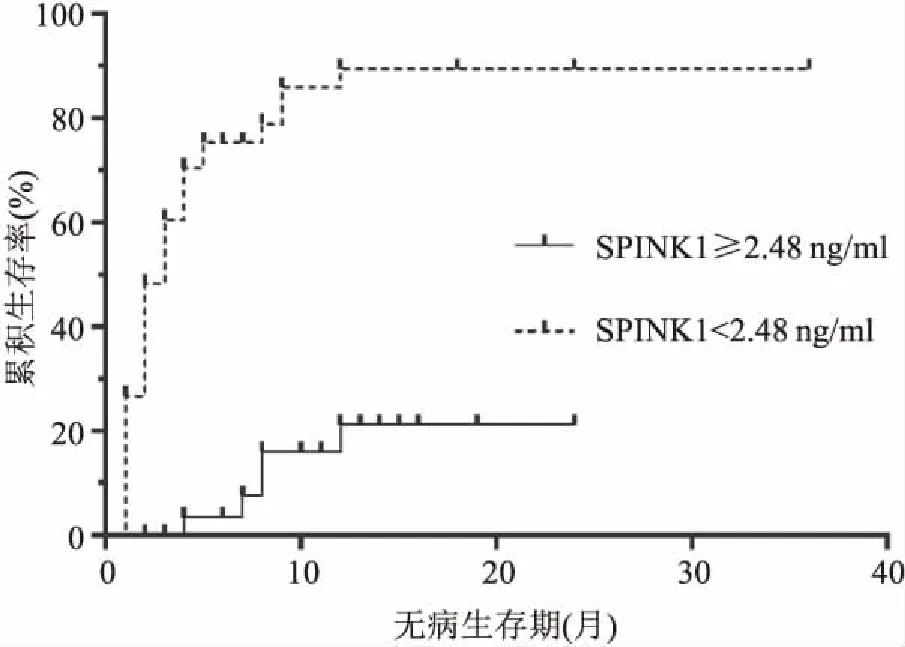
图2 SPINK1表达水平与HCC患者DFS的关系
3 讨论
我国HCC发病率占全球50%左右,由于早期不易诊断,且治疗后易复发,其总体预后不佳[2]。AFP作为HCC的常用筛查指标,其诊断效能欠佳。SPINK1是一种新的肿瘤标志物,在多种肿瘤中均有表达[6]。本研究中,HCC组的血清SPINK1水平较健康对照组和慢性肝病组升高(P<0.05),但慢性肝病组与健康对照组间差异无统计学意义(P=0.07),表明血清SPINK1能较好的鉴别良性肝病与HCC。经ROC曲线分析,血清SPINK1与AFP单独诊断HCC的ROC曲线下面积(0.879vs0.845)差异无统计学意义,提示两者鉴别HCC的能力相仿,面积大于0.8表明其诊断价值较高。与现有报道[9-10]相符。血清SPINK1与AFP联合检测可进一步提高诊断特异度(97.48%),有利于增强临床工作中对HCC的准确识别。血清SPINK1对AFP阴性的HCC也有补充诊断作用。以AFP阴性的HCC为病例组,当SPINK1 cut-off值取1.75 ng/ml时,其敏感度可高达95%。因此,定期筛查血清SPINK1可大大提高HCC的诊断率,具有较高的临床价值。
既往研究[5-6]表明,肿瘤患者体内SPINK1异常表达与不良预后密切相关。本研究中HCC患者血清SPINK1含量与Child-Pugh分级变化趋势基本一致(P<0.05),提示动态监测血清SPINK1有助于正确评估HCC患者疾病情况,该结果与文献[5,10]报道相符合。COX回归分析表明,SPINK1是HCC患者短期DFS的独立危险因素之一。此外,AFP水平升高、肿瘤体积较大、更高的Child-Pugh分级也影响HCC短期DFS,与既往报道[11-12]结果相符。因而,血清SPINK1作为HCC患者预后监测指标,对HCC的短期预后分层具有重要指导意义。
目前研究表明血清SPINK1是HCC良好的诊断和预后评判指标,然而其在HCC进程中扮演的角色尚不明确。有文献[5-6,13]报道,SPINK1与表皮生长因子(EGF)具有结构相似性,在肿瘤微环境中可通过EGFR信号途径促进肿瘤细胞EMT的发生,进而促进肿瘤细胞的侵袭和转移。此外,我国HCC的发生主要是由于乙型肝炎病毒(HBV)感染引起肝脏慢性炎症反复发作所致。Hass et al[10]研究表明SPINK1可通过干扰病毒感染肝细胞的凋亡而间接促进病毒的增殖。而Zhu et al[9]报道HBV可通过X蛋白增强肝癌细胞中SPINK1的表达。据此推测SPINK1可能通过与HBV相互作用促进HCC的发生及进展,然而其具体作用机制还需进一步探索。
综上,血清SPINK1对HCC有较高的诊断价值,在AFP阴性HCC的诊断中亦具有重要补充诊断意义。高水平SPINK1提示HCC的短期预后不良,可作为HCC预后分层的一个潜在血清标志物。

