嗜肺军团菌快速检测胶体金试纸的研制
张 秋,李 杰,王 猛,王 毅,杨 波,胡 征
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2. 湖北工业大学发酵工程教育部重点实验室,湖北 武汉 430068;3.工业发酵湖北省协同创新中心,湖北 武汉 430068)
嗜肺军团菌(Legionella pneumophila,Lp)是一种革兰阴性兼性胞内寄生菌,广泛存在于淡水环境中,属于条件致病菌[1],约占社区获得性肺炎病原菌的6%、院内感染肺炎病原菌的20%[2]。Lp的检测方法主要有培养法、血清学检测法、核酸检测法及抗原检测法,但这些方法均存在一定的不足。分离培养法细菌生长缓慢、操作繁琐、耗时长,且阳性检出率不高。血清学检测法主要是采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测急性期与恢复期患者的血清IgM抗体滴度,以判断是否存在感染,耗时较长,且不能进行床旁诊断[3]。核酸检测法是利用具有种属特异性的基因作为靶点进行聚合酶链反应(polymerase chain reaction,PCR)[4],操作繁琐,易出现假阳性。抗原检测法通过提取患者的呼吸道分泌物直接进行免疫荧光检测,检测速度较快,但灵敏度较低、特异性不高,有一定的交叉反应[5]。因此,亟需建立一种特异性高、灵敏度高、成本低且能快速检测嗜肺军团菌所有临床流行血清型的诊断方法,以满足临床诊疗的需求。生物膜层干涉(bio-layer interferometry,BLI)技术是一种非标记的,且可实时提供高通量生物分子相互作用信息的技术平台[6]。胶体金免疫层析快速检测技术具有操作方便、结果直观、特异性高等特点[7]。本研究拟通过BLI技术筛选出针对Lp特异性表面蛋白的高亲和力抗体,根据胶体金免疫层析法的基本原理,建立快速检测Lp的方法,为Lp感染的快速检测提供新的选择。
1 材料和方法
1.1 材料
Lp(ATCC 33152)、流感嗜血杆菌(ATCC 49247)、肺炎链球菌(ATCC 25238)、肺炎支原体(ATCC 15531)和卡他莫拉菌(ATCC 49619)均购自美国标准菌种库(American type culture collection,ATCC)。金黄色葡萄球菌、肺炎克雷伯菌、产酸克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、奇异变形杆菌及Lp的血清型Lp14、Lp12、Lp9、Lp6均为湖北省武警总医院的临床分离菌株。SP2/0骨髓瘤细胞由湖北工业大学发酵工程教育部重点实验室保存。BALB/c小鼠购自湖北省疾病预防控制中心,弗氏佐剂购自美国Sigma公司,鼠抗亚型鉴定试剂盒购自武汉三鹰生物科技有限公司,Sephadex G25和Protein A亲和层析填料均购自美国GE healthcare公司,CN140硝酸纤维素膜购自德国Sartorius公司。CB08玻璃纤维膜、CH37K吸水纸、 SM31-40 PVC板、HM3030 XYZ三维划膜喷金仪和ZQ2002型微电脑自动斩切机均购自上海金标生物科技有限公司。Octet Red96e分子相互作用仪、Ni-NTA传感器、Anti-M IgG Fc Capture Surface传感器(简称AMC传感器)均购自美国Fortébio公司。 DNA Marker和蛋白质Marker均购自武汉擎科生物技术有限公司,蛋白质彩色Marker购自上海翊圣生物科技有限公司。
1.2 方法
1.2.1 Lp-肽聚糖关联脂蛋白(peptidoglycanassociated lipoprotein,PAL)重组蛋白的表达和纯化 依据Lp的pal基因序列(468 bp,GenBank:X60543.1)设计引物:primer-F 5'-GG AATTCCATATGTGTTCTAAAACCCCAG-3'(NdeⅠ);primer-R 5'-CCGCTCGAGTCATCT TGTTGCCTCATAA-3'(XhoⅠ)。以Lp菌株为模板,在50 ℃条件下进行PCR扩增,NdeⅠ和XhoⅠ双酶切后,将其定向克隆到pET-28a(+)载体[8]上,通过双酶切初步鉴定,再进行基因测序。基因测序由武汉擎科生物技术有限公司完成。构建成功的重组质粒转化到表达菌株进行活化,在37 ℃条件下诱导表达,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)鉴定,取超声破碎后的上清液用0.45 μm滤膜过滤,然后用Ni柱亲和层析进行纯化,收集洗脱液,各取10 μL进行SDS-PAGE。
1.2.2 抗Lp-PAL重组蛋白的单克隆抗体(简称单抗)制备 (1)动物免疫。用100 μg Lp-PAL蛋白与等体积的弗氏完全佐剂充分乳化后初次免疫BALB/c小鼠。每隔10 d用相同剂量的抗原与弗氏不完全佐剂等体积充分乳化后加强免疫1次,免疫3次后取尾血测定血清效价;以样本组(血清)与空白组[磷酸盐缓冲液(phosphate-buffered saline,PBS)稀释液]吸光度(A)值比值>2.1且稀释倍数达到1∶100 000为有效效价[9],当达到有效效价时用100 μg免疫原腹腔进行加强免疫注射。(2)杂交瘤细胞株的制备。加强免疫3 d后按常规方法将脾细胞与SP2/0骨髓瘤细胞进行融合,采用间接ELISA筛选出产抗体的强阳性细胞株[10],具体步骤:抗原37 ℃包被2 h,2%牛血清白蛋白封闭1 h,杂交瘤细胞上清孵育1 h,羊抗小鼠孵育1 h,显色10 min并检测,实验温度均为37 ℃。(3)单抗的制备。取12周龄的BALB/c小鼠腹腔注射0.4 mL弗氏不完全佐剂,1周后腹腔注射杂交瘤细胞,7~10 d后收集腹水并用45%(NH4)2SO4对腹水进行初步纯化,经葡聚糖凝胶(Sephadex G25)除盐后采用Protein A亲和层析(甘氨酸缓冲液)进行纯化,收集的洗脱液冻干浓缩,再利用Sephadex G25柱将甘氨酸缓冲液更换为PBS。
1.2.3 抗Lp-PAL蛋白单抗的特异性分析 (1)ELISA鉴定特异性。将灭活的11种常见呼吸道病原菌及4种不同血清型Lp的细菌浓度调整至1×109CFU/mL,并进行超声破碎处理,作为间接ELISA中的抗原进行包被;采用间接ELISA(步骤同1.2.2)鉴定单抗的特异性,并用鼠抗亚型鉴定试剂盒鉴定单抗亚类。(2)免疫印迹法鉴定特异性。将灭活的肺炎链球菌、流感嗜血杆菌、卡他莫拉菌及Lp的细菌浓度调整至1×109CFU/mL,超声破碎,分别取4 μL经超声破碎处理后的4种菌液,另取5 μL Lp-PAL蛋白进行SDS-PAGE,再用半干法转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。以制备的单抗(3 μg/mL)作为一抗,以辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗小鼠抗体(武汉飞羿公司,1∶5 000稀释)为二抗,采用化学发光法显影。
1.2.4 BLI技术鉴定抗原抗体反应的特异性 (1)特异性鉴定。分别将不同浓度(0、30、100、300和1 000 nmol/L)的Lp-1和Lp-2单抗与同一浓度的抗原(Lp-PAL重组蛋白)进行反应,具体步骤:将AMC传感器浸入PBS中平衡60 s后,浸入待测抗体中固化180 s,再浸入PBS中平衡60 s,然后浸入抗原稀释液中反应120 s,再浸入PBS中解离120 s,最后浸入再生液(10 mmol/L 甘氨酸,pH值1.7)中再生30 s,见图1。以上过程用Octet Red96e分子相互作用仪进行实时检测。(2)采用竞争实验检验抗体识别抗原位点。将抗原(Lp-PAL重组蛋白)固化在Ni-NTA传感器上,然后依次与Lp-1单抗、Lp-2单抗相互作用,检测Lp-2单抗的结合信号,以判定2个抗体是否识别同一表位,Lp-2单抗结合信号比值>60%表明2个抗体间完全无竞争,<20%表明完全竞争;分2组进行实验,分别将Ni-NTA传感器在平衡液(PBS)中平衡60 s,固定抗原180 s,在PBS中平衡30 s,然后将Ni-NTA传感器先结合Lp-1单抗180 s,在PBS中平衡30 s,实验组结合Lp-2单抗,对照组结合PBS,浸入再生液中再生30 s,以上过程用Octet Red96e分子相互作用仪进行实时检测。(3)采用交叉反应实验鉴定抗体专一性。将相同浓度(1×109CFU/mL)的肺炎链球菌、卡他莫拉菌、流感嗜血杆菌、肺炎支原体、金黄色葡萄球菌、肺炎克雷伯菌、产酸克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、奇异变形杆菌和嗜肺军团菌用超声破碎,将其作为抗原与同一浓度(100 nmol/L)的2个抗体进行反应。具体步骤同特异性鉴定。

图1 AMC传感器的检测流程图
1.2.5 胶体金免疫层析试纸条的制备[11](1)胶体金结合垫的制备。采用柠檬酸钠还原法[12]制备40 nm的胶体金颗粒。(2)检测线和质控线的固定。将Lp-2单抗和羊抗小鼠抗体分别稀释至2.0、0.4 mg/mL,喷于硝酸纤维素膜上作为检测线(T线)和质控线(C线),间距为0.5 cm;将喷好的硝酸纤维素膜37 ℃真空干燥12 h以上,4 ℃密封干燥保存备用。(3)样品垫的制备。取1张CB08玻璃纤维素膜,将其在样品垫处理液(20 mmol/L Tris、3%蔗糖、1%牛血清白蛋白、0.3%聚乙烯吡咯烷酮、1% Tween20,pH值8.7)中浸泡至少2 h,再置于真空干燥箱内37 ℃干燥12 h,制成样品垫,室温密封干燥保存。(4)免疫层析试纸条的组装。将样品垫、结合垫、吸水纸依次贴在PVC底板上,将试纸切割成0.4 cm宽的试纸条,并与干燥剂一同封装于铝箔袋内。
1.2.6 测试方法与判定标准 将待检样本溶于0.9%NaCl溶液(含0.1% Triton X-100)中,取150 μL滴在样品垫上,10 min后判断结果。C线和T线均有条带,结果为阳性;C线有条带而T线无条带,结果为阴性;C和T线均无条带,结果无效。
1.2.7 试纸条的性能测试 (1)特异性测试。采用试纸条验证4种血清型Lp的特异性,采用试纸条分别检测超声破碎处理后的11种常见呼吸道病原菌,将菌浓度均调整为1×109CFU/mL,鉴定试纸条的特异性;(2)灵敏度测试。用0.9% NaCl溶液(含0.1% Triton X-100)将灭活的Lp梯度稀释为1×109、1×108、1×107、1×106和1×105CFU/mL,测试试纸条的灵敏度,实验重复2次。(3)稳定性和重复性测试。将3个不同批次的用铝箔袋密封的试纸条置于25 ℃储存6个月,每隔30 d用阳性样本和阴性样本进行检测,每个样本重复检测3次,观察重复性。
2 结果
2.1 Lp-PAL蛋白的制备和纯化结果
通过基因克隆得到的重组质粒经双酶切,在相对分子质量500 bp下方出现1个条带。将PCR产物进行测序比对,结果显示碱基序列未发生突变,表明构建成功。见图2。

图2 PCR扩增结果和重组质粒双酶切鉴定结果
在37 ℃条件下用异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)诱导成功表达,收集表达前后的样本进行SDS-PAGE,确定融合蛋白为可溶性蛋白,经Ni柱亲和纯化后收集洗脱的样本进行SDS-PAGE,见图3。目标蛋白相对分子质量为21 000(天然蛋白相对分子质量为19 000,Tag-His标签蛋白相对分子质量为2 000),在100 mmol/L咪唑洗脱液中出现目的条带,但杂蛋白较多;在150 mmol/L咪唑洗脱液中目标蛋白纯度可达95%以上,测定浓度后离心冻干,即得到目标抗原Lp-PAL蛋白。

图3 Lp-PAL融合蛋白的诱导表达和Ni柱亲和纯化结果
2.2 抗Lp-PAL蛋白单抗的制备及纯化结果
筛选到2株阳性杂交瘤细胞Lp-1和Lp-2,腹水抗体效价均为1∶52 100。将Lp-1细胞和Lp-2细胞分别注入5只12周龄的BALB/c小鼠体内,诱生腹水后采用45%硫酸铵沉淀法粗纯化稀释的血清样本,经Sephadex G25除盐,Protein A亲和纯化。2种抗体纯度均在90%以上,冻干后置-80 ℃保存。见图4。

图4 抗Lp-PAL蛋白单抗的SDS-PAGE结果
2.3 抗Lp-PAL蛋白单抗特异性分析结果
2.3.1 Lp-1及Lp-2单抗的特异性 间接ELISA结果表明,Lp-1及Lp-2单抗只与Lp发生阳性反应,与其他10种呼吸道常见病原菌(肺炎链球菌、卡他莫拉菌、流感嗜血杆菌、肺炎支原体、金黄色葡萄球菌、肺炎克雷伯菌、产酸克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、奇异变形杆菌)均无交叉反应。单抗的亚型鉴定结果表明,Lp-1和Lp-2单抗均为IgG1型,且均为κ轻链。
2.3.2 Lp-1及Lp-2单抗对Lp-PLA天然蛋白及重组蛋白的识别 免疫印迹法结果显示,Lp-1和Lp-2单抗与Lp-PLA天然蛋白及重组蛋白有强反应,与肺炎链球菌、流感嗜血杆菌和卡他莫拉菌无目的反应条带,Lp-1单抗与流感嗜血杆菌、卡他莫拉菌出现很浅且模糊的杂带,可能是非特异性结合的条带,Lp-2单抗未出现反应条带,见图5。
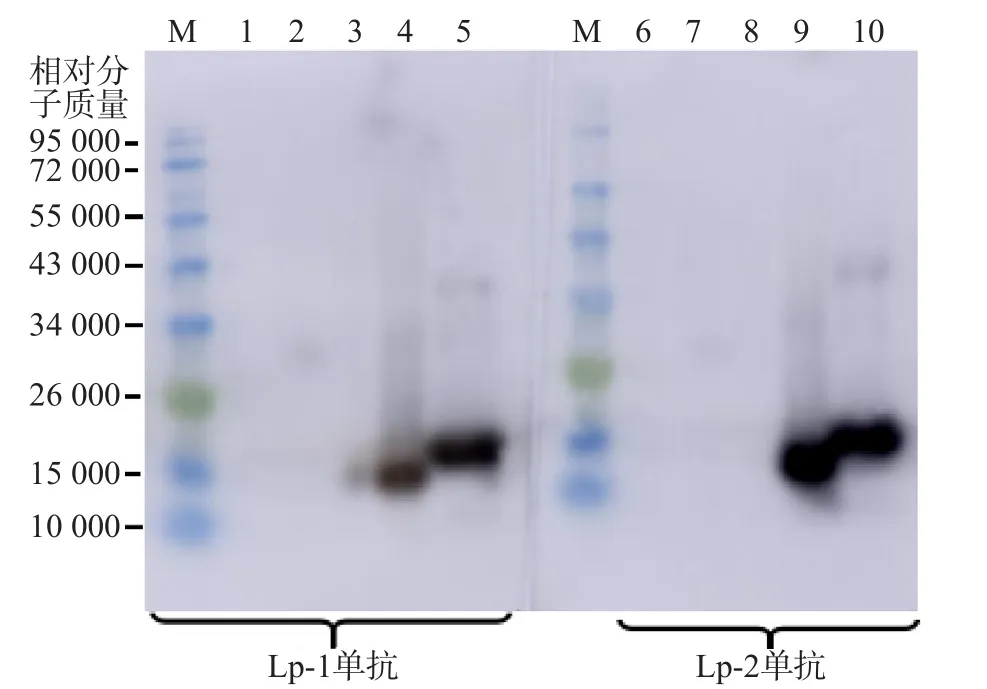
图5 Lp-1和Lp-2单抗的免疫印迹法结果
2.4 BLI技术鉴定结果
2.4.1 特异性鉴定结果 将不同浓度(0、30、100、300和1 000 nmol/L)的Lp-1、Lp-2单抗与同一浓度抗原(Lp-PAL重组蛋白)进行反应。结合动力学常数分析结果表明,Lp抗体与抗原的亲和力均能达109以上,提示抗原抗体的相互作用力均较强,见表1。结合解离图分析结果表明,Lp-1和Lp-2单抗结合速率均较快,且结合信号值较好,解离速率慢,提示筛选出的Lp-1和Lp-2单抗与Lp-PAL重组蛋白有较强的结合力。见图6。
2.4.2 竞争实验结果 将抗原(Lp-PLA重组蛋白)固化在Ni-NTA传感器上,依次与Lp-1、Lp-2单抗相互作用。根据传感器技术手册计算得到检测Lp-2的结合信号比值为77.53%,说明Lp-1和Lp-2单抗识别的是同一抗原的不同抗原表位。见图7。
2.4.3 交叉反应实验结果 Lp-1单抗和LP-2单抗只与Lp有强反应,与其他11种细菌(肺炎链球菌、卡他莫拉菌、流感嗜血杆菌、肺炎支原体、金黄色葡萄球菌、肺炎克雷伯菌、产酸克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、奇异变形杆菌和嗜肺军团菌)均无特异性反应,抗原抗体的专一性强。见图8。
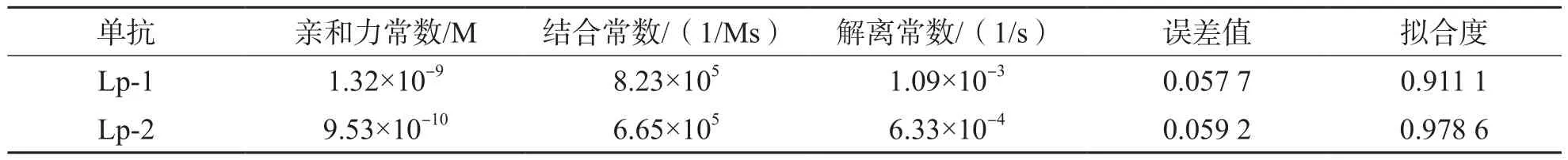
表1 Lp-1和Lp-2单抗与抗原Lp-PAL重组蛋白的相互作用动力学常数
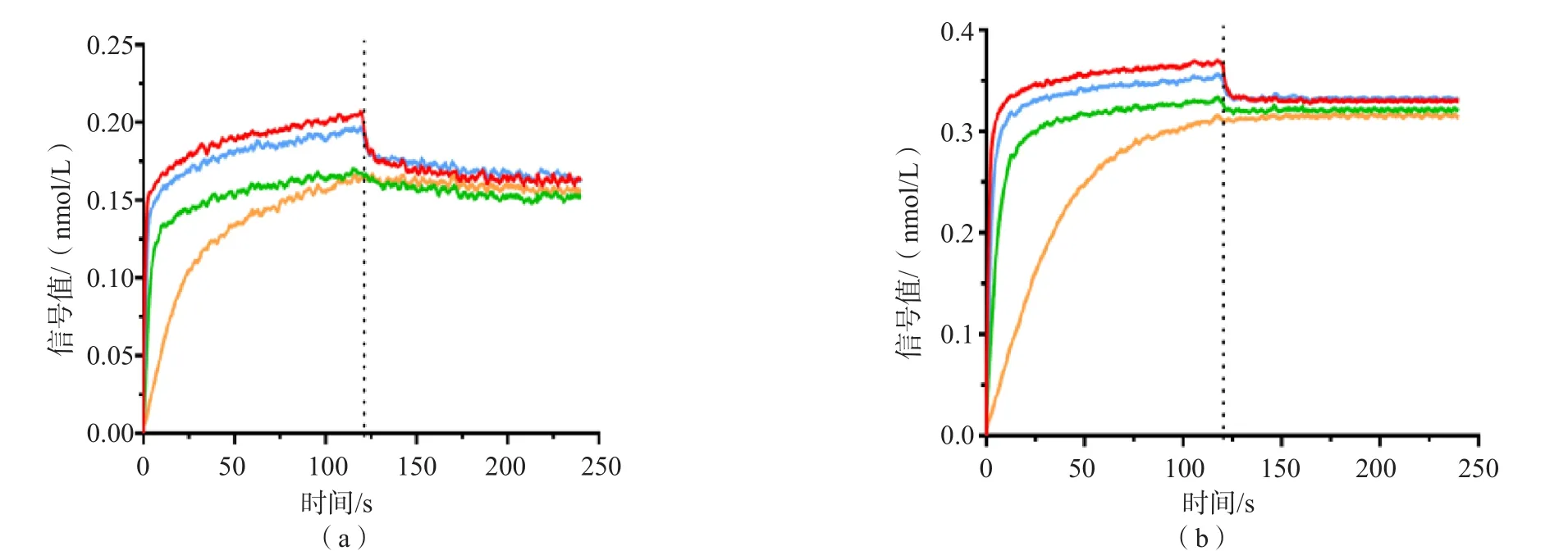
图6 Lp-1和Lp-2单抗与抗原Lp-PAL重组蛋白的结合、解离图
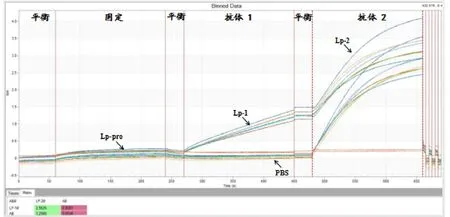
图7 Lp-1和Lp-2单抗相互竞争抗原Lp-PAL结合位点实验结果
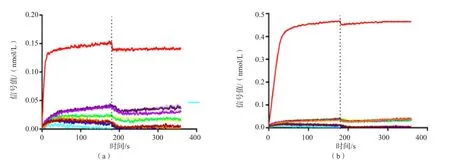
图8 交叉反应实验结果
2.5 胶体金免疫层析试纸条的性能评价
2.5.1 特异性 采用制备好的胶体金免疫层析试纸条分别检测细菌浓度为1×109CFU/mL的不同血清型Lp,以0.9%NaCl溶液作为阴性对照。结果显示,试纸条对Lp不同血清型(Lp12、Lp14、Lp9和Lp6)均有反应。采用胶体金免疫层析试纸条分别检测细菌浓度为1×109CFU/mL的11种常见呼吸道病原菌,其中Lp检测结果为强阳性,其他10种呼吸道常见病原菌检测结果均为阴性。见图9。

图9 胶体金免疫层析试纸条的特异性
2.5.2 灵敏度 当Lp浓度稀释至1×107CFU/mL时,T线上出现一条较弱的红色条带,继续稀释后进行检测,仅在C线上出现红色条带,因此胶体金免疫层析试纸条的检出下限(灵敏度)为1×107CFU/mL。见图10。

图10 胶体金免疫层析试纸条的灵敏度
2.5.3 稳定性和重复性测试 将胶体金免疫层析试纸条置于25 ℃储存6个月,每隔30 d取出进行检测,其特异性和灵敏度均未发生明显变化,且平行实验结果稳定。
3 讨论
Lp是一种可引起人类严重呼吸道疾病的病原微生物。军团菌肺炎在非典型性肺炎中是病情最重的一种,未经有效治疗者的病死率高达45%[8]。PAL蛋白是Lp中位于细胞表面的肽聚糖关联脂蛋白,与肽聚糖密切相关。对携带pal基因的片段进行测序,鉴定编码抗原的开放阅读框,发现该基因编码176个氨基酸,相对分子质量为18 913,通过信号肽酶Ⅱ切割出22个氨基酸,其共有序列证实该蛋白为脂蛋白[13]。KIM等[14]通过构建血清Ⅰ型Lp-PAL蛋白,制备多克隆抗体,采用ELISA检测尿液PAL抗原,证实PAL抗原存在于多种军团菌属内,是一种作为检测靶标的潜在广谱抗原,可用于泌尿系统感染的诊断。YOON等[15]通过PCR和免疫印迹法进一步证实PAL蛋白在军团菌中的保守性,提出Lp-PAL蛋白可作为军团菌感染的DNA疫苗候选物。鉴于PAL蛋白的高度保守性、种属特异性及表达广谱性,本研究以PAL蛋白作为Lp的检测靶标,建立相应的检测方法。
目前,针对军团菌感染的诊断主要依赖于军团菌抗原的检测。国外已有专门针对军团菌感染的血清Ⅰ型脂多糖抗原检测试剂盒[16],其敏感性可达90%以上,但检测不同血清型的Lp时会发生漏检。鉴于Lp感染的严重后果(致死率高达45%),开发能有效检测Lp所有血清型的检测试剂盒显得十分重要。
本研究通过基因工程方法获得PAL重组蛋白并通过杂交瘤技术筛选到2株分泌单抗的杂交瘤细胞株Lp-1和Lp-2。在免疫印迹法中出现的非特异性条带不影响检测,因试纸条中要2个抗体都非特异性结合1个抗原才会出现假阳性,说明筛选出的2种单抗均能特异性识别Lp-PLA天然蛋白和重组蛋白。该单抗组合能特异性识别多种血清型Lp菌体中的PAL天然蛋白,且与其他常见呼吸道病原菌无交叉反应,说明抗体所识别的抗原表位是Lp特有的,且2种单抗与Lp-PAL重组蛋白的结合无竞争效应及空间结合位阻效应,双单抗的选择有效保证了制备出的胶体金免疫层析试纸条的特异性。本研究制备的Lp检测试纸条只特异性识别Lp,具有较高的特异性。根据赵铁梅[17]的研究结果,Lp共有16个血清型,在Lp感染中,Lp12(21.8%)、Lp14(11.3%)、Lp9(3.5%)和Lp6(3.1%)均为较多见的血清型。本研究制备的胶体金免疫层析试纸条均能特异性识别以上Lp血清型,进一步证明PAL蛋白在Lp中的广谱表达性及保守性,适合作为Lp感染的检测靶标。
ADEGBOLA等[18]的研究结果显示,肺炎链球菌感染者上呼吸道中的细菌浓度>1×106CFU/mL,卡他莫拉菌感染者的细菌浓度>1×107CFU/mL。根据本研究的预实验结果,Lp感染患者咽拭子样本中的细菌浓度可达1×107CFU/mL以上,而Lp携带者细菌浓度均<1×105CFU/mL,因此本研究制备的胶体金免疫层析试纸条的灵敏度足以满足临床检测要求。
综上所述,本研究采用BLI技术鉴定出针对Lp的单抗,并以此为基础成功制备了检测Lp的胶体金免疫层析试纸条。相对于其他Lp的检测方法,该试纸条具有快速、特异、灵敏的特点,不需要培训专业人员和昂贵的仪器设备,可进行床旁检测,10 min内即可得到准确结果,尤其适用于对重症呼吸道感染患者的实时诊断,且有助于解决抗菌药物滥用等问题,具有广阔的应用前景。

