NLR在SARS-CoV-2感染中的临床意义
颜宇飞,金一鸣,刘明利,邓雪梅,秦 琴
(1.上海市杨浦区控江医院检验科,上海 200093;2.上海市杨浦区控江医院急诊科,上海 200093;3.武汉市第三医院感染科,湖北 武汉 430000;4. 海军军医大学第一附属医院实验诊断科,上海 200433)
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)属于β属冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径为60~140 nm,基因特征与急性呼吸综合征冠状病毒(severe acute respiratory syndrome-related coronavirus,SARSr-CoV)和中东呼吸综合症冠状病毒(middle east respiratory syndromerelated coronavirus,MERSr-CoV)有明显区别。新型冠状病毒肺炎作为急性呼吸道传染病已被纳入《中华人民共和国传染病防治法》规定的乙类传染病中,其实验室辅助检查包括白细胞(white blood cell,WBC)计数、淋巴细胞计数、C反应蛋白(C-reactive protein,CRP)、红细胞沉降率、降钙素原、肌酶、肝酶、乳酸脱氢酶(lactate dehydrogenase,LDH)等[1]。中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)是感染性疾病炎症标志物的研究热点之一,能综合体现感染者体内炎症反应和免疫状态,对疾病诊断有重要参考价值,但在确诊新型冠状病毒肺炎中尚未被使用。因此,本研究通过分析临床常用的WBC计数、CRP、淋巴细胞绝对数(the absolute value of lymphocyte,LYMPH#)、淋巴细胞百分比(the percentage of lymphocyte,LYMPH%),探讨NLR在SARS-CoV-2感染诊断中的临床意义。
1 材料和方法
1.1 研究对象
选取2019年1月30日—2020年2月10日在武汉市第三医院进行救治的SARS-CoV-2感染者70例作为感染组,其中男41例、女29例,年龄30~73岁,入组患者的诊断全部符合《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》[1]。另选取同期武汉市第三医院发热门诊患者50例作为发热组,其中男28例、女22例,年龄16~88岁,入组标准:无流行病学史;双肺影像学阴性;血液检查不符合SARS-CoV-2诊断标准。健康组50名,其中男27名、女23名,年龄23~58岁,为2019年上海市杨浦区控江医院体检健康人员。
1.2 方法
收集所有研究对象静脉血标本,采用Mindray BC-5390血液分析仪(深圳迈瑞生物医疗电子股份有限公司)检测血常规及CRP。检测过程严格按照标准操作规程进行操作,在4 h内完成检测。Mindray BC-5390血液分析仪校准品、质控品、试剂均为仪器配套专用产品。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析。经正态与方差齐性检验,正态分布计量资料以±s表示,组间比较采用方差分析。非正态分布计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Kruskal-WallisH检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价各项指标诊断SARS-CoV-2感染的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 感染组、发热组及健康组间各项指标比较
感染组N L R、C R P明显高于健康组(P<0.001),LYMPH#、LYMPH%明显低于健康组(P<0.001)。发热组NLR、CRP高于健康组(P<0.05),LYMPH#、LYMPH%低于健康组(P<0.05)。感染组NLR高于发热组(P<0.05),CRP、LYMPH#、LYMPH%与发热组差异均无统计学意义(P>0.05),WBC计数3个组间差异均无统计学意义(P>0.05)。见表1。
2.2 NLR、WBC计数、CRP、LYMPH%对SARS-CoV-2感染的诊断效能分析
ROC曲线分析显示,NLR、WBC计数、CRP、LYMPH%诊断SARS-CoV-2感染的曲线下面积(area under curve,AUC)分别为0.918、0.397,0.695、0.785。NLR诊断SARS-CoV-2感染的最佳临界值为2.94,敏感性为74.3%,特异性为92.0%,阳性预测值为90.5%,阴性预测值为85.6%,准确率为85.5%。本研究还比较了WBC计数、CRP、LYMPH%最佳临界值和临床常用诊断效能,结果见表2和图1。
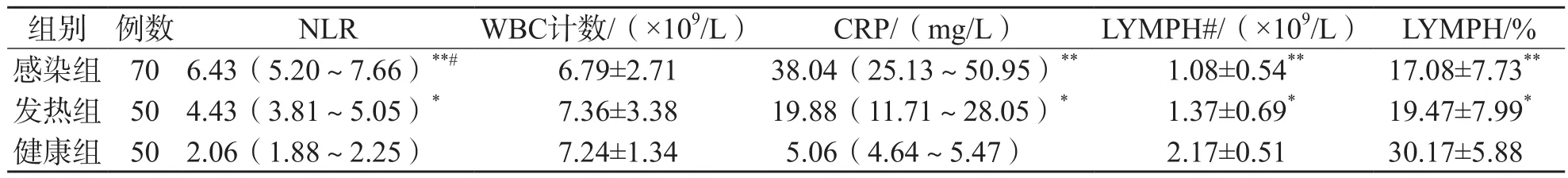
表1 感染组、发热组和健康组间各项指标比较
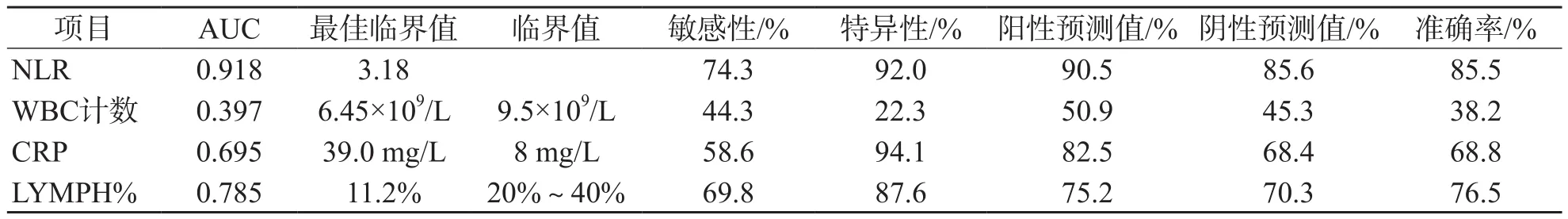
表2 NLR、WBC计数、CRP、LYMPH%对SARS-CoV-2感染的诊断效能评价

图1 NLR、WBC计数、CRP、LYMPH%诊断SARS-CoV-2感染的ROC曲线
3 讨论
SARS-CoV-2传染性强,人群普遍易感,且重型患者病情发展迅速,病死率较高。有报道显示,与其高度同源的严重急性呼吸综合征(severe acute respiratory syndrome,SARS)样冠状病毒感染后会导致细胞因子风暴,引起体内强烈的免疫反应,导致重症肺炎,甚至出现全身炎症反应综合征等[2]。YANG等[3]的研究发现,在SARSr-CoV感染者中常有WBC减少及免疫功能受损。ASSIRI等[4]在MERSr-CoV感染者的实验室检查中发现血小板和淋巴细胞减少,其他指标变化不大。目前,确诊患者是否感染SARS-CoV-2主要通过实时荧光定量逆转录聚合酶链反应检测患者呼吸道或血液标本中的病毒核酸。但是,由于此实验耗时长、呼吸道采样阳性率低、需多次采样进行阳性确认等问题,在我国感染人数较多、轻型患者影像学也未见肺炎表现的湖北等地可能会出现漏诊的情况。近年来,NLR作为系统性炎性反应指标受到临床关注,其变化不但能体现中性粒细胞在感染中的作用,还能反应淋巴细胞变化。当机体受到细菌或病毒感染时,NLR变化比WBC计数能更好地反映体内感染状况。在实际临床应用中,血常规检测操作简单、方便快速,能被各级医院广泛应用。因此,本研究探讨了NLR在SARS-CoV-2感染诊断中的临床意义。
目前,SARS-CoV-2感染实验室辅助检查中有WBC计数正常或减低,淋巴细胞计数减少,CRP升高,肌酶、肝酶、LDH增高等的情况[1],但未对其进行量化,也未知其实验敏感性与特异性。本研究结果显示,NLR、CRP、LYMPH#、LYMPH%水平的变化和SARS-CoV-2感染的发生有关,而且只有NLR水平的变化可以区分感染组、发热组和健康组,其他指标无法对其进行区分。ROC曲线分析显示,NLR诊断SARS-CoV-2感染AUC最高(0.918),有较好诊断价值,且诊断敏感性(74.3%)、特异性(92.0%)在本研究中也是最佳的,优于其他指标。
综上所述,在诊断新型冠状病毒感染中NLR特异性较好、准确性较高,有较好的诊断性能。但本研究对感染组患者未能进行临床分型(其中部分患者伴有其他基础疾病或细菌、病毒混合感染)、对发热组未能进行细菌或病毒感染分类、健康组也未能用到武汉市第三医院的样本,导致结果有许多不足之处,而且样本量较小,因此日后有待进一步进行大数据、多中心研究。
——2016学年期末汇报演出

