≥75岁老年患者血脂异常管理的专家共识
海峡两岸医药卫生交流协会老年医学专业委员会
心血管疾病的发病率随增龄显著升高。在心血管疾病中,高脂血症是重要危险因素,积极控制血脂可显著降低心血管病发病率和死亡率早已为临床共识。相对于65岁以下人群,65岁以上患者血脂管理的循证医学证据较少,高龄(≥75岁)老年人群的血脂管理证据尤为不足。且老年人常合并多系统疾病、同服多种药物,因此用药还需考虑治疗成本、药物特性和相互作用、患者体能、虚弱程度以及余寿等。尤其是≥75岁高龄老年患者,个体差异极大,而且不同的危险因素对高龄老年人的影响具有其独特性。
此外,随着增龄,以总胆固醇(total cholesterol,TC)预测冠状动脉事件的能力逐渐减弱,这种冠状动脉疾病与TC水平之间缺乏更直接的相关性,在高龄女性中更为明显。缘此,海峡两岸医药卫生交流协会老年医学专业委员会荟萃了海峡两岸血脂领域的专家,整合现有临床循证证据,深入研讨并撰写《≥75岁老年患者血脂异常管理的专家共识》。本共识立足于严谨的科学证据,提供具体实用的方法,提出适合我国≥75岁老年患者的血脂评价体系和治疗建议,进而有效管理我国高龄患者的血脂代谢异常。
1 高龄(≥75岁)老年人生理变化特点及共病对血脂代谢的影响
1.1 增龄带来的代谢变化
随年龄的增长,老年人从脂肪中摄取的热量百分比逐渐下降。同时,老年人无功能脂肪组织增加、低密度脂蛋白(low-density lipoprotein,LDL)受体减少、肝脏胆固醇储量增加等导致体内脂肪分解加速,为肝脏合成极低密度脂蛋白(very low-density lipoprotein,VLDL)提供更多游离脂肪酸(free fatty acid,FFA),引发高三酰甘油(triglyceride,TG)血症、高密度脂蛋白(high-density lipoprotein,HDL)降低和小而密低密度脂蛋白(small dense low-density lipoprotein,sdLDL)增多,后者更易于转化为氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL),具有更强的致动脉粥样硬化作用。在高龄老年人中,血脂代谢异常与能量摄入增加的相关性较小,更多的是与能量消耗的减少有关[1]。
1.2 共病对血脂代谢的影响
高龄患者多存共病状态,包括糖尿病(diabetes mellitus,DM)、慢性肾脏病(chronic kidney disease,CKD)、甲状腺功能减低等多种疾病,均可导致血脂代谢异常。
1.2.1 DM DM已成为老年患者最常见的疾病之一,美国约有50%的60岁以上老年人患有DM,而我国老年人的2型DM患病率也已高达22.8%。DM常合并血脂代谢异常,表现为:(1)空腹和餐后TG水平升高,即使在空腹血糖和TG水平控制正常后,更多存在餐后高TG血症;(2)HDL-C水平降低;(3)TC和LDL-C正常或轻度升高,且LDL-C发生质变,sdLDL-C升高;(4)载脂蛋白B(apolipoprotein B,ApoB)-100和ApoB-48升高。流行病学研究结果显示,LDL-C水平越高,DM患者的心血管疾病风险越大。LDL-C每增加10 mg/dl(0.26 mmol/L),DM患者心血管疾病风险可增加12%。而干预研究结果显示,每降低1 mmol/L的LDL-C,DM患者的主要不良心血管事件降低22%。
1.2.2 CKD 合并CKD的患者脂质代谢会发生变化,出现更多富含TG的脂质颗粒,具有更显著的致动脉粥样硬化倾向。在需要肾脏替代治疗的患者中,“营养不良-炎症-恶病质综合征”(malnutrition-inflammation-cachexia syndrome,MICS)对脂质代谢的影响是近年来关注的重点[2]。在MICS患者中,低胆固醇血症(hypocholesterolemia)会增加心血管事件的发生率,而无MICS的CKD患者中,高胆固醇与心血管病预后相关。
1.2.3 甲状腺功能减低 高胆固醇血症患者中合并甲状腺功能减低的比例约为4.0%,其中原发性甲状腺功能减低3.7%。甲状腺功能减低患者低甲状腺素水平促胆固醇合成效应明显强于降解作用,且由于LDL-C受体减少,TC和LDL-C水平升高。血脂代谢异常主要表现为TC、LDL-C、ApoB和脂蛋白α[lipoprotein(α),Lp(α)]升高,有时可伴有TG升高,HDL-C一般无明显变化[3]。
2 ≥75岁老年患者的全面调脂治疗中的靶点(表1)
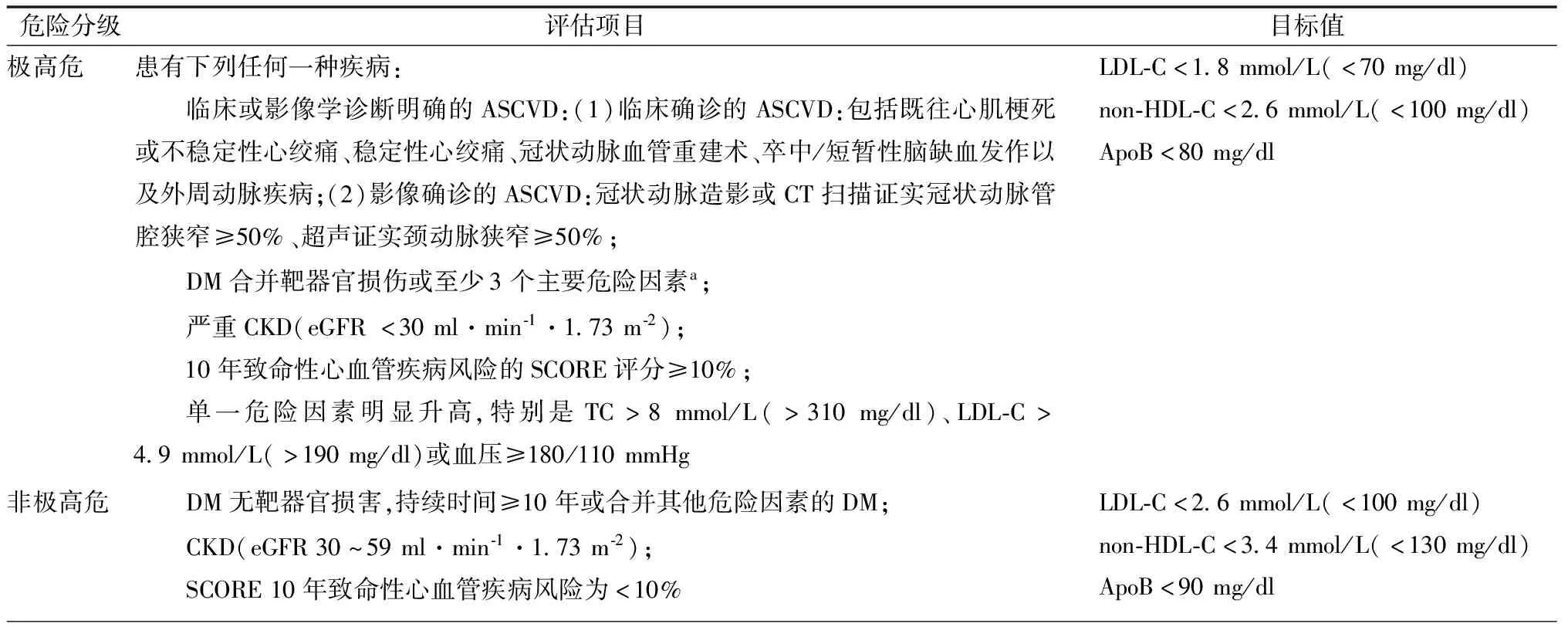
表1 ≥75岁老年患者血脂异常危险评估及调脂的靶目标值
2.1 LDL-C
最近更新的指南显示,LDL-C仍然是调脂治疗的最重要靶点,而且针对LDL-C的长期持续治疗较短期治疗获益更多。
2.2 ApoB
ApoB由肝脏合成,每一个Lp(α)、VLDL、LDL和中等密度脂蛋白颗粒中分别含有1分子ApoB。ApoB有ApoB-48和ApoB-100两种,前者主要存在于乳糜微粒中,90%以上的ApoB分布在LDL中,临床常规测定的ApoB通常指ApoB-100。由于ApoB-48所负载的乳糜微粒即使在餐后也不超过ApoB总含量的1%,故ApoB负载的脂蛋白总和等同于non-HDL-C。通过检测ApoB可以量化致动脉粥样硬化颗粒的总数。因此,ApoB在调脂治疗中的靶点地位显著提高[1,4]。
2.3 HDL-C
近年来研究发现,疾病状态下HDL-C与动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)预后的相关性较小,提示HDL-C在病理状态下易发生功能改变。ApoA-1氧化是HDL功能受损的重要原因。多项更新的指南中不再将HDL-C作为调脂治疗的主要靶点(J型曲线关系),但仍可作为风险评估的指标。
2.4 Lp(α)
高Lp(α)虽与ASCVD密切相关,但其作用弱于LDL-C。当Lp(α)过高[>180 mg/dl(4.3 mmol/L)]时,对ASCVD的影响酷似家族性高胆固醇血症。绝大多数高Lp(α)者与遗传相关,且Lp(α)在成年后变化较小,不需要连续监测[4]。
3 非药物治疗
相较年轻人而言,在老年人群中,减重、运动对调脂治疗效果非常有限,有研究报道其对心血管事件的影响可能来源于控制其他危险因素,如减重可提高细胞对胰岛素的敏感性,利于血压控制,进而对脂质代谢产生影响。
膳食方面,老年人群在保证营养的基础上,尽量减少饱和脂肪酸和反式脂肪酸的摄入,多摄入不饱和脂肪酸。进食应以水果、非淀粉类蔬菜、坚果、豆类、鱼、植物油、酸奶和全谷物为主,减少摄入红色和加工肉类、精加工的碳水化合物和高盐食物。虽然治疗性生活方式的改变在预防心血管不良事件的发生中可能有用,但其获益的主要机制并非来源于对血脂代谢异常的干预,并且在高龄老年人中作用非常有限。
专家共识推荐:
Ⅰ:≥75岁老年患者应在保证热量摄入的基础上,以摄入不饱和脂肪酸为主,不推荐积极的运动减重作为常规治疗
4 药物治疗
4.1 一线药物
4.1.1 他汀类药物 他汀类(statins)药物通过抑制3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶发挥作用,其本身或代谢物结构与HMG-CoA相似,他汀类药物对此酶的亲和力比HMG-CoA强1万倍,因此可于胆固醇合成的早期阶段竞争性抑制HMG-CoA还原酶的活性,从而使内源性胆固醇的合成减少,降低血清LDL-C、TG并可能轻度升高HDL-C水平。
洛伐他汀、辛伐他汀、氟伐他汀、阿托伐他汀和匹伐他汀均具有脂溶性,通过被动弥散进入肝细胞及非肝细胞。普伐他汀和瑞舒伐他汀具有水溶性,在有机阴离子转运多肽协助下进入肝细胞,少量进入非肝细胞。天然制剂洛伐他汀和半天然制剂辛伐他汀为前体药,经肝脏水解才有活性;合成他汀在体内不需水解即有活性。他汀的药代动力学特点、降胆固醇强度和循证医学证据见表2~4。
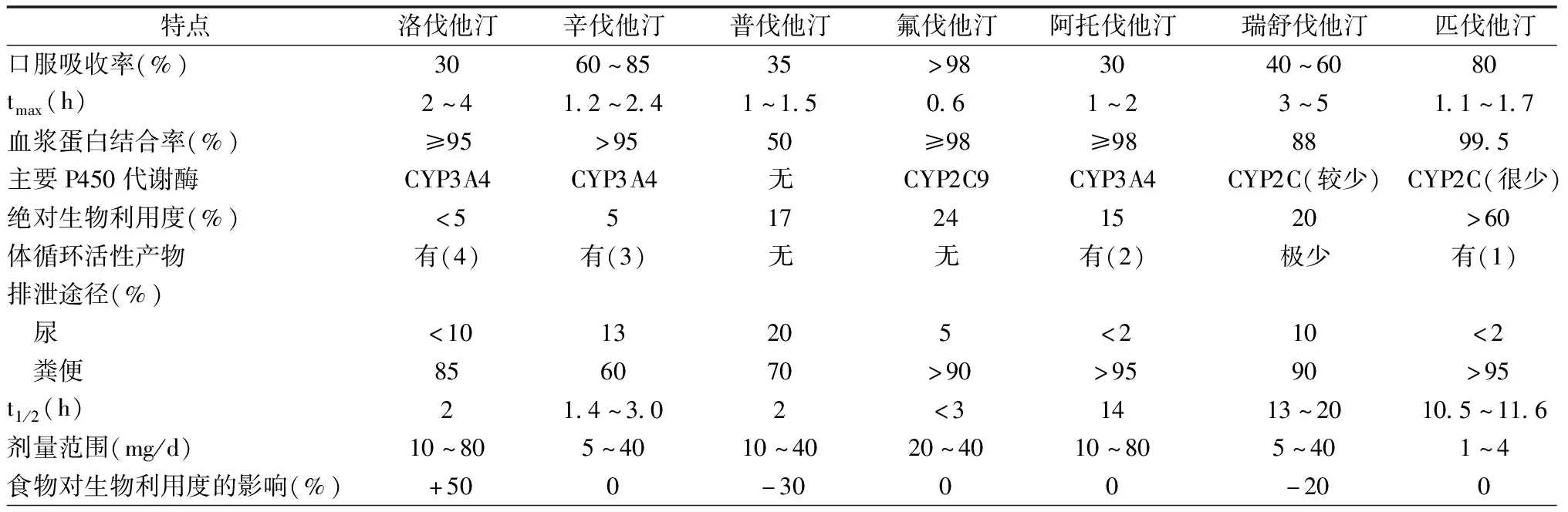
表2 HMG-CoA还原酶抑制剂药代动力学比较
4.1.1.1 一级预防证据 普伐他汀在高风险的老年人中的前瞻性研究(PROSPER研究)[5]入选患者平均75.4岁,该研究首次提供了他汀对≥75岁人群冠心病一级预防的获益证据,但入组对象中除外了存在认知功能障碍等共病的患者,因此在多重共病的高龄老年患者中的作用仍需进一步评估。JUPITER研究[6]中>70岁的老年亚组结果显示,其临床获益程度与其他年龄组人群相似。ALLHAT-LLT研究[7]中≥75岁的无ASCVD的患者,在接受普伐他汀治疗后非心血管死亡率有上升趋势(HR=1.34,P=0.07)。同时,来自JUPITER和HOPE-3的荟萃分析显示,≥70岁的患者服用他汀类药物过程中撤药率较高。老年患者合并衰弱综合征易发生他汀相关的肌肉症状(statin-associated muscle symptoms,SAMS)[8],表现为肌痛、疲乏无力等,严重者可出现横纹肌溶解,并且有限的预期寿命也减少了他汀的获益。
4.1.1.2 二级预防证据 2019年胆固醇协作组对28项他汀降脂的随机对照研究(186 854例)荟萃分析显示,≥75岁老年患者占8%,他们同样因调脂治疗而获益,LDL-C每降低1 mmol/L,主要不良心血管事件减少21%[9]。PROSPER研究[5]的二级预防人群中,住院时未使用他汀的缺血性卒中患者出院后使用他汀类药物在2年内严重不良心血管事件发生率更低。此外,CASTUO研究[10]显示,在≥75岁老年患者进行二级预防治疗的过程中,应用他汀治疗具有与其他年龄组相似甚至更多的获益。
专家共识推荐:
Ⅰ:≥75岁老年患者中,不推荐常规应用他汀类药物进行一级预防治疗;如75岁以前具有一级预防的指征并已使用他汀类药物,在年龄≥75岁后视共病、营养状态和不良反应等情况继续或减量使用他汀类药物
Ⅱ:≥75岁老年患者中,应将他汀类药物作为二级预防的首选药物,老年患者应从小剂量开始,根据患者的危险分层确定调脂的目标,逐渐合理调整剂量
Ⅲ:≥75岁老年患者中,首次应用他汀类药物治疗,应定期复查转氨酶及肌酸激酶水平
Ⅳ:≥75岁老年患者在调脂治疗达标的基础上,可首选亲水性他汀类药物(普伐他汀、瑞舒伐他汀等)以减少对肝脏和肌肉可能的影响
4.1.2 选择性胆固醇吸收抑制剂 选择性胆固醇吸收抑制剂的代表药物为依折麦布,可通过选择性抑制分布于小肠粘膜刷状缘的尼曼-匹克C1型类似蛋白1(NPC1L1)的载体活性,抑制食物、胆汁中的胆固醇和植物甾醇的吸收,降低循环胆固醇水平,LDL-C降幅达15%~22%。
SHARP研究[11]亚组分析显示,≥70岁老年患者二级预防中应用依折麦布获益更多,且耐受性好。IMPROVE-IT研究中,联用他汀类药物和依折麦布治疗较单用他汀类药物能更好地改善急性冠状动脉综合征患者的预后。EWTOPIA75研究[12]纳入了3 796例≥75岁且LDL-C水平≥140 mg/dl的患者,与单纯饮食治疗相比,饮食联合依折麦布治疗可使LDL-C降低超过21%,主要终点事件明显下降,且整体安全性良好。但对≥75岁老年患者,多存在胆固醇吸收功能降低,在高龄老年人中进行的小规模观察性临床研究并未发现类似效果,因此是否所有高龄患者均能通过服用依折麦布得到与该研究中日本老年人群一致的作用尚需进一步探讨。
专家共识推荐:
Ⅰ:≥75岁老年患者中,暂不推荐应用依折麦布作为一级预防治疗
Ⅱ:≥75岁老年患者中,若单独应用他汀类药物不能达标或存在严重不良反应风险者,推荐应用依折麦布作为联合用药进行二级预防,根据患者危险分层确定调脂目标值
4.1.3 前蛋白转化酶枯草溶菌素9抑制剂 前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)是肝脏合成的分泌型丝氨酸蛋白酶,结合并降解LDL受体,减少血清LDL-C清除。通过抑制PCSK9,可阻止LDL受体降解,促进LDL-C清除。PCSK9抑制剂无论单用或与他汀类药物联用均明显降低血清LDL-C水平,降幅平均60%左右,并改善HDL-C和Lp(α)。
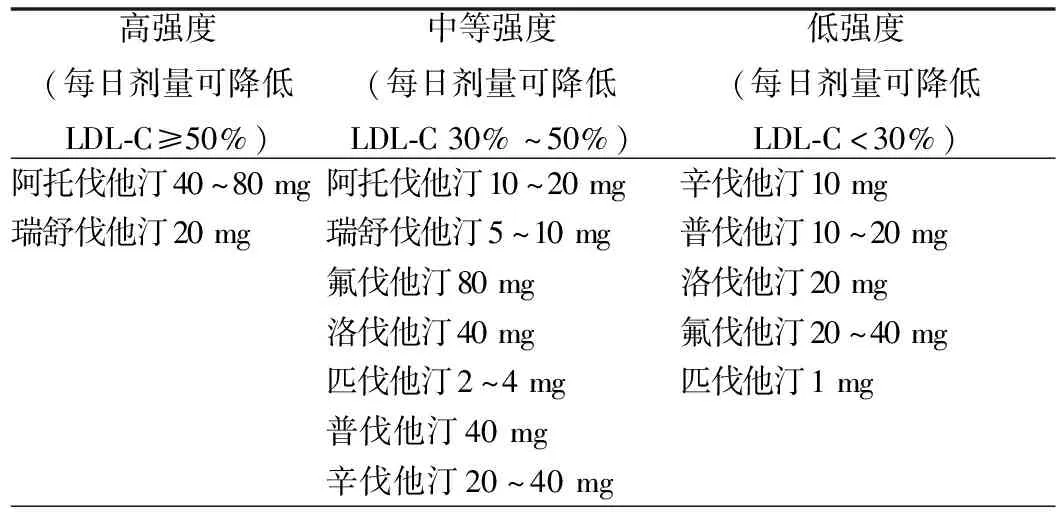
表3 他汀类药物降胆固醇强度
ODYSSEY[13]、FOURIER[14]等研究均显示,PCSK9抑制剂在应用他汀类药物、依折麦布基础上可进一步显著降低LDL-C水平,心血管获益显著且整体安全性良好。FOURIER研究中针对亚洲人群的亚组分析显示,其减少心血管事件的效果与其他人群一致。目前针对PCSK9抑制剂对阿尔茨海默病和认知功能影响的意见尚不一致,EBBINGHAUS研究[15-16]证实了PCSK9抑制剂联合他汀类药物治疗并不影响受试者的认知功能。PCSK9抑制剂对认知功能无明显影响很可能与血脑屏障存在相关,血脑屏障不仅使循环中胆固醇水平高低不会对大脑脂质水平产生直接影响,且会限制PCSK9及其单克隆抗体进入中枢神经系统。但在所有相关研究中,纳入的≥75岁老年患者比例较低,且缺乏此类患者的相关亚组分析。
专家共识推荐:
Ⅰ:≥75岁老年ASCVD患者的二级预防中,PCSK9抑制剂可考虑作为他汀类药物或联用他汀和依折麦布仍不达标患者的联合用药选择;根据患者危险分层确定调脂目标值
Ⅱ:≥75岁老年ASCVD患者,接受PCSK9抑制剂治疗时,建议应定期复查转氨酶及肌酸激酶水平
4.2 其他药物
以下各类药物均可改善大部分患者的血脂水平,但并无充足的证据支持此类药物对≥75岁老年人群的单一治疗或为他汀类药物的辅助治疗。
4.2.1 胆汁酸结合树脂(考来替泊、考来烯胺和考来维纶)主要优势为不经过全身吸收。
4.2.2 贝特类(非诺贝特、苯扎贝特和吉非罗齐) 主要用于降低TG和升高 HDL-C,其中吉非罗齐还可能增加他汀药物的不良反应,通常不推荐与他汀类药物合用。
4.2.3 烟酸类 升高HDL-C的同时可轻微地降低LDL-C和TG,目前研究表明联用他汀类药物和烟酸并未显示进一步心血管获益。
4.2.4 普罗布考 既是降脂药又是抗氧化药物,通过减少ox-LDL在巨噬细胞的积累,抑制泡沫细胞的形成,是其抗动脉粥样硬化的主要机制。其降脂作用缺乏选择性,可同时降低LDL-C和HDL-C。但缺乏普罗布考用于≥75岁老年人群降脂、抗氧化或心血管获益方面的证据。
4.2.5 微粒体三酰甘油转移蛋白抑制剂 洛美他派(lomitapide)的作用机制是通过抑制微粒体三酰甘油转移蛋白的活性而抑制TG向ApoB转运,从而减少VLDL的生成、继而减少LDL-C。
4.2.6 ApoB-100合成抑制剂 米泊美生(mipomersen)是一种较短的单链反义寡核苷酸,它可特异性地与编码ApoB的mRNA的碱基结合,从而抑制mRNA的翻译,减少ApoB的合成,从而减少VLDL生成和分泌。
4.2.7 鱼油 其所含的ω-3脂肪酸等成分,可将TG浓度降低25%~30%,膳食剂量或低剂量(<1 g/d)补充时,TG水平小幅降低,而摄入较高剂量鱼油(3~4 g/d)时,TG水平明显降低,最高降幅达45%。
专家共识推荐:
Ⅰ:≥75岁老年ASCVD患者,不常规推荐以上药物用于一级和二级预防
Ⅱ:≥75岁老年ASCVD患者,高纯度鱼油(ω-3)可作为胆固醇代谢异常合并高TG血症的辅助治疗,但普通鱼油仅为保健品,需经医生确认后方可服用
5 ≥75岁老年共病患者的调脂治疗
5.1 合并DM
目前的证据支持ASCVD合并DM患者需要更严格的血脂管理。T-SPARCLE研究[17]显示,non-HDL-C能预测DM患者主要不良心血管事件的发生,相反无DM者则未发现这种相关性。DM患者血脂异常的显著影响在IMPROVE-IT研究中得到证实,联用辛伐他汀和依折麦布可降低LDL-C水平,但仅在DM患者中可显著降低主要不良心血管事件。基于这些证据,2016年美国心脏病学会(ACC)专家共识[18]建议,合并DM的ASCVD患者使用他汀类药物若未达标,可考虑加用依折麦布等其他非他汀类药物,以达到LDL-C<70 mg/dl或non-HDL-C<100 mg/dl的靶目标。
专家共识推荐:
Ⅰ:在≥75岁老年人群中,确诊ASCVD合并2型DM的患者,建议将调脂目标定为LDL-C<70 mg/dl或non-HDL-C<100 mg/dl的靶目标
Ⅱ:在≥75岁老年ASCVD合并2型DM的患者中,可首选中等强度的他汀药物治疗(表2),若治疗未达标,可谨慎考虑加用依折麦布或PCSK9抑制剂作为联合用药
5.2 合并CKD
既往研究显示,CKD可能通过改变脂蛋白谱增加ASCVD风险。既往随机对照研究表明,晚期CKD患者TG升高,LDL-C水平降低,是主要不良心血管事件的重要危险因素,在接受他汀类药物治疗的CKD患者中,non-HDL-C水平仍具有显著预测价值。因此,合并CKD患者可将non-HDL-C<100 mg/dl作为靶目标。

表4 老年人使用他汀类药物的主要临床证据
专家共识推荐:
Ⅰ:在≥75岁老年人群中,存在严重CKD[肌酐清除率(eGFR)<30 ml·min-1·1.73 m-2]患者的调脂治疗,可将non-HDL-C作为调脂治疗的靶点,以non-HDL-C<100 mg/dl作为靶目标
Ⅱ:在≥75岁老年人群中,对存在MICS的患者,应避免出现严重低胆固醇血症(TC<60 mg/dl)
5.3 合并肿瘤
肿瘤患者常合并其他疾病,约55%肿瘤患者至少合并一种疾病,而心血管疾病为最常见合并症之一。≥75岁老年患者中,肿瘤发生率较低年龄组更高,研究提示,≥75岁老年患者发生癌症的累积风险为21.4%,死于癌症的风险为17.7%。脂质代谢可能与肿瘤发生发展相关,脂质代谢异常和肿瘤的发生发展相互促进,但不同的肿瘤其血脂代谢特点并不相同。肿瘤细胞快速增殖需要不断补充能量和合成构件大分子,为此肿瘤细胞的代谢信号发生明显改变,其中最重要的是脂肪酸合成增强、分解降低。有证据表明脂肪代谢的关键酶——脂酸合酶在乳腺癌[19-20]、前列腺癌、肺癌、结直肠癌[21]等多种癌症中均有高表达,不仅可以作为一种新的肿瘤标志物,更与不良预后密切相关。在肿瘤治疗过程中,内分泌治疗等方式也常常会导致脂质代谢异常。对肿瘤合并脂质代谢异常的患者,中国乳腺癌内分泌治疗多学科管理血脂异常管理共识专家组与中国成人血脂异常防治指南意见基本相似。若肿瘤患者出现恶液质表现,患者预期寿命显著受限,除突发心血管事件外,不建议常规进行降脂治疗。
专家共识推荐:
Ⅰ:在≥75岁老年ASCVD患者中,针对合并不同的肿瘤分类以及不同治疗方案应进行更为详细的评估,同时对此类患者的营养状态进行跟踪监测;可进行营养及衰弱评分
Ⅱ:在≥75岁老年ASCVD患者中,出现严重的低胆固醇血症(TC<60 mg/dl),应停用所有降脂药物
Ⅲ:在≥75岁老年ASCVD合并肿瘤患者中,存在恶液质状态的,除突发心血管事件外,不建议常规进行调脂治疗
5.4 衰弱综合征
衰弱是一种与增龄有关的综合征,以五种表型来进行识别:原因不明的体重下降、疲惫、虚弱、行走速度缓慢和低体力活动。在高龄老年人中,衰弱常呈现“反向流行病学(reverse epidemiology)”特征,即观察到的流行病学中传统的危险因素与不良事件的关联与一般人群中发现的关联相反[22]。高龄患者中,低胆固醇血症和高炎症标志物均与衰弱相关,胆固醇水平的下降是衰老过程中不可避免的一部分,可以作为死亡事件的重要预测因素。
衰弱的高龄老年人在接受降脂药物治疗时,因患者意愿而拒绝接受治疗或在治疗过程中存在较高的中断治疗比例。在参加大规模临床试验过程中,由于衰弱导致参加比例低或失访比例极高。同时,低HDL-C和低白蛋白血症常被建议作为诊断衰弱的标准,并与短期死亡率有极高的相关性。因此,由于衰弱导致的低HDL-C和低TC可用来预测高龄老年人心血管事件的发生。
专家共识推荐:
Ⅰ:≥75岁老年人群中,如确诊为衰弱综合征,调脂治疗的靶目标值应适当放宽,所有患者无论极高危、非极高危分层均以中低危分层设定的调脂目标值为准,同时避免出现低胆固醇血症(TC<150 mg/dl)
Ⅱ:≥75岁老年人群中,如监测发现存在明确衰弱的老年人血脂水平过低,出现严重的低胆固醇血症(TC<60 mg/dl),应停用所有降脂药物
6 调脂治疗的不良反应及相关处理原则
6.1 他汀类药物导致肝脏及肌肉损害风险
HPS2-THRIVE研究[23]表明,使用中等强度他汀类药物治疗时,中国患者肝脏不良反应发生率明显高于欧洲患者,肌病风险也高于欧洲人群10倍。大部分中国患者尤其是≥75岁的老年患者不需采用大剂量他汀类药物治疗,对他汀类药物不耐受或胆固醇水平不达标者,可考虑联用其他调脂药物,如联用依折麦布、PCSK9抑制剂治疗。尤其要关注通过细胞色素P4503A4代谢的药物与他汀类药物的相互作用导致肌病或横纹肌溶解(表5)。

表5 与他汀类药物联用可能发生严重不良反应的药物
专家共识推荐:
Ⅰ:≥75岁老年患者中,首次应用他汀类药物,应小剂量起始,用药前和用药后6周检测并于其后定期监测肝功能及肌酶水平,如出现明显乏力、肌痛表现应及时检测,根据肝酶及肌酶升高情况酌情减量
Ⅱ:≥75岁老年患者中,如应用他汀治疗过程中,转氨酶升高超过正常上限3倍或肌酸激酶超过正常上限10倍,应及时停药
Ⅲ:≥75岁老年患者中,可以优先选择亲水性他汀类药物,如普伐他汀、瑞舒伐他汀等为首选药物
6.2 他汀类药物导致新发DM风险[24]
老年患者长期服用他汀类药物,与新发DM(new-onset diabetes,NOD)具有相关性,这种相关性具有剂量依赖性。高龄和强化他汀治疗是NOD的危险因素。荟萃分析显示,他汀类药物导致NOD的发生率升高9%。JUPITER研究[6]显示,他汀类药物可降低胰岛素敏感性,从而影响血糖控制,引起2型DM发病增加;Koh等[25]的荟萃分析比较普伐他汀、阿托伐他汀、辛伐他汀和瑞舒伐他汀对胰岛素敏感性的影响,发现普伐他汀可增加患者胰岛素敏感性和脂联素分泌,而辛伐他汀、瑞舒伐他汀、阿托伐他汀可致胰岛素敏感性下降和脂联素分泌减少,考虑他汀类药物的亲脂性可能与胰岛素分泌减少有关。SPARCL研究[26]显示,阿托伐他汀的强化治疗会导致NOD的发生率升高19%。在相关危险因素方面,代谢综合征、随机血糖受损、体质指数>30 kg/m2、糖化血红蛋白大于6%均可能导致NOD发生率增加。但更多研究[27]显示,即使NOD风险增加,在ASCVD患者中应用他汀类药物治疗的获益仍远高于可能的NOD风险。
专家共识推荐:
Ⅰ:≥75岁的老年患者DM发病率高,且较少接受强化调脂治疗方案,因此不推荐接受他汀治疗患者常规监测NOD风险
Ⅱ:≥75岁的老年患者可首先选择亲水性他汀类药物,其中普伐他汀较其他他汀类药物临床证据相对更多
Ⅲ:≥75岁老年ASCVD患者中,应用他汀类药物治疗的获益仍远高于可能的NOD风险,NOD出现后可根据血糖情况给予相关治疗
6.3 药物导致的继发血脂异常
合成甾体类药物可降低HDL-C,对LDL-C影响的变异较大。肿瘤治疗药物中,如雌激素类可导致血脂异常。糖皮质激素同时升高TG、HDL-C和LDL-C。维生素A升高TG、LDL-C,降低HDL-C。干扰素导致高TG血症。抑制排斥反应的药物如环孢素、麦考酚酯亦可导致或加重血脂代谢异常。治疗艾滋病的抗逆转录病毒药物,尤其是蛋白酶抑制剂(如克力芝,为洛匹那韦和利托那韦复合制剂),导致TG、LDL-C以及其他脂质代谢异常,增加动脉粥样硬化风险。近期发表的研究[28-29]显示,艾滋病患者出现脂质代谢异常,应用他汀类药物和PCSK9抑制剂均安全、有效。
专家共识推荐:
Ⅰ:≥75岁的老年患者多存在多重共病,联合用药时,对药物相互作用进行评估非常必要
Ⅱ:≥75岁老年患者中,长期应用糖皮质激素、治疗艾滋病的蛋白酶抑制剂等均可能导致继发性血脂代谢异常,需密切监测血脂水平
Ⅲ:≥75岁老年患者中,他汀类药物仍为首选药物,调脂治疗不达标者,可联合PCSK9抑制剂
6.4 老年患者特殊类型血脂代谢异常:低胆固醇血症
低胆固醇血症指血清TC<150 mg/dl。严重的低胆固醇血症定义为血清TC<60 mg/dl。低胆固醇血症被认为是各种病理状态下发病率和死亡率升高的预后指标[30]。胆固醇过低可导致细胞膜的稳定性和流动性发生改变,从而引发细胞膜结构和功能的异常进而影响机体细胞的正常功能。研究显示胆固醇水平与死亡率呈“J”形关系,提示胆固醇水平过低可导致死亡风险高,且低胆固醇血症出现越早,死亡风险越高。此外,低胆固醇血症可导致认知障碍的风险增加,且是潜在恶性肿瘤的重要影响因素。
6.5 对认知功能和帕金森病的影响
鹿特丹队列研究和檀香山亚洲衰老研究(HAAS)发现,高胆固醇血症的参与者帕金森病风险更低。在护士健康研究和HPFS研究中,帕金森病风险随着自我报告血胆固醇水平的增加而降低。但亦有研究显示,高胆固醇血症与帕金森病的发生呈正相关,因此目前认为尚存在不确定的混杂因素影响。同时,在高龄老年人群中,不良的健康状态,尤其是衰弱综合征可作为认知功能减退的预测因素[31]。
7 结语
我国心血管疾病的发病率和死亡率均随年龄增长而显著上升。虽然与中年/初老期(65~75岁)人群相比,≥75岁高龄老年人血脂管理的循证医学证据较少,但现存证据仍支持使用他汀类药物降低其心血管疾病的死亡率。对于≥75岁高龄老年人群,综合利弊得失,包括临床获益、不良反应及治疗成本等,仍应以LDL-C为治疗主要靶点,辅以non-HDL-C和ApoB进行多靶点全面调脂干预,对所有≥75岁的ASCVD患者进行二级预防;并密切关注不良反应,尤其是肝脏和肌肉的损害。同时,须依据高龄老人的个体化情况选择药物种类和调整药物剂量等,以期达到最优化和合理的治疗方略。
《≥75岁老年患者血脂异常管理的专家共识》专家委员会
顾问:高润霖(中国医学科学院阜外医院),何青(北京医院 国家老年医学中心),陈红(北京大学人民医院),郭静萱(北京大学第三医院),李勇(上海华山医院),杨新春(首都医科大学附属北京朝阳医院),杨跃进(中国医学科学院阜外医院)
主持:卢长林(首都医科大学附属北京朝阳医院),俞梦越(中国医学科学院阜外医院),刘德平(北京医院 国家老年医学中心)
执笔:钱海燕(中国医学科学院阜外医院),王征(北京大学第三医院),刘德平(北京医院 国家老年医学中心),卢长林(首都医科大学附属北京朝阳医院),俞梦越(中国医学科学院阜外医院),陈冠群(中国台湾振兴医疗财团法人振兴医院)
专家委员会成员(按姓氏笔画顺序)
马长生(首都医科大学附属北京安贞医院),王乐丰(首都医科大学附属北京朝阳医院),王吉云(首都医科大学附属北京同仁医院),王红石(首都医科大学附属北京朝阳医院),王连生(南京大学附属第一医院),王征(北京大学第三医院),王焱[厦门大学附属心血管病医院(厦门市心脏中心)],王显(北京中医药大学附属东直门医院),卢长林(首都医科大学附属北京朝阳医院),叶宏一(中国台湾马偕医院),史旭波(首都医科大学附属北京同仁医院),乔锐(安徽医科大学附属安庆医院),任景怡(中日友好医院),刘宇(首都医科大学附属北京朝阳医院),刘德平(北京医院 国家老年医学中心),刘巍(首都医科大学附属北京安贞医院),孙英贤(中国医科大学附属盛京医院),孙昊(首都医科大学附属北京朝阳医院),苏晞(武汉亚洲心血管病医院),李广平(北京世纪坛医院),李田昌(中国人民解放军总医院第六医学中心),谷新顺(河北医科大学附属第二医院),李拥军(河北医科大学附属第二医院),李忠佑(北京大学人民医院),李惟铭(首都医科大学附属北京朝阳医院),李静(首都医科大学宣武医院),杨士伟(首都医科大学附属北京安贞医院),杨中甦(首都医科大学附属北京朝阳医院),杨伟宪(中国医学科学院阜外医院),杨进刚(中国医学科学院阜外医院),杨跃进(中国医学科学院阜外医院),杨新春(首都医科大学附属北京朝阳医院),吴岳平(厦门大学附属中山医院),吴炜(中国医学科学院北京协和医院),吴造中(中国台湾台大医院),何青(北京医院 国家老年医学中心),何奔(上海交通大学医学院附属仁济医院),何冀芳(首都医科大学附属北京朝阳医院),佟子川(首都医科大学附属大兴医院),宋俊贤(北京大学人民医院),张大鹏(首都医科大学附属北京朝阳医院),张岩(北京大学分子医学研究所),张岩(北京大学第一医院),张建军(首都医科大学附属北京朝阳医院),张海澄(北京大学人民医院),张萍(清华大学附属长庚医院),张智勇(首都医科大学附属北京朝阳医院),张福春(北京大学第三医院),陈凤荣(北京大学第三医院),陈红(北京大学人民医院),陈纪言(广东省人民医院),陈牧雷(首都医科大学附属北京朝阳医院),陈冠群(中国台湾振兴医疗财团法人振兴医院),陈静(武汉大学人民医院),陈肇文(中国台湾荣民总医院),周玉杰(首都医科大学附属北京安贞医院),单健(美国克利夫兰医学中心),胡中权(中国香港圣玛丽医院),胡泽平(安徽医科大学第一附属医院),侯东明(美国印第安纳大学医学中心),俞梦越(中国医学科学院阜外医院),洪涛(北京大学第一医院),聂绍平(首都医科大学附属北京安贞医院),夏昆(首都医科大学附属北京朝阳医院),钱海燕(中国医学科学院阜外医院),徐立(首都医科大学附属北京朝阳医院),徐亚伟(上海第十人民医院),徐波(中国医学科学院阜外医院),殷伟贤(中国台湾振兴医疗财团法人振兴医院),高润霖(中国医学科学院阜外医院),郭远林(中国医学科学院阜外医院),郭炜华(首都医科大学附属北京同仁医院),郭宗生(首都医科大学附属北京朝阳医院),郭静萱(北京大学第三医院),唐熠达(中国医学科学院阜外医院),黄觊(首都医科大学附属北京安贞医院),崔鸣(北京大学第三医院),崔炜(河北医科大学附属第二医院),彭建军(北京世纪坛医院),蒋忠想(中国香港伊丽莎白医院),蒋学俊(武汉大学人民医院),傅向华(河北医科大学附属第二医院),雷警输(首都医科大学附属北京朝阳医院——燕达院区),谭宁(广东省人民医院),霍勇(北京大学第一医院)
利益冲突:无

