miRNA-100低表达间充质干细胞对急性髓细胞性白血病细胞增殖、凋亡的影响及机制
缪华纬,孔凡良,蒋英俊,王凤云
合肥市第二人民医院,合肥230011
急性髓细胞性白血病(AML)是一种高度恶性的血液性疾病[1,2]。表观学调控尤其是微小RNA(miRNA)对其靶基因的转录调节在白血病发生发展中起着关键作用[3,4]。有研究显示,基因的异常改变可以导致miRNA功能失活,从而导致白血病干细胞增殖、分化[6,7]。miR-100被报道参与AML的发生发展[8],但是其作用机制尚未明确。近年来的研究表明,白血病的发生发展受到微环境的调控,尤其是间充质干细胞(MSC)[9]。2019年1~9月,本研究观察了MSC中miR-100表达失调对AML细胞恶性生物学行为的影响,现报告如下。
1 材料与方法
1.1 细胞与主要实验材料 人骨髓MSC(BFN60808567)购买于青旗生物技术发展有限公司。人白血病细胞株K562来源于安徽医科大学。K562细胞采用完全培养基进行培养。当细胞培养至80%融合度时进行传代。所有细胞均培养于无菌细胞培养箱中(37 ℃、5% CO2)。DMEM、胎牛血清、青霉素、链霉素皆购自美国Gibco公司。miRNA-100的相关引物购于Invitrogen公司。miRNA提取试剂盒购自TaKaRa公司。miR-100-3p inhibitor质粒、慢病毒载体购自上海汉恒公司。6孔细胞培养板购于康宁公司。PI染色试剂盒购于碧云天公司。Western blotting实验所用一抗购自美国CST公司,二抗购自美国Sigma公司。
1.2 miR-100低表达MSC的构建 将MSC分为两组,分别感染miR-100-NC和miR-100-inhibitor慢病毒。感染后观察荧光强度,并通过嘌呤霉素筛选稳定细胞株。待所有细胞均有荧光表达时即可停止筛选,扩大培养获得稳定表达目的基因的细胞株。采用qRT-PCR法检测MSC中的miR-100,以GAPDH作为内参。GAPDH上游引物序列为5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物序列为5′-GGCTGTTGTCATACTTCTCATGG-3′。miR-100上游引物序列为5′-AACCCGUAGAUCCGAACUUGUG3′,下游引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGGTCACTGGAT-ACGACCACAAGT-3′。
1.3 MSC与K562细胞共培养及分组 两组MSC培养3 d后,胰酶消化黏附生长的MSC。取1×104个细胞接种于6孔板,待过夜,加入消化好的K562细胞(悬浮生长)。共培养3 d后,吸取培养基(含有K562细胞),离心沉淀获取K562细胞,与感染miR-100-NC慢病毒MSC共培养的细胞为对照组,与感染miR-100-inhibitor慢病毒MSC共培养的细胞为低表达组。
1.4 K562细胞增殖能力观察 ①MTT实验:于共培养3 d后采用MTT法检测细胞增殖能力。将20 μL的MTT溶液分别加至每个孔并将6孔板置于37 ℃孵箱中孵育2 h。用移液枪吸净孔内培养基及MTT溶液,加入DMSO溶液,在摇床上避光溶解30 min后,上机检测OD值表示细胞增殖能力。②克隆形成实验:共培养3 d后采用平板克隆实验反映细胞增殖能力。收集细胞,在6孔板中以5×102/孔接种,加入2 mL完全培养基,放于孵箱中培养14 d。用PBS清洗6孔板,晾干后加入0.1%结晶紫染色1 h左右,清洗并拍照,观察克隆形成情况,并计算克隆形成数。
1.5 K562细胞周期蛋白检测 采用Western blotting法检测细胞中的细胞周期依赖性激酶4(CDK4)、细胞周期蛋白D1(Cyclin D1),以β-actin为内参。
1.6 K562细胞凋亡情况观察 ①调亡细胞:采用流式细胞术。取两组K562细胞,测定总细胞数。取1×106个细胞用含10% FCS、1%叠氮化钠的冰冷PBS重悬,再向每根离心管中添加100 μL细胞悬液。按照1∶200加入7AAD和Anexin V染料,室温孵育30 min,离心洗涤后上机检测凋亡细胞。②调亡相关蛋白:采用Western blotting法检测细胞中的凋亡相关蛋白Bcl-2样蛋白x(Bax)、cleaved Caspase-3,以β-actin为内参。
1.7 低表达miR-100的MSC中差异表达生长因子检测 收集感染miR-100-NC和miR-100-inhibitor慢病毒的MSC,采用qRT-PCR法检测细胞中已知参与白血病细胞增殖调节的生长因子,结果显示低表达miR-100的MSC中骨形态发生蛋白4(BMP4)基因表达显著上调(分别为0.12±0.02、1.62±0.31,P<0.05)。
1.8 K562细胞培养液中BMP4检测 根据“1.3”进行细胞分组与处理,采用ELISA法检测K562细胞培养液中的BMP4。
1.9 BMP抑制剂Noggin对K562细胞增殖、凋亡的影响观察 将K562细胞分为对照组、低表达组和实验组,对照组细胞与感染miR-100-NC慢病毒的MSC共培养;低表达组和实验组细胞与感染miR-100-inhibitor慢病毒的MSC共培养,实验组共培养1 d后加入Noggin蛋白。培养2 d后收集K562细胞,采用MTT实验和平板克隆实验检测细胞增殖能力,流式细胞术检测凋亡细胞,采用Western blotting法检测CDK4、Cyclin D1、Bax、cleaved Caspase-3,以β-actin为内参,方法同上。

2 结果
2.1 低表达组与对照组细胞增殖能力比较 低表达组细胞共培养72 h细胞增殖能力高于对照组(P<0.05)。见表1。低表达组、对照组共培养3 d克隆形成数分别为(59±0.05)、(71±0.09)个,低表达组高于对照组(P<0.05)。
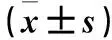
表1 两组细胞增殖能力比较
2.2 低表达组与对照组细胞周期蛋白表达比较 低表达组细胞中Cyclin D1、CDK4相对表达量分别为6.25±0.17、8.21±0.49,对照组Cyclin D1、CDK4相对表达量均为1,低表达组Cyclin D1、CDK4相对表达量高于对照组(P均<0.05)。
2.3 低表达组与对照组细胞凋亡情况及凋亡相关蛋白表达比较 低表达组、对照组细胞凋亡率分别为15.9%±1.08%、25.13%±2.31%,低表达组细胞凋亡率低于对照组(P<0.05)。低表达组Bax、cleaved Caspase-3相对表达量分别为0.12±0.02、0.23±0.01,对照组分别为1、1,低表达组Bax、cleaved Caspase-3相对表达量低于对照组(P均<0.05)。
2.4 低表达组与对照组培养液中BMP4水平比较 低表达组、对照组培养液中BMP4水平分别为(598±0.28)、(386±0.21)pg/mL,低表达组培养液中BMP4水平高于对照组(P<0.05)。
2.5 外源性noggin对K562细胞增殖、凋亡的影响 实验组共培养72 h后细胞增殖能力低于低表达组,低表达组增殖能力高于对照组(P均<0.05)。见表2。实验组、低表达组、对照组克隆形成数分别为(86±0.26)、(202±0.68)、(102±0.30)个,实验组克隆形成数少于低表达组,低表达组克隆形成数高于对照组(P均<0.05)。实验组CDK4与Cyclin D1相对表达量低于低表达组,低表达组CDK4与Cyclin D1表达高于对照组(P均<0.05)。见表3。实验组、低表达组、对照组细胞凋亡率分别为13.60%±0.65%、0.25%±0.32%、11.20%±0.02%,实验组细胞凋亡率高于低表达组,低表达组凋亡率低于对照组(P均<0.05)。实验组Bax、cleaved Caspase-3相对表达量高于低表达组,低表达组Bax、cleaved Caspase-3相对表达量低于对照组(P均<0.05)。见表3。
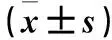
表2 三组细胞增殖能力比较
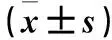
表3 三组细胞中CDK4、Cyclin D1、Bax、cleaved Caspase-3相对表达量比较
3 讨论
miRNA的异常调节与AML的发生发展密切相关[10]。前期有研究报道miRNA在白血病中呈现不同的表达趋势,其中miR-100低表达[11,12]。然而miR-100是如何调节AML的进程,当前知之甚少。
MSC是白血病微环境中重要的支持细胞。在获得特定的基因修饰后,MSC能够被转化为对维持造血干细胞或白血病干细胞增殖和稳态有利的支持细胞[13]。Lena等[14]报道在MSC中敲除IKBα或PARγ小鼠皆能发生骨髓增殖性肿瘤。MSC作为微环境中的一员对骨髓增殖性肿瘤甚至是白血病的发生发展至关重要。有报道表明,MSC中的miR-100可通过外泌体的形式参与mTOR/Hif1α信号调控,进而影响乳腺癌的恶性进程[15]。本研究结果显示,miR-100敲低的MSC能够促进白血病细胞的增殖,减少细胞凋亡,细胞周期蛋白与凋亡相关蛋白表达也相应发生变化。这表明miR-100敲低后,MSC可能通过某种机制影响白血病细胞的增殖和凋亡。细胞周期的调控主要由细胞周期调控蛋白决定[16]。本研究显示,与miR-100低表达的MSC共培养后,CDK4在K562细胞中呈现高表达,提示通过靶向CDK4可能会在miR-100低表达的AML中具有转化治疗前景。
MSC对白血病细胞的影响至少有两种,一是分泌细胞因子直接影响白血病细胞的功能[17],二是通过分泌趋化因子募集其他白细胞(如单核细胞)对白血病细胞的功能产生影响[9]。本研究采用体外实验模拟两种细胞之间的作用,细胞因子的筛选成为本研究的重点。我们对报道过参与白血病细胞增殖调节的细胞因子进行筛选,结果显示BMP4蛋白上升水平最高。BMP信号通路调控干细胞稳态,同时也参与了肿瘤的发生发展[17]。但是,BMP信号通路是否调控白血病细胞的增殖,目前仍然知之甚少。本研究结果显示,与miR-100敲低的MSC共培养的K562细胞培养液中BMP4水平升高,提示MSC可能参与BMP4的分泌;而抑制BMP后,K562细胞增殖受到抑制、凋亡增多,提示miR-100敲低后K562细胞增殖、凋亡的变化可能与BMP4水平变化有关。因此,BMP4很有可能参与形成白血病干细胞的维持、自我更新,并调节白血病细胞的代谢。通过靶向BMP信号通路可能有助于改善miR-100低表达白血病患者的预后。
结合上述研究结果,我们认为,miR-100低表达的MSC可促进AML细胞增殖、抑制其凋亡,可能是通过上调BMP4水平实现的。这一发现将有助于靶向BMP信号通路的特异性药物的研发和应用。

