TRIM55在胃癌组织、细胞中的表达变化及其与肿瘤恶性生物学行为的关系
田树波,刘景磊,彭利盼,孔帅
山东第一医科大学附属省立医院,济南250021
胃癌是严重影响人们健康和威胁生命的常见肿瘤[1]。胃癌治疗主要是以手术为主的综合治疗[2]。胃癌的发生发展机制还未完全阐明,并且缺乏有效的早期诊断标志物。因此,寻找和鉴定胃癌分子标志物,对于胃癌的早期诊断、治疗及预后评估十分重要。三结构域蛋白(TRIM)家族由众多成员构成[3],部分成员在肿瘤发生发展过程中参与了细胞的转录调控、细胞的增殖凋亡等过程,从而发挥促癌或抑癌的作用[4,5]。TRIM家族蛋白结构多样性的特点,决定了其功能的多样性。TRIM55也称肌肉特异性RING锌指蛋白2(Murf 2),其可维持肌肉发育和心肌功能。TRIM55在骨骼肌分化和肌纤维生成的早期阶段发挥重要作用[6]。研究表明,在SARS-CoV感染中,miR-30-5-5p可以调控TRIM55的表达[7]。TRIM55在肝癌组织中低表达,是肝癌的独立预后因素,其可以通过上皮-间质转化(EMT)和MMP2通路调节肝癌细胞的侵袭转移[8]。本研究观察了胃癌组织中TRIM55的表达变化,探讨TRIM55与预后的关系,以及TRIM55对胃癌细胞恶性生物学行为的影响,现报告如下。
1 资料与方法
1.1 胃癌组织及细胞来源 选取山东省立医院胃肠外科2014年7月~2015年12月收治的具有完整随访资料的91例胃癌患者的肿瘤组织及癌旁正常胃黏膜组织标本,所有组织均经HE染色病理检查证实。91例患者中,男61例、女30例,平均年龄63.6岁。收集患者的性别、年龄、肿瘤位置、肿瘤病理分期及淋巴结转移情况等资料。随访自术后1个月开始,主要是以电话和门诊复诊的方式,随访至患者死亡或截至2019年12月。91例中,死亡56例,存活35例。本研究经医院伦理委员会批准,所有患者签署知情同意书。胃癌MGC803细胞培养于含10%胎牛血清的培养基中,并于37 ℃、5% CO2、饱和湿度的细胞培养箱中进行培养。当细胞融合度至80%~90%时按照1∶2比例将细胞传代。
1.2 胃癌组织中TRIM55检测 将胃癌组织制作成病理组织芯片,然后进行染色。先用二甲苯进行脱蜡,柠檬酸盐缓冲液进行抗原修复。PBS洗4次后用BSA封闭液37 ℃封闭,滴加TRIM55一抗(1∶200稀释),4 ℃孵育过夜,PBS洗4次。按照免疫组化检测试剂盒说明书,加入二抗,室温孵育20 min。PBS清洗后,加入链霉亲和素-过氧化物酶结合物,孵育20 min。用DAB进行染色,镜下观察着色情况,终止显色后用苏木素复染,脱水。加入二甲苯透明后用中性树脂封片。在显微镜下观察并拍照,用图像分析软件对图片进行分析。根据染色强度评分,无着色为0分、淡黄色为1分、棕黄色为2分、褐色为3分;按阳性细胞百分比评分,无阳性细胞为0分、1%~10%为1分、11%~50%为2分、51%~75%为3分、76%~100%为4分。两项得分相乘,≥4为TRIM55高表达。
1.3 TRIM55低表达后胃癌细胞增殖、迁移、侵袭能力观察
1.3.1 细胞分组及TRIM55 siRNA转染 将胃癌细胞分为两组,即转染靶向TRIM55的siRNA组(si-TRIM55组)和转染阴性对照干扰组(si-NC组)。根据TRIM55的CDS编码序列,构建靶向TRIM55基因片段的siRNA。siRNA-TRIM55上游序列为5′-AUCAAACUUCUCACAAAGCUC-3′,下游序列为5′-GCUUUGUGAGAAGUUUGAUUA-3′;阴性对照si-NC上游序列为5′-UUCAUUUAGGGAGUUCAACCA-3′,下游序列为5′-GUUGAACUCCCUAAAUGAAUG-3′。应用Lipofectamine2000分别将siRNA-TRIM55或si-NC转染MGC803细胞。应用TRIzol试剂提取胃癌细胞中的总RNA,分光光度计下测定OD260/280值,测定RNA浓度。采用TaKaRa逆转录试剂盒逆转录合成cDNA,采用real-time PCR法检测TRIM55,以GAPDH为内参。TRIM55上游引物序列为5′-GGTTTTGGATAGACATGGGGT-3′,下游引物序列为5′-TTCTCCTCTTGGGTTCGGGT-3′。以2-ΔΔCt表示TRIM55的相对表达量。结果si-TRIM55组TRIM55 mRNA相对表达量低于si-NC组(P<0.05),转染成功。
1.3.2 胃癌细胞增殖能力观察 胃癌细胞培养于6孔板中,转染36 h后,将细胞以2×103个/孔的密度接种到96孔板中,分别于24、48、72、96 h后向每孔加入10 μL的CCK-8,于培养箱孵育4 h后,用酶标仪测定450 nm处的吸光度值(OD450),根据OD值绘制细胞生长曲线。
1.3.3 胃癌细胞迁移、侵袭能力观察 取对数生长期的胃癌细胞,胰酶消化后以无血清培养基重悬并调整细胞密度为1×106/mL,取200 μL接种于Transwell板的上室,下室内加入含10%胎牛血清的培养基。侵袭实验需要在小室内膜表面铺基质胶。细胞于培养箱中培养48 h后,弃去上室内培养基并用棉签擦去上室内残余细胞,多聚甲醛固定下室细胞30 min后用结晶紫染色,于显微镜下观察下室内细胞的数量。

2 结果
2.1 胃癌组织中TRIM55表达变化及与肿瘤临床病理参数的关系 TRIM55定位于细胞核与细胞膜,呈棕褐色颗粒,主要表达于细胞核(图1)。91例胃癌组织中TRIM55高表达40例,癌旁组织中TRIM55低表达,胃癌组织中TRIM55高表达率高于癌旁组织(P<0.05)。不同年龄、性别、肿瘤位置和Lauren分型患者TRIM55表达差异均无统计学意义(P均>0.05)。Ⅰ+Ⅱ期者TRIM55高表达率低于Ⅲ期者,无淋巴结转移者TRIM55高表达率低于有淋巴结转移者,T1+T2期者TRIM55高表达率低于T3+T4期者(P均<0.05)。详见表1。

注:A为癌旁正常胃黏膜组织;B为高分化胃癌组织;C为低分化胃癌组织;D为胃印戒细胞癌组织。
2.2 TRIM55表达与胃癌预后的关系 TRIM55高表达患者5年生存率低于低表达者(P=0.026,图2)。TRIM55高表达、低表达患者中位总生存期(OS)分别为34个月(95%CI:13.3~62.8)、57个月(95%CI:25.5~84.5),TRIM55高表达者中位OS短于低表达者(P<0.05)。单因素COX回归分析结果显示,肿瘤T分期、淋巴结转移、肿瘤TNM分期和TRIM55表达水平是胃癌患者预后的影响因素;进一步行多因素COX回归分析结果显示,淋巴结转移、TNM分期、TRIM55表达水平是胃癌预后的独立影响因素(见表2)。
2.3 TRIM55低表达后胃癌细胞增殖、迁移、侵袭能力变化 si-TRIM55组培养24、48、72、96 h细胞增殖能力均低于si-NC组(P均<0.05),见表3。迁移实验结果显示,si-TRIM55组、si-NC组穿膜细胞数分别为(117.6±6.4)、(223.4±16.3)个,侵袭实验结果显示,si-TRIM55组、si-NC组穿膜细胞数分别为(76.8±5.2)、(158.5±7.6)个,两组穿膜细胞数相比,P均<0.05。见图3。

表1 不同临床病理参数胃癌患者TRIM55高表达情况比较
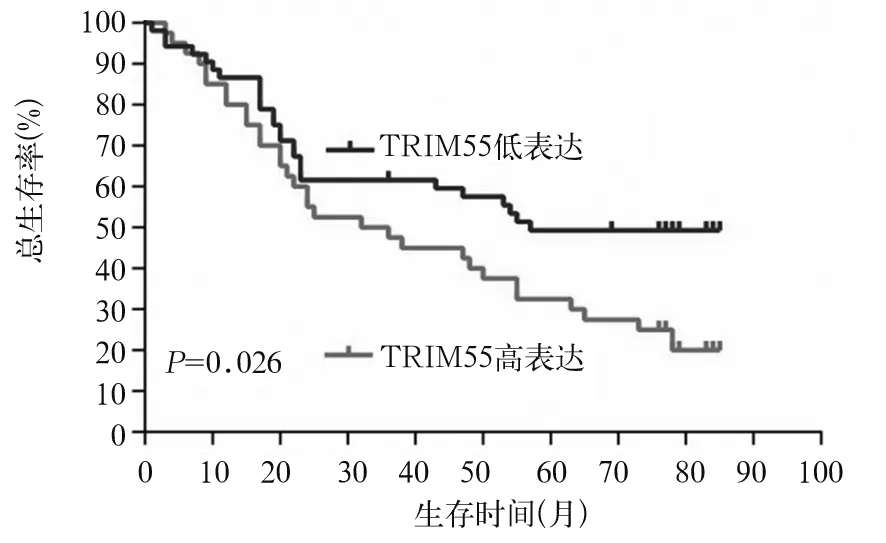
图2 TRIM55表达与胃癌患者生存率的关系
3 讨论
TRIM55属于TRIM蛋白家族,其在肿瘤的发生发展过程中起着重要作用。TRIM蛋白拥有3个特征性结构域,作为E3连接酶发挥作用,可以介导蛋白的泛素化,通过降解靶分子,进而参与调节细胞内的病理生理过程和肿瘤相关进程[9~11]。TRIM蛋白主要通过调节p53及NF-κB信号通路等多种机制,影响肿瘤相关因子表达而发挥促癌或抑癌的作用[12~14]。TRIM59在乳腺癌中过表达并与较高的TNM分期和淋巴结转移相关,其过表达可以促进乳腺癌细胞的增殖、侵袭、转移,增强肿瘤细胞对顺铂的耐药性;TRIM59过表达还可以促进乳腺癌细胞p53的泛素化过程,导致p53降解,促进肿瘤进展[15]。TRIM24蛋白在胃癌中高表达,并且与胃癌的临床分期、局部侵犯和较差的预后有关;TRIM24过表达也可导致胃癌细胞对5-FU耐药并促进胃癌细胞生长[16]。还有研究表明,TRIM32的表达与胃癌较差的预后相关,其作为促增殖、抗凋亡因子参与胃癌的AKT信号通路调节,还可以通过靶向胃癌细胞中的GLUT1和HKⅡ加强糖酵解[17]。研究表明,TRIM55在结直肠癌中定位于细胞核且高表达,TRIM55阳性表达患者5年生存率明显低于阴性患者[18]。TRIM55作为E3泛素连接酶可以通过影响细胞因子信号转导抑制因子1的表达进而促进结直肠癌细胞增殖[19]。一项纳入芬兰心力衰竭人群的研究显示,TRIM55表达缺失或TRIM55 E140K变异体过表达与心脏收缩能力减弱密切相关[20]。还有研究报道,TRIM55在系膜增生性肾小球肾炎的发展过程中起到调节TNF-α-CCL2通路、促发炎症反应的作用[21]。

表2 胃癌患者预后影响因素COX分析结果
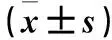
表3 si-TRIM55组、si-NC组培养不同时间细胞增殖能力比较

注:A为迁移实验;B为侵袭实验。
本研究首次探讨了TRIM55在胃癌中的表达及生物学功能,通过组织芯片免疫组化法检测了TRIM55在91例胃癌组织和癌旁组织中的表达,结果表明TRIM55在胃癌组织中高表达,生存分析显示TRIM55高表达者5年生存率和OS降低,COX回归分析也证实TRIM55是胃癌预后的独立影响因素。分析TRIM55表达与胃癌临床病理参数的关系,结果显示,TRIM55表达与胃癌T分期、淋巴结转移和TNM分期有关。以上结果提示,TRIM55可能参与了胃癌的发生发展过程。
为了研究TRIM55在胃癌细胞中的功能,我们构建了靶向TRIM55的siRNA,转染至胃癌MGC803细胞中,降低TRIM55的内源性表达。通过CCK-8增殖实验证实,敲低TRIM55基因并使其低表达可以明显抑制胃癌细胞的增殖。Transwell实验表明,胃癌细胞转染TRIM55 siRNA后,能够穿过基底膜的细胞数目明显减少。这些结果提示,TRIM55在胃癌中可能发挥癌基因的功能,降低其表达可以抑制胃癌细胞的恶性增殖过程,抑制胃癌细胞的侵袭和转移。
综上,本研究探讨了TRIM55作为肿瘤促进因子的生物学效应,TRIM55在胃癌组织中高表达,有望作为胃癌预后不良的独立标志物。但是TRIM55促进胃癌细胞侵袭、转移的分子生物学机制未知,下一步应继续探讨其具体作用的信号通路,以期为胃癌的临床治疗提供新的治疗策略和分子靶点。

