VHA-c2&c4双基因沉默株系拟南芥对NaCl与ABA的响应
苏杰 郭荣起 高阳 于秀敏 李国婧 王瑞刚
(1. 内蒙古农业大学职业技术学院,包头 014109;2. 内蒙古农业大学 内蒙古自治区植物逆境生理与分子生物学重点实验室,呼和浩特010018;3. 呼伦贝尔市农业科学研究所,呼伦贝尔 162650;4. 中国农业科学院草原研究所,呼和浩特 010010)
液泡H+-ATPase(Vacuolar-type H+-ATPase,VATPase)是存在于真核生物(包括酵母、植物和动物)中的保守质子泵[1]。它在亚细胞的酸化、pH和离子稳态、内吞和分泌转运等过程中起重要作用[2]。V-ATPase由13个亚基组成,这种寡聚酶包含V1和V0结构域。V1域位于膜内的细胞质中,由A-H亚基构成,对ATP的水解起催化作用。V0域镶嵌于膜上,由a、c、c''、d、e亚基构成,是物质进出膜内通道的“开关”[3]。V-ATPase的c亚基(VHA-c)是V-ATPase组装的关键,直接负责质子的结合和跨膜运输。在植物的V-ATPase中,只有c亚基由多基因编码。例如,模式植物拟南芥(Arabidopsis thaliana)c亚基有5个同源基因,即VHA-c1、VHA-c2、VHA-c3、VHA-c4和VHA-c5,GenBank登 录 号 依 次 为At4g34720、At1g19910、At4g38920、At1g75630 和 At2g16510[4]。
关于拟南芥VHA-c基因已有大量研究。研究报道显示,拟南芥VHA-c基因表达受外源激素和盐胁迫等的调节。如Perera等[4]、徐萍等[5]研究表明ABA和盐胁迫参与了拟南芥VHA-c亚基同源基因的表达调节。王瑞刚[6]证实拟南芥VHA-c基因的调控序列指导的GUS在转基因烟草的表达受NaCl和植物激素等的调控。苏杰等[7-8]前期研究发现,VHA-c1和VHA-c3可能参与ABA和糖介导的信号转导途径。Padmanaban等[9]通过RNA干扰技术(RNAi)研究发现vha-c1和vha-c3突变体对盐胁迫敏感,同时VHA-c1和VHA-c3沉默降低了V-ATPase活性并抑制根的生长,表明VHA-c基因对细胞扩增起重要作用。郭荣起[10]、韩晓东等[11]利用RNAi技术发现VHA-c1可能通过影响H+-ATPase在盐胁迫信号通路和ABA信号通路中起着不同的调控功能。
前人研究证实了拟南芥VHA-c亚基在植物响应胁迫过程中可能具有重要的作用。但VHA-c亚基的特定功能以及在植物的生长发育过程中各亚基之间如何相互协调发挥作用目前尚不明确。
本研究通过构建VHA-c2与VHA-c4双沉默载体,获得转基因纯合体,并对其进行盐胁迫和ABA处理,进行了非损伤微测技术(Non-invasive micro-test technique,NMT)试验,旨为探明VHA-c基因在植物生长发育及非生物胁迫应答方面的机制提供理论依据。
1 材料与方法
1.1 材料
野生型Columbia拟南芥种子由内蒙古自治区植物逆境生理与分子生物学重点实验室保存,将植株于22℃,相对湿度60%,16 h光照/8 h黑暗条件下培养。菌株(根癌农杆菌GV3101、大肠杆菌DH5α)和质粒载体(pHANNIBAL、pART27)均由内蒙古自治区植物逆境生理与分子生物学重点实验室保藏。
1.2 方法
1.2.1VHA-c2&c4沉默载体的构建与农杆菌转化 采用CTAB法[12]提取整株拟南芥基因组DNA。并以此为模板,以c2&c4-s-5/c2&c4-as-5和c2&c4-s-3/c2&c4-as-3为引物(表1)进行扩增。将PCR产物纯化回收,利用限制性内切酶XhoⅠ和EcoRⅠ双酶切正义链片段和pHANNIBAL载体(图1-A),连接后命名为pHAN-c2&c4-s,并进行测序鉴定。再利用限制性内切酶XbaⅠ和BamHⅠ双酶切反义链片段和载体pHAN-c2&c4-s,连接后命名为pHAN-c2&c4-s-as,并进行测序鉴定。最后,用NotⅠ分别酶切pHAN-c2&c4-s-as质粒和pART27载体(图1-B),将获得的2个目的片段c2&c4-s和c2&c4-as与载体pART27连接并转化大肠杆菌DH5α,获得目标重组表达载体pART-c2&c4。
采用电击法[13]将重组质粒pART-c2&c4转化农杆菌GV3101,在LB固体培养基(25 μg/mL庆大霉素和100 μg/mL壮观霉素)上筛选阳性克隆,进行菌落PCR鉴定,鉴定为阳性的重组菌GV3101/pART-c2&c4用于植物转化。
1.2.2VHA-c2&c4沉默植株的筛选及纯合体株系的获得 将重组菌GV3101/ pART-c2&c4于LB固体培养基上划线,28℃培养 48 h。挑取单克隆于LB液体培养基(抗生素含量同上),28℃震荡培养过夜。次日,按照1∶100(体积比),将培养过夜的菌液重新接种于LB液体培养基(同上),28℃震荡培养至A600nm1.2-1.6。离心后收集菌体,并用新鲜LB液体培养基重新悬浮菌体,使其A600nm约为 0.8,即制成重组菌GV3101/pART-c2&c4悬液。
图1 RNAi表达载体
采用浸花法[14]将重组菌GV3101/pART-c2&c4转化拟南芥。转化后的拟南芥植株继续在正常环境中培养约1个月,收取种子。在1/2 MS选择培养基(含卡那霉素30 μg/mL)中,22℃培养种子10-12 d后,将阳性植株移至蛭石上培养,成熟后按单株收取种子(T1代);T1代种子继续按单株播种于含卡那霉素的培养基上,培养10-12 d后挑选发生1/3性状分离的株系并移至蛭石上培养,成熟后按单株收取种子(T2代);在含卡那霉素的培养基上培养筛选T2代种子,纯合体株系将不再发生性状分离,用于后续分析。
1.2.3VHA-c2&c4沉默植株中VHA-c2和VHA-c4沉默效果鉴定 (1)分别提取野生型拟南芥和VHA-c2&c4沉默植株总RNA,反转录获得cDNA,再以cDNA为模板,分别对内参基因actin(GenBank登录号:At3g12110,引物为actin-RT-F和actin-RT-R)和VHA-c2&c4(引物为c2-RT-PCR-F/R和c4-RT-PCR-F/R)进行PCR扩增(表1)。凝胶成像分析(Syngene公司凝胶成像仪)以上PCR产物。(2)对双基因沉默较强的植株的沉默片段特异性进行测定:根据(1)的结果,挑取双基因沉默较强的植株,以其反转录获得的cDNA为模板,分别对VHA-c1-VHA-c5进行扩增,将其产物进行凝胶成像分析以检测该株系的VHA-c1-VHA-c5的表达情况,进而检测沉默片段的特异性。

表1 特异性引物与引入的酶切位点
1.2.4 NaCl处 理VHA-c2&c4沉 默 株 系 (1) 将VHA-c2&c4沉默株系和拟南芥野生型种子同时播种于1/2MS培养基,4℃春化3 d,于22℃、16 h光照/8 h黑暗条件培养5 d。然后同时移至含不同浓度NaCl(0、25、50、75、100、125 和 150 mmol/L)的1/8MS培养基上,16 h光照/8 h黑暗条件竖直培养4 d,统计主根的长度。(2)将VHA-c2&c4沉默株系和拟南芥野生型种子同时播种于含125 mmol/L NaCl的1/2MS培养基。4℃春化3 d后置于22℃,16 h光照/8 h黑暗条件下培养并开始计时,于24、48、72和96 h统计萌发率。
1.2.5 ABA处理VHA-c2&c4沉默株系 将VHA-c2&c4沉默株系和拟南芥野生型种子同时播种于1/2MS培养基,4℃春化3 d,22℃,16 h光照/8 h黑暗条件培养 5 d。然后分别移至含不同浓度ABA(0、4、8和12 μmol/L)的1/8MS培养基,16 h光照/8 h黑暗条件竖直培养4 d,统计主根的长度。
1.2.6 NMT检测VHA-c2&c4沉默株系H+的内流 拟南芥VHA-c2&c4沉默株系和对照种子同时种于1/2MS培养基,4℃春化3 d,22℃、16 h光照/8 h黑暗条件下培养 6 d。取其分生区200-300 μm的区域,在测试液中平衡15 min,检测5 min,待吸收稳定后加入 ABA(终浓度 100 μmol/L)[15],再检测20 min。
2 结果
2.1 VHA-c2&c4沉默株系的筛选与鉴定
将构建好的基因沉默质粒pART-c2&c4经农杆菌介导转化野生型拟南芥,利用卡那霉素筛选,最终获得了7个T2代转基因纯合株系,分别命名为c2&c4-1、c2&c4-2、c2&c4-3、c2&c4-4、c2&c4-5、c2&c4-6和c2&c4-7。利用半定量PCR技术,在actin转录水平相同的情况下,比较7个基因沉默株系与野生型对照的VHA-c2和VHA-c4表达量。结果显示,设定对照表达量为100%,7个沉默株系的VHA-c2表达量分别为4%、3%、10%、89%、78%、20%和18%,VHA-c4表达量分别为8%、2%、40%、29%、28%、46% 和 11%( 图 2)。 由 于 c2&c4-1、c2&c4-2和c2&c4-7这3个株系的双基因沉默效率较高,因此将其用于后续分析。
由于VHA-c1-VHA-c5序列的同源性很高,通过对双基因沉默较强的植株c2&c4-2的沉默片段特异性进行测定。结果显示,设计的c2&c4-RNAi沉默片段特异性很好,只使VHA-c2和VHA-c4沉默,而VHA-c1、VHA-c3和VHA-c5的表达不受影响(图3)。

图2 沉默株系中VHA-c2&c4的表达水平

图3 基因沉默株系c2&c4-2的VHA-c2&c4沉默特异性检测
2.2 NaCl处理下VHA-c2&c4沉默株系的变化
2.2.1VHA-c2&c4沉默株系主根伸长变化 为进一步探明VHA-c参与响应盐胁迫的机理,将3个VHA-c2&c4强沉默株系在不同浓度NaCl培养基中培养,测量主根长度,并计算主根相对伸长量。结果显示,当NaCl浓度≥100 mmol/L时,3个沉默株系的主根生长受到抑制,且主根相对伸长量比野生型对照减少。在100 mmol/LNaCl浓度下,3个株系主根的相对伸长量平均比对照分别减少11%、13%和16%;在125 mmol/L NaCl浓度下,分别减少6%、8%和4%(图4);但当NaCl浓度达150 mmol/L时,转基因纯合体和野生型植株根的生长几乎都被抑制(结果中未显示)。这说明基因沉默株系抵抗盐胁迫的能力较对照弱。
2.2.2VHA-c2&c4沉默株系种子萌发的变化 通过探究125 mmol/L NaCl对基因沉默株的种子萌发率的影响。结果显示,125 mmol/L NaCl处理下,3个VHA-c2&c4沉默株系的种子萌发率比对照减少。24 h后,对照和基因沉默株系的种子开始萌发,但萌发均受抑制;在48 h时,3个株系的种子萌发率平均分别比野生型减少12%、15%和13%;72 h 时,平均分别比野生型减少15%、17%和12%;96 h时,平均分别比野生型减少14%、10%和12%(图5)。说明VHA-c2&c4的沉默使种子对盐胁迫的敏感度增大。
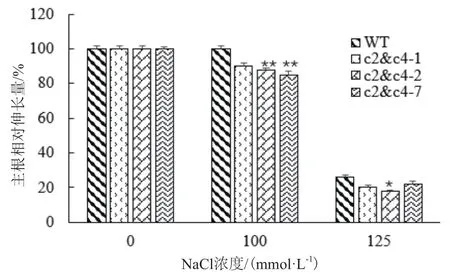
图4 NaCl处理VHA-c2&c4沉默株系主根相对伸长量的变化
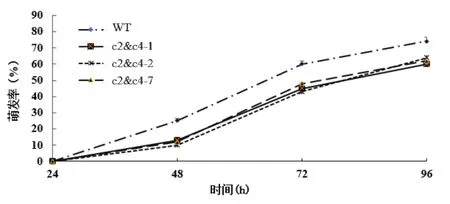
图5 NaCl处理VHA-c2&c4沉默株系种子萌发率的变化
2.3 ABA处理VHA-c2&c4沉默株系主根伸长的变化
用ABA处理后,发现VHA-c2&c4沉默株系以及对照拟南芥的主根相对伸长量和子叶展开程度都受到不同程度的抑制,其中3个株系的表型较为明显。ABA浓度越大,它们的主根生长被抑制的程度和子叶的黄化程度越大,且VHA-c2&c4沉默株系子叶的展开程度和主根长度比对照高(图6-A,以c2&c4-7为例)。在4 μmol/L ABA浓度下,3个株系主根的相对伸长量比对照分别增长11%、17%和17%;在8 μmol/L ABA浓度下,分别增长2%、20%和21%;在12 μmol/L ABA浓度下,分别增长3%、23%和7%(图6-B),表现出基因剂量依赖的效应。
2.4 VHA-c2&c4沉默株系H+运输能力的NMT测定
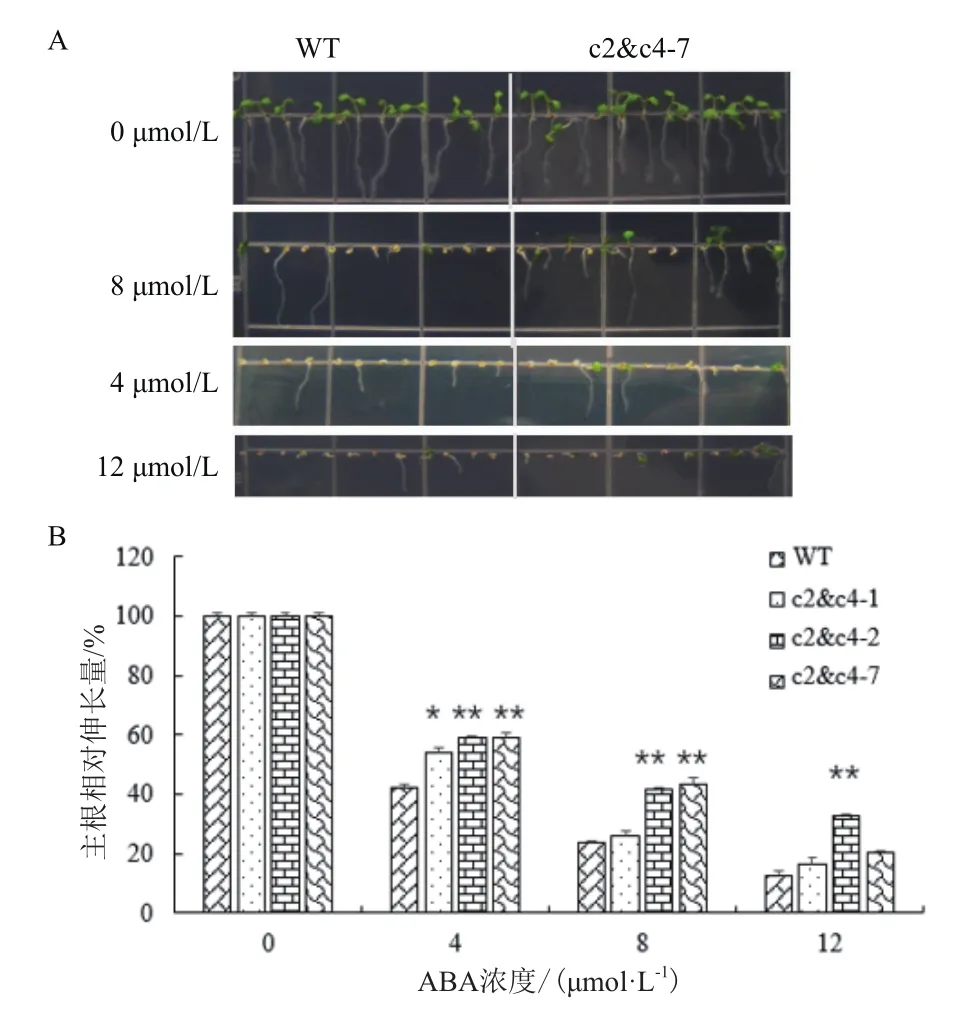
图6 ABA处理VHA-c2&c4沉默株系主根相对伸长量的变化
NMT试验可以在相对真实的生理环境状态下,测得进出样品细胞膜的离子浓度、流速和运动方向等参数。为进一步研究拟南芥基因沉默株系VHA-c2&c4的V-ATPase对H+的运输能力,利用NMT技术对6日龄的基因沉默株系和对照的主根分生区进行测定。在100 μmol/L ABA处理300 s后,基因沉默株系的H+内流现象非常显著,而对照几乎没有H+内流现象(图7)。
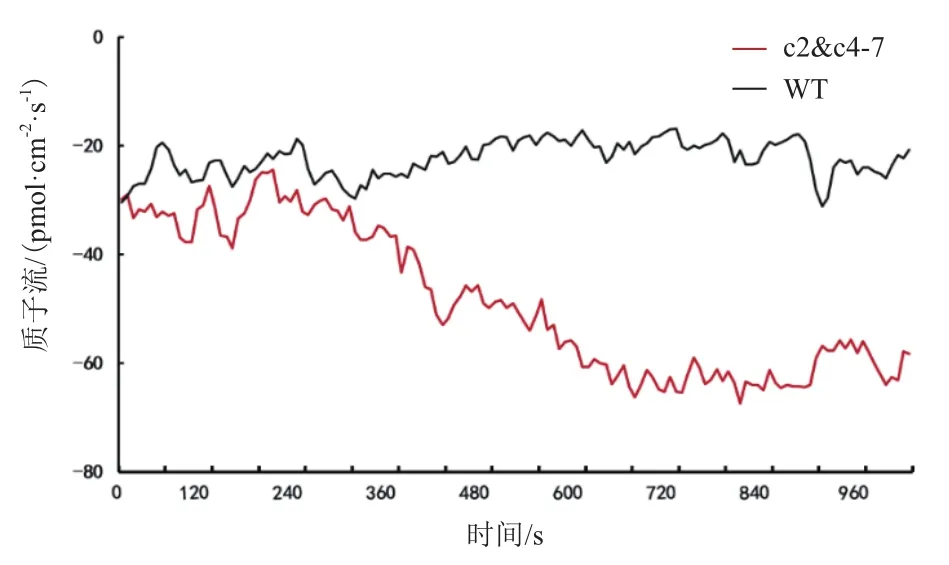
图7 NMT 技术测定拟南芥根部H+运输能力
3 讨论
Zhou等[16]通过c亚基表达量的变化影响植物根长、鲜重、高度等试验证实V-ATPase c亚基影响细胞扩展。究其机理,可能是液泡中ATP释放的能量可被V-ATPase利用,将H+泵到液泡腔使液泡酸化,从而使液泡中溶质积聚而产生膨胀压力,进一步促进细胞的扩展[9]。本研究通过dsRNA干扰技术,构建了VHA-c2和VHA-c4共沉默载体,得到7个双基因沉默株系。
V-ATPase在耐盐胁迫方面起重要作用,它为H+偶联的Na+逆向运输蛋白提供驱动力,例如Nhx1,它将钠隔离在液泡中,从而有助于适应盐胁迫。例如,在一些植物中,盐胁迫增强了泵的转录水平或活性[17]。冰叶日中花A、B、E亚基的转录水平因盐胁迫而升高[18-19],同时盐胁迫增强了c亚基的转录水平,盐处理过的幼苗VHA-c1和VHA-c2转录水平增加[9]。本研究发现NaCl处理下,基因沉默株系的主根相对伸长量和种子萌发率均小于对照,表明dsRNA介导的VHA-c2&c4沉默株系对盐更敏感而且这两个基因表达水平的共同减弱不能被其他VHA-c所取代。
ABA是一种参与高等植物生长发育、抗逆等诸多生理过程的植物激素。研究显示,ABA可以诱导V-ATPase c亚基[5-8,11]。本研究用 ABA 处理VHA-c2&c4沉默株系后发现:VHA-c2&c4沉默株系以及对照拟南芥的主根相对伸长量和子叶展开程度都受到不同程度的抑制;ABA浓度越大,它们的主根生长被抑制的程度和子叶的黄化程度越大,且c2&c4沉默株系子叶的展开程度和主根长度比对照高。VHA-c2&c4的沉默,使其对ABA的抑制不敏感,VHA-c2和VHA-c4可能参与了ABA介导的信号转导途径,而其机制还有待于进一步研究论证。
NMT试验测定ABA处理下主根分生区的H+运输能力,发现VHA-c2&c4沉默株系的H+内流现象非常明显,而野生型植株的H+运输能力无明显变化。表明VHA-c2&c4的转录水平降低,使得由其他VHA-c同源基因表达的c亚基装配而成的V-ATPase活性增加,而野生型植株V-ATPase的活性却未改变。
4 结论
获得VHA-c2&c4沉默株系,VHA-c2&c4沉默株系对NaCl胁迫作用敏感,对ABA抑制作用不敏感。ABA促进双沉默基因纯合体株系的H+内流能力。

