大麻素受体2激动剂AM1241对TGF-β1诱导的HSC-T6增殖、活化及凋亡的影响
龙翠珍,舒远辉,何萍,2,王豫萍,2△
肝纤维化是弥漫性肝损伤后组织修复过程中的代偿反应,是各种慢性肝病向肝硬化发展的中间环节[1]。肝纤维化的实质是以胶原为主的细胞外基质(extracellular matrix,ECM)的合成增多而降解不足,并在肝脏过度沉积,此过程中肝星状细胞(hepatic stellate cells,HSCs)的活化是中心环节[2]。HSCs 存在于窦间隙Disse 腔内,正常情况下HSCs 表现为富含维生素A脂滴的静止型[3]。在慢性肝损伤的刺激下,HSCs 表型由静止型转变为激活型,其特征为表达α-平滑肌肌动蛋白(α-SMA),分泌与合成ECM,自分泌或旁分泌转化生长因子(TGF)-β1、碱性成纤维细胞生长因子(bFGF)等各种细胞因子,这些细胞因子能够促进HSCs的活化而加重肝纤维化[4-5]。因此,抑制HSCs 增殖与活化,促进其凋亡已成为当前抗肝纤维化治疗的主要策略[6]。
近年研究发现内源性大麻素系统(endocannabinoid system,ECS)在肝纤维化及肝硬化的发生发展中起重要作用,是抗肝纤维化的潜在治疗靶点[7]。大麻素受体(cannabinoid receptor ,CB)2是ECS 的重要组成部分之一,具有抗炎、抗氧化应激、抗纤维化等作用[8-9]。本课题组前期研究发现,CB2 受体激动剂AM1241 能减轻四氯化碳(CCl4)诱导的小鼠肝纤维化,降低肝组织血小板衍生因子(platelet derived growth factor,PDGF)蛋白的表达水平,提示激活CB2 可改善肝纤维化[10]。但是有关CB2 受体激动剂AM1241 对体外培养的HSCs 增殖、活化与凋亡的影响鲜有报道。本课题组前期体外实验采用葡萄糖氧化酶刺激大鼠肝星状细胞(HSCT6)建立氧化应激模型,发现AM1241能发挥抗氧化作用抑制HSC-T6 的增殖与活化[11]。本研究采用TGF-β1 诱导HSC-T6 活化,进一步探讨AM1241 对HSC-T6增殖、活化及凋亡的影响及作用机制。
1 材料与方法
1.1 材料 大鼠肝星状细胞株HSC-T6购自昆明细胞库;胎牛血清(FBS)购自以色列Biological Industries 公司;高糖DMEM 培养基购自美国GIBCO 公司;重组人TGF-β1 购自美国Peprotech 公司;AM1241 购自美国Selleck 公司;CCK-8 试剂盒购自日本同仁化学研究所;Annexin V FITC 细胞凋亡检测试剂盒购自美国BD 公司;全蛋白提取试剂盒及BCA 蛋白浓度测定试剂盒均购自北京索莱宝科技有限公司;兔抗鼠GAPDH抗体、兔抗鼠α-SMA抗体、兔抗鼠c-Jun氨基末端激酶(JNK)1+JNK2+JNK3 抗体、兔抗鼠JNK1+JNK2+JNK3(磷酸化T183+T183+T221,p-JNK)抗体均购自美国Abcam公司;兔抗鼠bFGF 抗体购自爱必信公司;兔抗鼠Bax 多克隆抗体购自沈阳万类公司;兔抗鼠cleaved caspase-3 单克隆抗体购自美国CST 公司;山羊抗兔IgG(H+L)HRP 购自杭州联科生物技术有限公司;ECL 化学发光液购自美国Millipore 公司;ELX800酶标仪、BIO-RAD全套电泳装置购自美国BIO-RAD公司;Chemi Scope Mini 3300 化学发光成像仪购自上海勤翔科学仪器有限公司;NaviosTM分析型流式细胞仪购自美国贝克曼公司。
1.2 方法
1.2.1 细胞培养 HSC-T6 采用含90% 高糖DMEM+10%FBS+1%青链霉素混合液+1%L-谷氨酰胺的培养基,置于37 ℃、5%CO2细胞培养箱中进行培养,待细胞生长至融合度为70%~80%时,用0.25%胰蛋白酶消化并传代。
1.2.2 CCK-8 法测定AM1241 对HSC-T6 增殖能力的影响 取对数生长期HSC-T6 以4×103个/孔接种于96 孔板内,实验设空白对照组(空白培养基)、阴性对照组(未加药品)、TGF-β1组(5 μg/L TGF-β1)及20、40、80、160 μmol/L AM1241组(5 μg/L TGF-β1+20、40、80、160 μmol/L AM1241);每组设5个复孔,培养24 h。吸掉旧培养基,用含1%FBS 的高糖DMEM 培 养 液 洗1 次,加 入100 μL/孔 含1%FBS 的 高 糖DMEM培养液,再加入10 μL/孔CCK-8试剂,37 ℃、5%CO2孵育1.5 h,采用ELX800 酶标仪于450 nm 波长处检测吸光度(A)值。计算AM1241 系列浓度梯度对HSC-T6 的生长抑 制 率,细 胞 生 长 抑 制 率=[1-(A药物-A空白)/(A0-A空白)]×100%,并采用GraphPad Prism 5.0 软件计算半数抑制浓度(IC50)。
1.2.3 流式细胞术检测AM1241对HSC-T6凋亡的影响 取对数生长期HSC-T6分为阴性对照组(未加药品)、TGF-β1组(5 μg/L TGF-β1)及30、60 μmol/L AM1241 组(5 μg/L TGFβ1+30、60 μmol/L AM1241),培养48 h。用不含EDTA 的0.25%胰蛋白酶消化1~2 min,1 000 r/min离心5 min,PBS洗2次,计数,取2×106个/mL 的细胞悬液100 μL 于流式管内,分别加入5 μL 的Annexin V FITC 和PI,避光孵育15 min,后加入400 μL的缓冲液,于NaviosTM分析型流式细胞仪检测细胞凋亡情况。
1.2.4 Western blot 检测α-SMA、bFGF、Bax、cleaved caspase-3、p-JNK蛋白的表达 将对数生长期HSC-T6分成阴性对照组(未加药品)、TGF-β1 组(5 μg/L TGF-β1)和27 μmol/L AM1241 组(5 μg/L TGF-β1+27 μmol/L AM1241)。采用全蛋白提取试剂盒提取细胞蛋白,BCA法测定总蛋白浓度。蛋白样品加入5×蛋白上样缓冲液,100 ℃煮沸10 min,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜至PVDF 膜、5%脱脂奶粉封闭1.5 h,膜条4 ℃孵育一抗GAPDH 抗体(1∶10 000)、α-SMA抗体(1∶5 000)、bFGF抗体(1∶300)、Bax抗体(1∶500)、cleaved caspase-3 抗体(1∶1 000)、p-JNK 抗体(1∶1 500)、JNK抗体(1∶1 000)过夜,次日洗膜,室温孵育山羊抗兔IgG(H+L)HRP 1.5 h,洗膜,加入ECL化学发光液显影并曝光。采用Image J 软件分析条带灰度值,计算各目的蛋白与内参蛋白GAPDH灰度值的比值。
1.3 统计学方法 采用SPSS 19.0 软件进行统计学分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
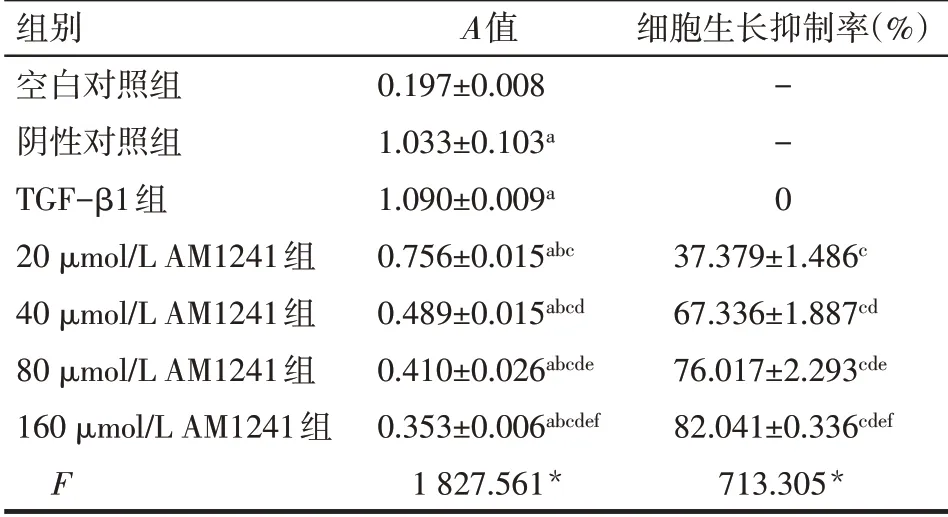
2.1 不同浓度AM1241 对TGF-β1 诱导后HSC-T6增殖能力的影响 TGF-β1 组细胞增殖能力与阴性对照组差异无统计学意义;与TGF-β1 组比较,AM1241 可抑制HSC-T6 增殖能力,且随着AM1241浓度的升高,细胞增殖能力逐渐降低,细胞生长抑制率逐渐升高,组间多重比较差异均有统计学意义,见表1。AM1241的IC50为27 μmol/L。
Tab.1 Effects of different concentrations of AM1241 on the proliferation of HSC-T6 cells表1 实验各组对HSC-T6增殖能力的影响(n=3)
Tab.1 Effects of different concentrations of AM1241 on the proliferation of HSC-T6 cells表1 实验各组对HSC-T6增殖能力的影响(n=3)
*P<0.05;a与空白对照组比较,b与阴性对照组比较,c与TGF-β1组比较,d与20 μmol/L AM1241组比较,e与40 μmol/L AM1241组比较,f与80 μmol/L AM1241组比较,P<0.05
组别空白对照组阴性对照组TGF-β1组20 μmol/L AM1241组40 μmol/L AM1241组80 μmol/L AM1241组160 μmol/L AM1241组F A值0.197±0.008 1.033±0.103a 1.090±0.009a 0.756±0.015abc 0.489±0.015abcd 0.410±0.026abcde 0.353±0.006abcdef 1 827.561*细胞生长抑制率(%)--0 37.379±1.486c 67.336±1.887cd 76.017±2.293cde 82.041±0.336cdef 713.305*
2.2 流式细胞术检测AM1241 对TGF-β1 诱导后HSC-T6 凋亡的影响 阴性对照组、TGF-β1 组及30、60 μmol/L AM1241 组HSC-T6 凋 亡率 分 别 为(7.983±2.129)%、(8.527±2.089)%、(30.973±1.732)%、(59.200±9.224)%,组间比较差异有统计学意义(n=3,F=72.387,P<0.05)。TGF-β1组细胞凋亡率与阴性对照组比较差异无统计学意义;与TGF-β1 组比较,30、60 μmol/L AM1241 组HSC-T6 凋亡率均明显上 升,且60 μmol/L AM1241 组 高 于30 μmol/L AM1241组(P<0.05),见图1。
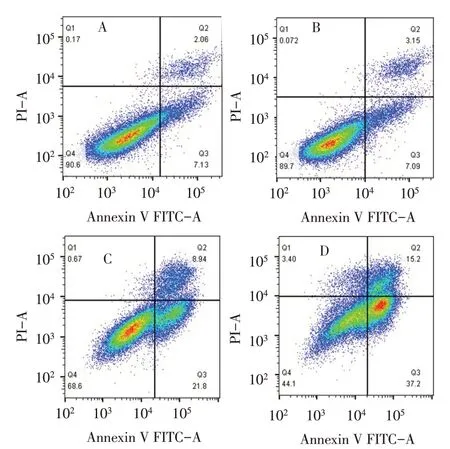
Fig.1 Detection of apoptosis by flow cytometry in HSC-T6 cells of each group图1 流式检测各组HSC-T6的凋亡情况
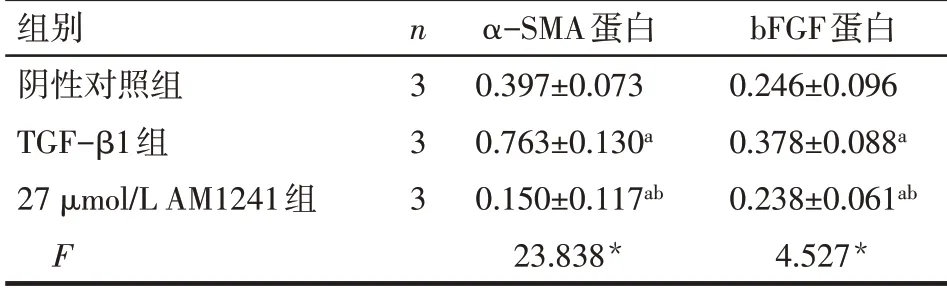
2.3 AM1241 对HSC-T6 活化的影响 TGF-β1 组α-SMA 和bFGF 蛋白表达水平较阴性对照组升高(P<0.05);27 μmol/L AM1241 组α-SMA 和bFGF 蛋白表达水平较TGF-β1 组明显降低(P<0.05),见图2、表2。
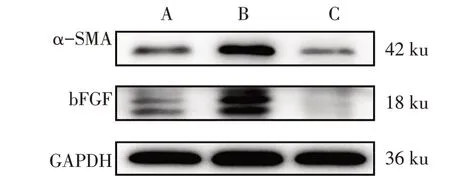
cells of each group图2 各组HSC-T6 α-SMA和bFGF蛋白表达情况
Tab.2 Comparison of relative expression levels of α-SMA and bFGF proteins in HSC-T6 cells of each group表2 各组HSC-T6 α-SMA和bFGF蛋白表达水平的比较(n=3)
Tab.2 Comparison of relative expression levels of α-SMA and bFGF proteins in HSC-T6 cells of each group表2 各组HSC-T6 α-SMA和bFGF蛋白表达水平的比较(n=3)
*P<0.05;a与阴性对照组比较,b与TGF-β1组比较,P<0.05
组别阴性对照组TGF-β1组27 μmol/L AM1241组F n3 3 3 α-SMA蛋白0.397±0.073 0.763±0.130a 0.150±0.117ab 23.838*bFGF蛋白0.246±0.096 0.378±0.088a 0.238±0.061ab 4.527*
2.4 AM1241 对TGF- β1 诱 导 的HSC-T6 Bax、cleaved caspase-3、p-JNK蛋白表达的影响 TGF-β1组Bax、cleaved caspase-3 和p-JNK 蛋白表达水平与阴性对照组差异均无统计学意义(P>0.05);27 μmol/L AM1241 组Bax、cleaved caspase-3、p-JNK 蛋白表达水平较TGF-β1 组升高(P<0.05),见图3、表3。
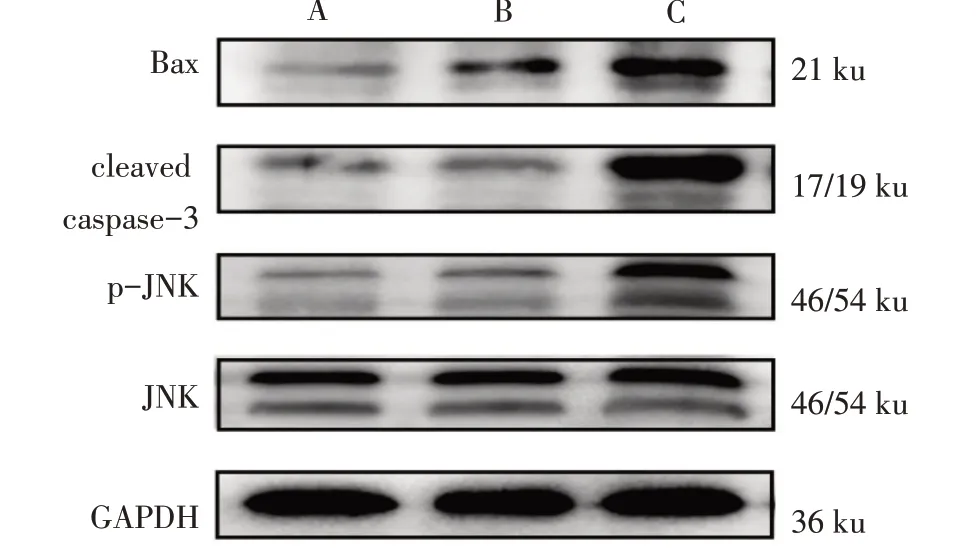
Fig.3 Expressions of Bax,cleaved caspase-3 and p-JNK proteins in HSC-T6 cells图3 各组HSC-T6 Bax、cleaved caspase-3、p-JNK蛋白表达情况
Tab.3 Relative expression levels of Bax,cleaved caspase-3 and p-JNK proteins in HSC-T6 cells表3 各组HSC-T6Bax、cleaved caspase-3和p-JNK蛋白表达水平的比较 (n=3)
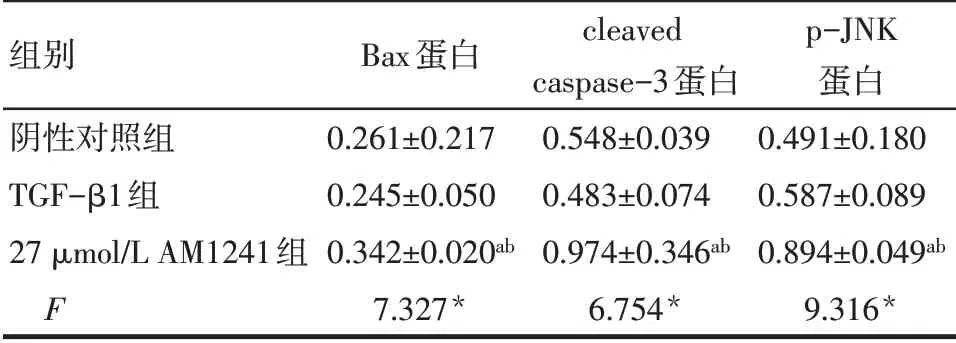
Tab.3 Relative expression levels of Bax,cleaved caspase-3 and p-JNK proteins in HSC-T6 cells表3 各组HSC-T6Bax、cleaved caspase-3和p-JNK蛋白表达水平的比较 (n=3)
*P<0.05;a与阴性对照组比较,b与TGF-β1组比较,P<0.05
组别阴性对照组TGF-β1组27 μmol/L AM1241组F Bax蛋白0.261±0.217 0.245±0.050 0.342±0.020ab 7.327*cleaved caspase-3蛋白0.548±0.039 0.483±0.074 0.974±0.346ab 6.754*p-JNK蛋白0.491±0.180 0.587±0.089 0.894±0.049ab 9.316*
3 讨论
肝纤维化是持续性肝损伤后肝内结缔组织异常增生的病理生理过程[12]。HSCs 是肝纤维化的主要效应细胞,其活化可促进肝纤维化的发生发展。若能抑制HSCs的活化与增殖,理论上可部分逆转或者减慢肝纤维化的进展[6,12]。TGF-β1 是目前已知最强的促纤维化细胞因子之一,是激活静态HSCs的主要因子[5]。郑素军等[13]研究显示,以10 μg/L TGF-β1分别刺激HSC-T6 24、36 h,可增强细胞增殖能力,并上调胶原和α-SMA 蛋白表达水平,提示TGF-β1 可促进HSC-T6 的增殖与活化。本研究结果显示,以5 μg/L TGF-β1 刺激HSC-T6 24 h 后,其α-SMA 与bFGF 蛋白表达水平较阴性对照组明显升高,提示TGF-β1可促进HSC-T6活化,满足本研究对实验模型的要求。但HSC-T6 增殖能力、细胞凋亡率和凋亡相关蛋白cleaved caspase-3、Bax 蛋白表达水平与阴性对照组无明显差异,提示TGF-β1对HSC-T6增殖、凋亡均无明显影响,与郑素军等[13]研究结果不同,可能与TGF-β1 浓度及HSC-T6 状态、生长环境与培养方式不同有关。
内源性大麻素系统由CB、内源性配体及与配体合成、降解相关的酶类共同构成[14]。CB包括CB1和CB2两种,属于G蛋白偶联受体,其中CB1主要分布在中枢神经系统,CB2 主要分布在外周免疫细胞中[10]。有研究发现,在CCl4或乙醇诱导的肝纤维化动物模型中,拮抗CB2可加重肝纤维化,激活CB2可有效抑制肝纤维化[15]。本研究结果显示,CB2 受体激动剂AM1241可抑制TGF-β1诱导的HSC-T6的增殖能力,且呈剂量依赖性,提示激活CB2可抑制体外培养的HSC-T6增殖,与张自力等[16]研究结果一致。α-SMA、bFGF表达水平可反映HSCs细胞活化程度。本研究结果显示,AM1241可明显下调TGF-β1诱导的HSC-T6 α-SMA、bFGF 蛋 白 表 达 水平,提示AM1241可有效抑制TGF-β1诱导的HSC-T6的活化及相关细胞因子的分泌,也证实激活CB2 可产生抗肝纤维化的作用。
目前AM1241 对活化的HSCs 凋亡的影响及其机制鲜有报道。有研究显示,在肝纤维化动物模型中,CB 可能参与HSCs 内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的调控[16-17]。JNK 是MAPK 的家族成员之一,参与调节炎症反应及细胞分化、增殖、凋亡等多种生物学过程[18]。JNK通路的促凋亡作用依赖于c-fos、c-Jun等细胞核转录因子的活化,活化的c-fos、c-Jun又可调控Bax、Bcl-2 等多种凋亡基因的表达,进而促进细胞凋亡的发生[19-20]。Bax 和Bcl-2 基因的表达产物均定位于线粒体膜,Bax 增加细胞色素C 的释放,Bcl-2抑制细胞色素C的释放,从线粒体释放的细胞色素C 能促进caspase-3 裂解并启动细胞凋亡[21]。caspase-3是凋亡过程的主要效应因子,其活化标志着凋亡进入不可逆阶段[22]。本研究结果显示,与TGF-β1 组比较,30、60 μmol/L AM1241 组HSC-T6凋亡率均明显上升,且60 μmol/L AM1241组高于30 μmol/L AM1241组;Western blot结果显示,27 μmol/L AM1241 组HSC-T6 Bax、cleaved caspase-3 蛋白表达水平较TGF-β1 组升高,提示AM1241 可促进HSCT6 凋亡。同时,27 μmol/L AM1241 组HSC-T6 p-JNK 蛋白表达水平较TGF-β1 组明显上调,提示AM1241 对HSC-T6 的促凋亡作用可能与JNK 通路相关。
综上所述,CB2 受体激动剂AM1241 可抑制TGF-β1 诱导的HSC-T6 增殖与活化,促进HSC-T6凋亡,且其作用机制可能与JNK通路有关。

