银耳源糖醛酸制备工艺及体外抗氧化活性研究
高云杉 陈洋炜 郑明锋 杨成龙
摘 要:以银耳多糖为原料,采用酸水解法制备葡萄糖醛酸。以葡萄糖醛酸得率为指标,运用单因素和正交试验设计对水解条件进行优化并制备银耳糖醛酸,检测其体外抗氧化活性。结果表明,酸水解制备银耳糖醛酸的最佳工艺条件如下:水解温度80℃,水解时间6h,盐酸浓度1mol/L,底物浓度0.8mg/mL,葡萄糖醛酸得率(32.03±1.70)%。与银耳多糖、葡萄糖醛酸的体外抗氧化活性对比,银耳糖醛酸的抗氧化活性要显著优于银耳多糖和葡萄糖醛酸。
关键词:葡萄糖醛酸;银耳多糖;制备;体外抗氧化
中图分类号 S567.3+4文献标识码 A文章编号 1007-7731(2020)09-0022-06
Study on Preparation of Tremella Glucuronic Acid and its Antioxidant Activity in Vitro
Gao Yunshan1 et al
(1School of Food Science, Fujian Agriculture and Forestry University, Fuzhou 350000, China)
Abstract: The glucuronic acid were obtained by acid hydrolysis from Tremella polysaccharide. The yield rate of glucuronic acid was used as the index to optimize the preparation condition for glucuronic acid by orthogonal design depended on the results of single factor experiments. Results showed that the yield rate of Tremella glucuronic acid was at 32.03%±1.70% under the optimal conditions: the hydrolysis at 80℃ for 6 hours, hydrochloric acid concentration of 1mol/L, substrate concentration of 0.8mg/mL. The antioxidant activity of tremella glucuronic acid was better than that of glucuronic acid and tremella polysaccharide.
Key words: Tremella Polysaccharide; Glucuronic Acid; Preparation; Antioxidant Activity in vitro.
葡萄糖醛酸(Glucuronic acid)簡称葡糖醛酸,广泛存在于动植物体内,它的分子式为C6H10O7,分子量为194.14[1]。葡萄糖醛酸分子中同时存在高反应活性的醛基和羧基,可与人体内源性及外源性有毒物质中的羟基、巯基、羧基、氨基等相互作用,从而达到排毒养颜、促进代谢的目的[2]。有研究表明,糖醛酸含量与其抗氧化活性呈正相关[3]。目前,葡萄糖醛酸的生产方法主要有生物发酵法、化学氧化法、多糖水解法等[4]。但生物发酵法所用的酶及菌株的筛选与制备过程繁琐、成本高且收率极低,目前,仅用于实验探索[5]。当前工业化生产葡萄糖醛酸主要是采用浓硝酸氧化淀粉的化学氧化法,但污染严重、能耗高、成本大[6]。多糖水解法多采用动植物多糖经过酸碱水解生产糖醛酸,原料天然多样、来源广泛,对开展大宗农副产品深加工和综合利用、合理利用自然资源有着重要意义。
银耳多糖(Tremella polysaccharides,TP)是银耳中的重要活性成分之一,具有抗氧化、抗衰老、免疫调节、降血糖血脂等多项生理功能[7-10]。银耳多糖是由α-(1→3)-D-甘露糖为主链结构的杂多糖,主要成分有木糖、葡萄糖醛酸和甘露糖,其中葡萄糖醛酸的含量约占10%,比其他天然多糖中的原料糖醛酸含量高[11]。在一般情况下银耳多糖中的葡萄糖醛酸常与糖苷键结合在一起,通过水解等方法使银耳多糖中的葡萄糖醛酸游离或产生小分子结构,使其更易被分解利用,发挥出更强的生物活性[12]。
目前关于纯化的银耳多糖的单糖组成以及糖醛酸含量研究已有少量报道,但未见银耳多糖制备葡萄糖醛酸的研究。因此,本研究以银耳源葡萄糖醛酸为研究对象,以葡萄糖醛酸提取率为评价指标,探讨了水解时间、底物浓度、酸浓度、温度等对银耳多糖水解后葡萄糖醛酸提取率的影响,以及银耳源葡萄糖醛酸对羟基自由基、ABTS自由基、DPPH自由基的清除作用,以考察糖醛酸含量与其抗氧化活性的相关性,为以后的分离纯化、活性分析和应用研究提供参考。
1 材料与方法
1.1 主要试剂及仪器 葡萄糖醛酸标准品(上海宝曼生物科技有限公司)、无水乙醇、浓盐酸、浓硫酸、氢氧化钠、间羟基联苯、四硼酸钠、30%过氧化氢、硫酸亚铁、1,1-二苯基-2-三硝基苯肼(DPPH)标准品、ABTS标准品、三氯乙酸、水杨酸化学试剂均为分析纯、BL60S电子天平(德国SARTRIUS公司)、HH-2恒温水浴锅(国华电器有限公司)、XD-52CS-1旋转蒸发器(上海贤德实验仪器公司)、LXJ-ⅡB离心机(上海安亭科学仪器厂)、CLARIOSTAR多功能酶标仪(德国BMGLABTECH公司)。
1.2 试验方法
1.2.1 葡萄糖醛酸的测定 葡萄糖醛酸含量的检测采用间羟基联苯法[13],具体步骤如下:
四硼酸钠—硫酸溶液:0.478g四硼酸钠溶于100mL浓硫酸中,备用。
间羟基联苯溶液:称取0.15g间羟基联苯溶于5mg/mL氢氧化钠溶液中,定容至100mL,使得最终浓度为1.5mg/mL。
标准葡萄糖醛酸溶液:称取干燥至恒重的葡萄糖醛酸10mg定容至100mL,混匀配置成100μg/mL的溶液。
取100μg/mL的葡萄糖醛酸溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1mL于20mL的具塞试管中,加水至1mL,置于冰水浴中预冷3min,然后加入5mL的四硼酸钠—硫酸溶液,漩涡振荡器震荡2min后,于沸水浴中加热5min,立即冷却至室温,加入100μL间羟基联苯溶液,震荡摇匀5min,静置30min,于520nm波长处测定吸光值。测得回归方程为:y=0.0063x+0.0932,r=0.9993。
取试验结果得到的葡萄糖醛酸溶0.5mL于20mL的具塞试管中,置于冰水浴中预冷3min,然后加入5mL的四硼酸钠—硫酸溶液,漩涡振荡器震荡2min后,于沸水浴中加热5min,立即冷却至室温,加入100μL间羟基联苯溶液,震荡摇匀5min,静置30min,于520nm波长处测定吸光值。
1.2.2 银耳水解糖醛酸工艺单因素试验
1.2.2.1 温度 取1mg/mL银耳多糖溶液20mL与20mL的1.0mol/L盐酸溶液混合,将溶液在恒温振荡水浴锅中分别加热至50、60、70、80、90℃后混合進行水解反应,开始反应计时,反应6h,用2.0mol/LNaOH溶液中和,调pH值至6.5,定容60mL,并冷却至室温。取10mL反应液加入4倍体积的无水乙醇静置12h,5000r/min离心10min,收集上清液,计算葡萄糖醛酸的提取率。
1.2.2.2 时间 取1mg/mL银耳多糖溶液20mL与1.0mol/L盐酸溶液20mL混合,将溶液在恒温振荡水浴锅中分别加热至90℃后混合进行水解反应,开始反应计时,反应4、5、6、7、8h,用2.0mol/L NaOH溶液中和,调pH值至6.5,定容60mL,并冷却至室温。取10mL反应液加入4倍体积的无水乙醇静置12h,5000r/min 离心10min,收集上清液,计算葡萄糖醛酸的提取率。
1.2.2.3 酸浓度 取1mg/mL银耳多糖溶液20mL与0.3、0.5、0.7、1.0、1.2mol/L盐酸溶液20mL混合,将溶液在恒温振荡水浴锅中分别加热至90℃后混合进行水解反应,开始反应计时,反应6h,用2.0mol/L NaOH溶液中和,调pH值至6.5,定容60mL,并冷却至室温。取10mL反应液加入4倍体积的无水乙醇静置12h,5000r/min离心10min,收集上清液,计算葡萄糖醛酸的提取率。
1.2.2.4 底物浓度 取0.5、1、2、3、4、5mg/mL银耳多糖溶液20mL与1.0mol/L盐酸溶液20mL混合,将溶液在恒温振荡水浴锅中分别加热至90℃后混合进行水解反应,开始反应计时,反应6h,用2.0mol/L NaOH溶液中和,调pH值至6.5,定容60mL,并冷却至室温。取10mL反应液加入4倍体积的无水乙醇静置12h,5000r/min离心10min,收集上清液,计算葡萄糖醛酸的提取率。
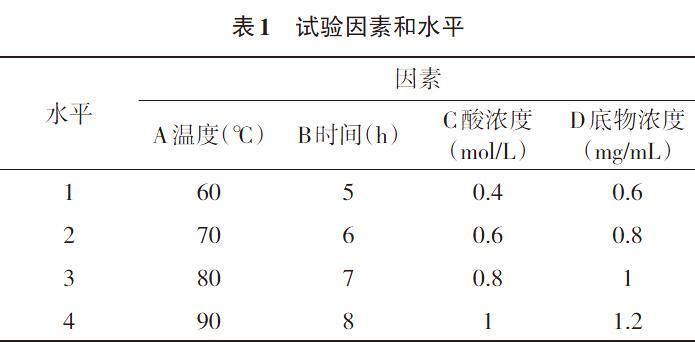
1.2.3 银耳水解糖醛酸工艺正交试验 在上述研究的基础上,对单因素条件进行正交优化,试验每组重复3次。正交试验设计见表1。
1.2.4 银耳糖醛酸与银耳多糖、葡萄糖醛酸抗氧化活性的测定
1.2.4.1 银耳糖醛酸制备 根据正交分析筛选出的最优条件生产银耳水解物。称取0.8mg/mL银耳多糖溶液500mL,加入0.1mol/L盐酸水溶液500mL,在温度90℃下加热6h,冷却至室温,加入4倍体积的无水乙醇静置12h,5000r/min离心10min,收集上清液,真空浓缩至无馏分,冷冻干燥备用。
1.2.4.2 对羟基自由基(-OH)清除效果的测定 参照文献[14]方法,往试管中依次加入配好的水杨酸—乙醇(9mmol/L)工作液、亚硫酸铁溶液(9mmol/L),然后加入浓度分别为2、4、6、8、10mg/mL的样品溶液以及过氧化氢溶液(8.8mmol/L)各1mL,纯水补足15mL,振荡混匀后置于37℃的水浴中反应15min,在波长510nm下检测吸光值,记为AX;按上述步骤用1mL的纯水代替样品检测吸光值,记为A0;将1mL纯化水代替过氧化氢检测吸光值,记为AX0。试验每组平行3次,取平均值。参照以下公式计算羟基自由基清除率:
羟基自由基清除率(%)=[1-(AX-AX0)/A0]×100
1.2.4.3 对ABTS 自由基清除效果的测定 参照文献[15]方法配制ABTS工作液,分别取浓度为1、2、3、4、5mg/mL的样品溶液100μL和ABTS工作液1.5mL充分混合,避光处常温放置1h后,于波长734nm处测定吸光度,记为AX;同时以纯水代替样品测定吸光度,记为A0;以纯水代替ABTS测定吸光度,记为AX0。试验每组平行3 次,取平均值。参照以下公式计算羟基自由基清除率:
ABTS 自由基清除率(%)=[1-(AX-AX0)/A0]×100
1.2.4.4 对DPPH 自由基清除效果测定 参照文献[16]方法,分别取浓度为1、2、3、4、5mg/mL 的样品溶液2mL和DPPH工作液2mL在试管中混匀,在常温避光处反应30min,然后于波长517nm处测定其吸光度(AX);以纯化水代替样品测定吸光度(A0);以纯化水代替DPPH工作液测定吸光度(AX0)。试验每组平行3次,取平均值。参照以下公式计算羟基自由基清除率:
DPPH自由基清除率(%)=[1-(AX-AX0)/A0]×100
2 结果与分析
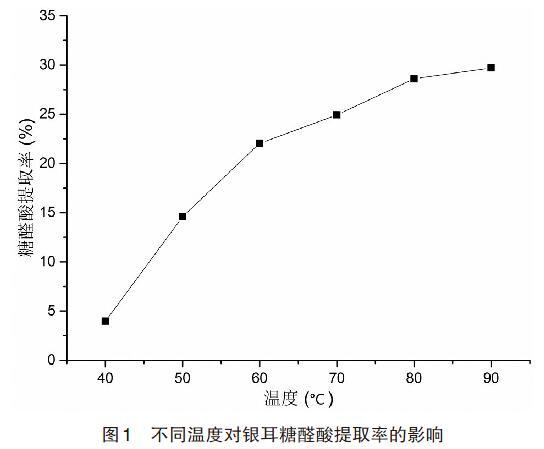
2.1 不同温度对银耳糖醛酸提取率的影响 由图1可以看出在不同温度的条件下,水解液中的葡萄糖醛酸提取率随温度的升高呈现逐渐上升的趋势,通过数据分析显示,当温度达到90℃时糖醛酸提取率达到最高,但80℃与90℃糖醛酸提取率相差较小,分别为28.60%和29.71%;这可能是因为温度越高,分子运动越激烈,酸分子与多糖的糖苷键接触的机会越多,大大增加了糖苷键的断裂机会,使带有葡萄糖醛酸的糖苷键游离出来,更易被分离提取;这可能是由于反应液内葡萄糖醛酸的糖苷键基本游离出来,糖醛酸提取率就开始趋于平稳[17]。
2.2 不同时间对银耳糖醛酸提取率的影响 由图2可知水解时间与银耳糖醛酸的提取率密切相关,水解时间太短时银耳多糖反应不够充分,糖醛酸提取率太低,随着水解反应时间的不断延长,葡萄糖醛酸含量也逐渐增大,水解时间到达6h时糖醛酸提取率到达最高峰,为26.29%,随后糖醛酸的提取率随水解时间的延长开始有小幅下降。这可能是因为长时间的高温在一定程度上破坏了糖醛酸的结构,使糖醛酸提取率下降[18]。因此综合考虑确定银耳糖醛酸提取的最佳水解时间为6h。
2.3 不同底物浓度对银耳糖醛酸提取率的影响 如图3所示,当底物浓度在0.5~5mg/mL范围时,水解液中的葡萄糖醛酸提取率刚开始呈现上升趋势,但底物浓度超过1mg/mL后糖醛酸提取率开始逐步下降,当底物浓度到达3mg/mL时糖醛酸提取率变化趋势趋于平稳。这可能是由于底物浓度较小时,反应液内糖醛酸的量有限,因此糖醛酸提取率较小。随着底物浓度的增加,糖醛酸的提取率也随之上升,上升到一定浓度时反应液黏度增大,当黏度到达一定程度时,盐酸分子不能充分地与糖苷键进行接触水解,从而降低了水解效率,使葡萄糖醛酸提取率下降或停滞不前。因此综合考虑银耳糖醛酸提取的最佳底物浓度为1mg/mL。
2.4 不同酸浓度对银耳糖醛酸提取率的影响 由图4可以看出,随着酸浓度的增加,葡萄糖醛酸含量也在逐渐增加。当盐酸浓度达到0.7mol/L后,糖醛酸提取率曲线趋于平缓。由于过大的盐酸浓度会使后续的调节pH产生大量的盐,不利于之后的分离纯化检测,因此选择0.7mol/L的酸浓度作为水解的最佳条件。
2.5 正交试验 在单因素试验的基础上,采用正交试验筛选最佳的水解条件组合。如表2所示,通过比较k值可以得出水解条件的最优组合为A4B2C4D2,即温度90℃,时间6h,盐酸浓度1mol/L,底物浓度0.8mg/mL。极差R分析结果显示,4种影响因素中温度的极差最大,为18.215,底物浓度次之,说明在水解的过程中,主要影响的因素是温度,其次是盐酸的浓度。
对正交试验结果进行方差分析,如表3所示,通过比较F值可以得出,4种因素的显著性差异大小为A>C>B>D,即温度>酸浓度>时间>底物浓度。这与表2中的极差分析结果相一致。进一步的统计分析和显著性检验结果表明,因素B、D对葡萄糖醛酸提取率的影响不显著,因此从表2中选取平均数最大的水平B2D2为最优水平;因素A、C影响极显著(P<0.01),进一步进行多重比较。
采用邓肯氏新复极差法对因素A、C进行多重比较,结果显示因素A处于第3水平(80℃)、第4水平(90℃)时葡萄糖醛酸的提取率相差不大,两者均可作为优选条件。综合经济节能考虑,选取第3水平为温度的最优条件,即A3。因素C中第4水平(1mol/LHCl)要显著优于其他水平,因此选取第4水平为酸浓度最优条件,即C4。
根据正交试验方差分析和多重比较,A3B2C4D2为最优方案。将筛选出的最优水平做验证试验,结果与正交试验结果相一致,说明酸水解银耳多糖提取糖醛酸的最佳工艺条件即为水解温度80℃下,水解6h,盐酸浓度1mol/L,底物浓度0.8mg/mL,所得的银耳糖醛酸提取率為32.03%±1.70%。
2.6 银耳糖醛酸体外抗氧化效果
2.6.1 对羟基自由基的清除效果的测定 从图5可以看出银耳多糖、银耳糖醛酸、葡萄糖醛酸对羟基自由基均有清除作用,且随着浓度的增加而有所增强,说明羟基自由基的清除率与三者的质量浓度呈一定的量效关系。经方差分析表示,当浓度处于2mg/mL时,三者的羟基自由基清除率差异显著(P<0.01)。当浓度超过8mg/mL后,三者虽都处于上升趋势,但三者清除率的差异并不显著(P>0.05)。葡萄糖醛酸的羟基自由基清除率要高于银耳多糖与银耳糖醛酸,这可能是因为葡萄糖醛酸水溶液不稳定性,易与羟基结合从而减少有色物质生成,使羟基自由基清除率上升。银耳糖醛酸的羟基自由基清除率要略高于银耳多糖,可能是由于银耳水解物中糖醛酸含量要略高于银耳多糖,糖醛酸通过与自由基反应从而达到清除自由基的目的。
2.6.2 对ABTS 自由基的清除效果 由图6结合方差分析可知,在一定浓度范围内(1~5mg/mL),银耳糖醛酸的ABTS自由基清除效果远远优于银耳多糖和葡萄糖醛酸(P<0.01),银耳糖醛酸ABTS自由基清除率IC50为1.13mg/mL。银耳糖醛酸浓度在1~3mg/mL时ABTS自由基清除率有着极显著上升(P<0.01)。随着样品浓度的增加,银耳多糖和葡萄糖醛酸的ABTS自由基清除率略有上升,但两者差异并不显著(P>0.05)。当银耳糖醛酸浓度到达3mg/mL时,银耳糖醛酸的ABTS自由基清除率达到98.96%,而银耳多糖和葡萄糖醛酸ABTS自由基清除率才达到14.01%和8.31%,可见银耳糖醛酸的ABTS自由基清除效果要优于银耳多糖和葡萄糖醛酸。
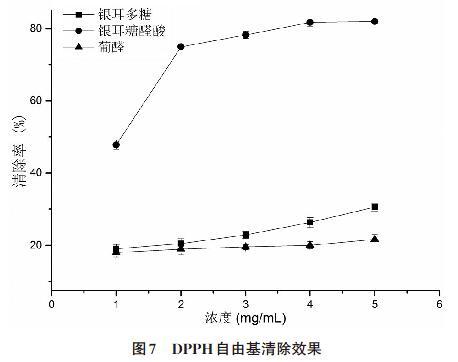
2.6.3 对DPPH 自由基的清除效果 图7结合方差分析表明,在1~5mg/mL浓度范围内,银耳糖醛酸的DPPH自由基清除率大大优于银耳多糖和葡萄糖醛酸(P<0.01),银耳糖醛酸DPPH自由基清除率IC50为1.08mg/mL。当浓度在1~3mg/mL之间,银耳糖醛酸DPPH自由基清除率大幅度上升;当浓度到达3mg/mL之后,银耳糖醛酸DPPH自由基清除率趋势逐渐放缓且差异并不显著(p>0.05),清除率之差逐步维持在2~3个百分点。随着银耳多糖和葡萄糖醛酸浓度增加,其DPPH自由基清除率虽有上升,但是相邻浓度间DPPH自由基清除率差异并不显著(p>0.05),上升趋势缓慢,远不如银耳糖醛酸。
3 结论
在单因素试验的基础上,以银耳葡萄糖醛酸提取率为评价指标,以水解温度、时间、酸浓度、底物浓度为考察因素,通过L16(45)正交试验结合多重比较确定酸水解法提取银耳糖醛酸的最优工艺条件:温度80℃下,水解6h,盐酸浓度1mol/L,底物浓度0.8mg/mL。
根据最优工艺条件生产的银耳水解物,其体外抗氧化试验表明银耳糖醛酸的抗氧化活性要优于银耳多糖和葡萄糖醛酸。当银耳糖醛酸浓度达到5mg/mL时,其对羟基自由基、ABTS 自由基、DPPH自由基清除率分别为30.51%、99.40%、82.01%。根据银耳多糖和葡萄糖醛酸的抗氧化试验结果,结合方差分析可见银耳糖醛酸对于羟基自由基的清除效果稍差一些,但对ABTS自由基、DPPH自由基的清除效果非常好(p<0.01)。
参考文献
[1]Pitt N, Duane RM, O′Brien A, et al. Synthesis of a glucuronic acid and glucose conjugate library and evaluation of effects on endothelial cell growth[J]. Carbohydrate Research, 2004,339(11):1873-1887
[2]周楷.葡醛内酯清洁生产工艺的研究[D].武汉:武汉工程大学,2013.
[3]吴艳丽,邵珠领,张宇,等.南瓜均一多糖的分离纯化及其抗氧化活性的研究[J].食品研究与开发,2019(23):62-70.
[4]李益烽.鲁氏接合酵母产葡萄糖醛酸发酵条件优化[D].无锡:江南大学,2019.
[5]DELATTRE C, MICHAUD P, LION J M, et al. Produc- tion of glucuronan oligosaccharides using a new glucuronan lyase activity from a Trichoderma sp.Strain[J].Journal of Biotechnology,2005,118(4):448-457.
[6]卢瑞.葡萄糖醛酸及其内酯的制备与表征[D].西安:陕西科技大学,2018.
[7]CHEN B. Optimization of extraction of Tremella fuciformispolysaccharides and its antioxidant and antitumour activities in vitro[J]. Carbohydrate Polymers, 2010,81(2):420-424.
[8]陈岗.银耳多糖的功能特性及其应用[J].中国食品添加剂,2011(4):144-148.
[9]Cho EJ, Hwang HJ, Kim SW, et a1. Hypoglycemic effects of exopolysaccharides produced By mycelial cultures of two different mushrooms Tremella fuciformis and Phellinus baumii in ob/obmice[J]. Appl. Microbiol. Biotechnol., 2007, 75:1257-1265.
[10]Jeong HJ, Yoon SJ, Pyun YR. Polysaccharides from edible mushroom Hinmogi(Tremella fuciformis)inhibit differentiation of 3T3-L1 adipocytes by reducing mRNA expression of PPAR-γ,C/EBPα, and Leptin[J]. Food Sci. Biotechnol., 2008, 17(2):267-273.
[11]陳丽娟.银耳多糖快速提取及可控降解的研究[D].广州:华南理工大学,2017.
[12]曹桂华.银耳多糖的制备、化学结构及活性研究[D].长春:长春中医药大学,2013.
[13]马彦.TEMPO/Ca(ClO)2体系催化氧化甲苷合成葡萄糖醛酸及其内酯[D].武汉:武汉工程大学,2012.
[14]白生文,汤超,田京,等.沙棘果渣总黄酮提取工艺及抗氧化活性分析[J].食品科学,2015(10):59-64.
[15]罗莉.大枣生物活性多糖分离及抗氧化活性研究[D].焦作:河南工业大学,2012.
[16]刘继婷,鲁晓丽,张自萍.不同处理方法对贺兰山紫蘑菇多糖抗氧化活性的影响[J].食品科学,2015(4):6-10.
[17]王珊珊,李泰雅,谷舞,等.北五味子多糖热水浸提工艺优化及体外抗氧化性能研究[J].粮油食品科技,2017(1):64-69.
[18]吴加雄,袁华,张培,等.微波辅助活性MnO2选择氧化葡甲苷合成葡萄糖醛酸[J].合成化学,2015(11):1056-1059.
(责编:王慧晴)

