化学脱水法预浓缩工业钛白废酸的研究*
庞虹因,唐盛伟,张 涛
(四川大学化学工程学院,四川成都 610065)
二氧化钛(TiO2)俗称钛白粉,最主要的应用领域是涂料、纸张和塑料等行业[1]。目前,我国90%以上的钛白粉通过硫酸法生产。在硫酸法钛白粉生产过程中,会产生大量w(H2SO4)约20%的废硫酸,其中溶解了大量硫酸亚铁(FeSO4),还含有一定量的钛、铝、锰等元素[2]。该废酸如直接排放将会造成严重的环境污染及资源浪费。
目前,钛白废酸主要处理方法为直接利用和回收利用。直接利用包括采用碱性物质如石灰、氨水、氯化铵、尿素等进行反应,或作为原料生产净水剂、颜料、磷肥等[3-4]。该方法未实现硫酸和盐的分离,造成资源浪费。回收利用最为广泛的方法是采用真空蒸发技术对钛白废酸进行浓缩[5]。废酸蒸发浓缩过程中,大量的溶解盐沉淀析出,造成高浓度段换热器传热表面严重积垢,传热效率大幅降低,严重影响设备的可持续运行[6]。
有研究证明,化学脱水法能有效脱除稀酸中的水分和杂质,缓解直接蒸发过程中的盐沉淀析出、结垢等问题[7-8]。笔者以工业钛白废酸为研究对象,以FeSO4·H2O为脱水剂,主要研究了脱水时间、脱水剂用量及脱水温度对钛白废酸浓缩效果的影响,考察了杂质的脱除情况及脱水剂的循环再生性能。研究结果对钛白工业的绿色化发展及钛白废酸的资源化利用具有一定指导意义。
1 试验部分
1.1 试验原料
七水硫酸亚铁[w(FeSO4·7H2O)≥99%]为分析级试剂,购于成都科龙化学试剂有限公司;通过加热 FeSO4·7H2O 得 到w(FeSO4·H2O) ≥ 99% 一水硫酸亚铁。化学分析采用高纯水(电导率≤10-4S/m)。
1.2 试验设备与方法
1)试验设备。采用恒温水浴(DF-101S,中国巩义市裕华仪器有限公司)控制反应温度,控温精度为±1 K。采用热风干燥箱(CS101-AB,重庆试验设器厂)制备脱水剂。产品称量采用电子天平(FA2204B,精度为 ±0.000 1 g)。
2)试验方法。将钛白废酸与脱水剂以一定比例混合于250 mL的三口烧瓶中。将三口瓶密封放置于预先设定好温度的恒温水浴锅内,水银温度计(控温精度为±0.1 K)用来监控溶液的温度,确保温度的准确性。反应完成后,将三口烧瓶取出,立即用漏斗进行过滤,准确称量滤液和滤饼;滤液和滤饼分别置于100 mL容量瓶中,用高纯水稀释,分析溶液组成。最后对滤饼进行取样,用乙醇洗涤,干燥后进行XRD分析。
1.3 分析及评价方法
采用重铬酸钾滴定法测定硫酸亚铁含量,氢氧化钠滴定法测定硫酸含量,电感耦合等离子体原子发射光谱法测定钛白废酸中其他微量杂质离子含量[9-10]。固液质量比定义为脱水剂与钛白废酸的质量比。
水分及杂质脱除率α按式(1)计算:

式中:α——脱除率,%;
w1——脱水前溶液中该组分质量分数,%;
w2——脱水后溶液中该组分质量分数,%;
w3——脱水前溶液中硫酸质量分数,%;
w4——脱水后溶液中硫酸质量分数,%。
硫酸的回收率Y1按式(2)计算:

式中:Y1——硫酸回收率,%;
m1——脱水前钛白废酸质量,g;
m2——脱水后钛白废酸质量,g。
脱水剂的回收率Y2按式(3)计算:

式中:Y2——脱水剂回收率,%;
m3——干燥回收的脱水剂质量,g;
m4——加入体系的脱水剂质量,g。
2 试验结果与讨论
2.1 钛白废酸的组成
该试验所使用的钛白废酸组成见表1。

表1 钛白废酸组成
由表1可见:工业钛白废酸中含量最高的杂质离子为Fe,除Fe外,含量较高的杂质离子为Mg,Ti,Mn,其中Na,Si,K的含量较低,在测定过程中可忽略。
2.2 反应时间的影响
在FeSO4·H2O与钛白废酸质量比(以下简称固液质量比)为0.2,反应温度为25 ℃的试验条件下,考察了反应时间对溶液组成的影响,试验结果见图1。
该反应主要发生FeSO4·H2O向FeSO4·7H2O的转化。在0~60 min内,随着反应时间延长,FeSO4·H2O不断溶解,FeSO4·7H2O不断成核生长,因此溶液中H2SO4含量逐渐上升,FeSO4的含量逐渐下降。当反应时间大于60 min时,溶液浓度保持不变,说明溶液已达到钛白废酸体系的热力学平衡。为确保反应完全达到平衡,选取1 h作为反应时间。

图1 反应时间对溶液组成的影响
2.3 脱水剂加入量的影响
在反应温度为25 ℃,反应时间为1 h的条件下,考察了FeSO4·H2O脱水剂的加入量对脱水率及硫酸回收率的影响,试验结果见表2。
由表2可见:脱水率随固液质量比的增加而增加。当该质量比为0.2时,浓缩废酸中的w(H2SO4)已达到26%左右;再提高该质量比,硫酸质量分数略有上升,且析出的固体中含有少量FeSO4·H2O。

表2 钛白废酸脱水结果
在忽略杂质存在的情况下,将试验结果绘制在25 ℃下FeSO4-H2SO4-H2O三元体系的相图中[11],见图2。
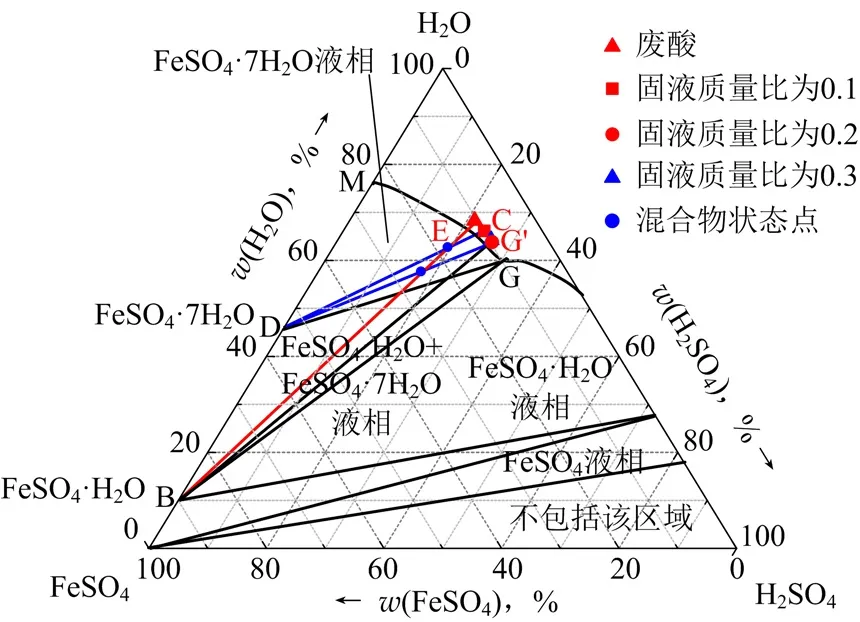
图2 25℃下FeSO4-H2SO4-H2O三元相图
由图2可见:固液质量比为0.1和0.2的两组试验符合上述原理,其析出的固体全部为FeSO4·7H2O结晶水合物。当固液质量比由0.2增大至0.3,废酸的浓缩程度几乎不变,且析出固体中包含少量FeSO4·H2O结晶水合物。根据脱水原理判断,该组试验的混合物点落在了废酸体系中FeSO4·7H2O与FeSO4·H2O的混合结晶区。上述试验现象说明固液质量比为0.2的试验条件刚好将工业钛白废酸浓缩至FeSO4·H2O与FeSO4·7H2O的转晶点G’[w(H2SO4)26%,w(H2SO4)9.5%],即25℃下亚铁离子全部以FeSO4·7H2O结晶水合物的形式析出,化学脱水所能达到的最高硫酸浓度。
2.4 杂质的脱除情况
在反应温度为25 ℃,反应时间为1 h,固液质量比为0.2的试验条件下,考察了化学脱水过程中钛白废酸杂质离子的脱除情况。其试验结果见表3。

表3 浓缩前后溶液组分
由表3可见:化学脱水过程不仅能脱除钛白废酸中的水分与Fe,还能脱除部分金属杂质,其中Mg脱除率为48.84%,Mn脱除率为34.47%。杂质的脱除将会在很大程度上缓解后续蒸发设备中的结垢堵塞问题。
2.5 温度的影响
在固液质量比为0.2,反应时间为1 h的试验条件下,考察了反应温度对脱水过程的影响。试验结果见表4。
由表4可见:反应温度对脱水反应的影响较大。随着反应温度的升高,脱水率逐渐下降。这是因为FeSO4·7H2O的溶解度随温度的升高而增大,相同反应物的条件下,钛白废酸的浓缩程度降低。当反应温度降至15 ℃时,脱水率为26.65%,脱铁率为57.13%。当温度高达35 ℃时,脱铁率为负数。这是由于温度升高导致溶解度增大,部分FeSO4·H2O脱水剂溶解在了钛白废酸中。
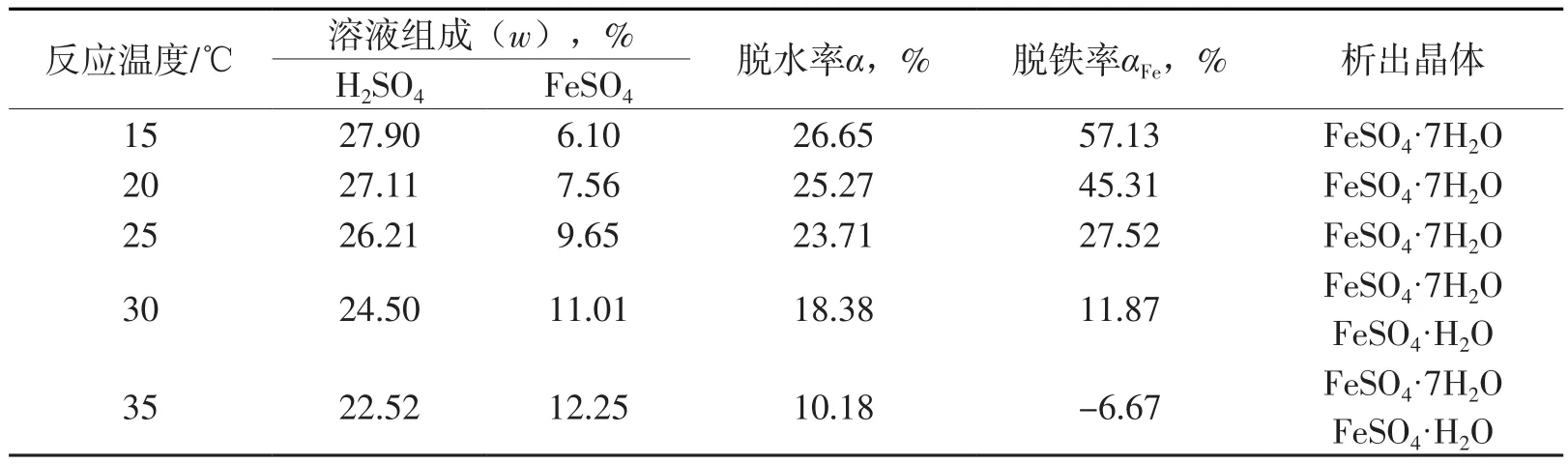
表4 反应温度对钛白废酸脱水效果的影响
从上述试验结果可以看出,合理控制反应温度能强化该脱水过程。0.2仅是达到25 ℃下转晶点所需的最大固液质量比。随着反应温度的降低,相应转晶点处硫酸含量增大,硫酸亚铁含量减小,所需固液质量比增大。因此理论上钛白废酸在15 ℃下能浓缩至更高的浓度,说明化学脱水法是一种极其有潜力的脱除水分和硫酸亚铁的技术。
2.6 脱水剂的制备过程
通过等温干燥试验,分析干燥温度对脱水剂制备过程的影响,为工业上脱水剂的制备提供理论依据。试验过程为准确称取20 g FeSO4·7H2O均匀铺在培养皿的表面,将其置于鼓风干燥箱中,分别在80,100,120 ℃下干燥至恒重,每 10 min取出放入天平称量。不同温度下FeSO4·7H2O等温干燥曲线见图3。

图3 不同温度下FeSO4·7H2O的等温干燥曲线
由图3可见:由FeSO4·7H2O制备FeSO4·H2O所需时间随干燥温度的升高而减小。在80 ℃下,干燥所需时间为 330 min,是 100 ℃下所需时间(110 min)的 3 倍,是 120 ℃下所需时间(36 min)的 9.16倍。
FeSO4在高温下容易被氧化。为确定脱水剂的氧化情况,分别对3个温度下脱水后的样品进行XRD分析,结果见图4。

图4 再生脱水剂的X射线衍射图谱
由图4可见:当干燥温度为80 ℃时,脱水剂能够得到良好再生。当干燥温度上升至100 ℃时,X射线衍射检测到Fe3+氧化物的特征峰,说明该温度下,脱水剂极易被氧化。因此,脱水剂再生过程的反应温度应控制在80 ℃左右。
2.7 脱水剂的循环试验
为研究杂质的析出对脱水剂性能的影响,试验人员对化学脱水过程过滤出的脱水剂的循环利用进行了研究。将制备的脱水剂用于下列条件的循环试验,在固液质量比为0.2,反应时间为1 h,反应温度为25 ℃的条件下,循环试验结果见表5。

表5 循环试验脱水结果
由表5可见:使用再生的脱水剂在3次循环试验后可得到相近的脱水率及回收率,说明杂质的少量析出不影响脱水剂的循环使用,脱水剂在过滤干燥之后可实现良好再生。化学脱水法在脱水的同时还会使原溶解在稀酸中的Fe沉淀析出,因此脱水剂回收率大于100%,化学脱水过程所需脱水剂可完全由脱水后析出的FeSO4·7H2O结晶水合物循环再生,脱水过程无需外加脱水剂。
3 结论
1)化学脱水法可实现工业钛白废酸的预浓缩和硫酸亚铁的预脱除。室温25℃下,以FeSO4·H2O为脱水剂,最高能将废酸w(H2SO4)由21.17%浓缩至26.11%,脱水率为23.37%,所需固液质量比为0.2。
2)化学脱水法可脱除工业钛白废酸中的部分金属杂质,在室温下进行试验,Fe,Mg,Mn的脱除率分别为25.99%,48.84%,34.47%。杂质的预脱除将会缓解后续蒸发过程的沉淀析出问题。
3)最佳反应时间为1 h。反应温度对反应过程的影响较大,低温有利于脱水过程,可通过降温强化反应的性能,在固液质量比为0.2的条件下,将反应温度降至15 ℃时,钛白废酸浓缩至w(H2SO4)27.9%,硫酸亚铁脱除率达57.13%。
4)80 ℃热风干燥FeSO4·7H2O为最佳的脱水剂再生方式。将再生脱水剂进行3组循环试验都得相近的脱水率,说明杂质的少量析出不影响脱水剂的回收过程,脱水剂具有良好的回收性能。

