产普鲁兰酶芽孢杆菌L5的ARTP诱变育种及发酵优化研究
宇光海,王翱宇,李海峰,惠 明
河南工业大学 生物工程学院,河南 郑州 450001
普鲁兰酶(pullulanase)是一类能够专一性分解α-1,6糖苷键的淀粉脱支酶,能产普鲁兰酶的菌种主要有假交替单胞菌(Pseudoalteromonas)、嗜酸芽孢杆菌(Bacillusacidophilus)、嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)以及少数真菌等[1-4]。在食品工业中,葡萄糖淀粉酶只能水解线性的α-1,4糖苷键,而普鲁兰酶可特异性水解支链淀粉中的α-1,6糖苷键,两者共同使用可以加快糖化过程并减少葡萄糖淀粉酶的使用量[5]。如今,普鲁兰酶已经成为高效利用淀粉的关键酶之一,在果葡糖浆、超高麦芽糖浆以及啤酒生产中起着关键作用[6-8]。此外普鲁兰酶在改性淀粉食品生产中也有应用,比如生产抗消化淀粉、缓消化淀粉、歧化环糊精以及直链淀粉等[9-11]。然而,普鲁兰酶工业化生产仍面临单位发酵酶量低、生产成本高等难题,严重影响普鲁兰酶的工业化应用[12]。
目前,产普鲁兰酶工业菌株的育种研究主要应用传统诱变育种及基因工程技术,基因工程育种技术主要包括对产普鲁兰酶野生菌株的直接改造及普鲁兰酶的异源表达。普鲁兰酶异源表达虽有较高的表达量,但容易形成包涵体且复性困难[13];对产普鲁兰酶野生菌株的直接改造不仅操作复杂而且成本较高[14];传统的紫外诱变及化学诱变,不仅正突变率较低而且存在潜在的毒害危险。常压室温等离子体(ARTP)诱变技术具有正突变率高、成本低、易操作、安全等优势,已成功运用于各种产酶微生物育种,如通过采用ARTP对枯草芽孢杆菌(Bacillussubtilis)XZI125进行诱变,使纳豆激酶活力提高了26.5%[15];采用ARTP诱变使枯草芽孢杆菌BL03产纤维素酶活力提高了72%[16];采用ARTP对产葡萄糖氧化酶(GOD)菌株黑曲霉1504进行诱变,产酶活力提高至原始菌株的3.31倍[17]。
作者从郑州市某淀粉厂附近的土壤中筛选得到一株产普鲁兰酶菌株L5,通过16S rDNA测序、Blast序列对比、构建系统发育树,鉴定为芽孢杆菌菌属(Bacillusgenus)。以L5菌株为出发菌株,采用ARTP技术对其进行诱变育种,优化诱变参数,通过3轮诱变筛选出4株普鲁兰酶高产菌株。利用正交试验对发酵工艺参数进行优化,并对其酶学性质进行初步研究。
1 材料与方法
1.1 材料
1.1.1 菌种来源
郑州市某淀粉厂附近的土壤中筛选得到一株产普鲁兰酶菌株L5。
1.1.2 主要试剂
普鲁兰糖:上海瑞永生物科技有限公司;3,5-二硝基水杨酸:国药集团化学试剂有限公司;基因组提取试剂盒:TaKaRa公司。
1.1.3 培养基
筛选培养基:普鲁兰糖3.0 g,蛋白胨5.0 g,KH2PO40.5 g,MgSO4·7H2O 0.1 g,琼脂粉20.0 g,加水定容至1 000 mL,pH 7.0。
发酵培养基:可溶性淀粉20 g,蛋白胨10 g,酵母浸粉(或酵母膏)5 g,KH2PO41 g,CaCl21 g,MgSO4·7H2O 0.5 g,加水定容至1 000 mL,pH 7.0。
1.2 仪器与设备
DHP-9052电热恒温培养箱:上海一恒科学仪器有限公司;TC-XP-G基因扩增仪:杭州博日科技有限公司;ZWYR-D2402恒温培养振荡器:上海智城分析仪器制造有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;MANDELA多功能等离子体诱变仪:北京伟恩斯技术有限公司。
1.3 方法
1.3.1 普鲁兰酶活力测定
采用DNS法[18]测定普鲁兰酶活力。用葡萄糖制作标准曲线,每分钟生成1 μmol还原糖(以葡萄糖计)所需酶量定义为1个酶活力单位(U)。
1.3.2 16S rDNA鉴定
采用TaKaRa基因组提取试剂盒提取细菌总DNA,利用16S rDNA通用引物(P0∶5′-CTACGGCTACCTTGTTACGA-3′和P6∶5′-GAGAGTTTGATCCTGGCTCAG-3′),对L5菌株16S rDNA基因进行克隆和测序(赛默飞), 测序结果提交GeneBank数据库,登录号为MN148884,并利用MEGA5.1以Neighbor-Joining法构建系统发育树。
1.3.3 ARTP诱变方法及筛选
以氮气作为工作气体(气流量为12 L/min),输入功率115 W,照射距离2 mm,处理时间为10~90 s,间隔为10 s,对L5菌株进行诱变。利用生理盐水稀释诱变后菌液,涂布筛选培养基平板,37 ℃避光培养24 h后,挑选水解圈直径大于对照组的菌株,并转接到筛选培养基斜面。
1.3.4 正交法优化普鲁兰酶发酵培养基
首先利用单因素试验初步确定碳源、氮源、金属离子最佳组合,碳源:可溶性淀粉、支链淀粉、糊精、糊精和可溶性淀粉,质量分数为1.0%;氮源:蛋白胨、黄豆粉、酵母浸粉、蛋白胨和黄豆粉、蛋白胨和酵母浸粉、黄豆粉和酵母浸粉,质量分数为1.0%;金属离子:K+、Ca2+、Mg2+、Fe2+、Zn2+,质量分数为0.1%。然后在单因素试验的基础上选定各因素(可溶性淀粉、糊精、蛋白胨、黄豆粉、Ca2+、Fe2+、Zn2+),进行七因素三水平正交试验[19],进一步优化培养基。
1.3.5 生长曲线及产酶曲线测定
平板培养:将菌株接种于筛选培养基上,37 ℃培养24 h。
摇瓶发酵:将菌株以2%的接种量接种到发酵培养基中,37 ℃、180 r/min摇瓶培养24 h,用DNS法测酶活。
生长曲线及产酶曲线测定:将菌株发酵40 h,前12 h间隔2 h取样,12~48 h间隔4 h取样,测OD600和所产普鲁兰酶活力。
1.3.6 酶学性质研究
1.3.6.1 普鲁兰酶的最适反应温度和pH值
在不同温度(35~85 ℃,间隔为5 ℃)及不同pH值(5.0~8.5,间隔为0.5)条件下,分别测定普鲁兰酶活力,确定酶最适反应温度及pH 值。
1.3.6.2 普鲁兰酶的温度及pH稳定性
将酶液分别置于不同温度(30~80 ℃,间隔为10 ℃)的水浴中保温2 h后测定酶活力,研究普鲁兰酶的热稳定性。将酶液分别置于不同pH值(4.0~9.0,间隔为1)的缓冲液中室温保持4 h后测定酶活力,研究普鲁兰酶的pH稳定性。
1.3.6.3 普鲁兰酶动力学参数测定
在不同质量浓度的普鲁兰糖底物(1~5 mg/mL;溶解于0.2 mol/L、pH 6.5的磷酸缓冲溶液)中加入1 mL酶液,以去离子水为空白对照,测定酶活力,计算出底物不同浓度下酶的反应速度,绘制双倒数曲线。
2 结果与分析
2.1 菌株的鉴定
将L5的16S rDNA序列进行Blast对比分析,结果表明:L5菌株与芽孢杆菌Bacillussubtilisstrain AB30JX188065.1的相似性超过99%。利用MEGA5.1构建系统发育树,如图1所示,菌株L5与Bacillussubtilisstrain AB30JX188065.1、BacillussubtilisIMG04 LC469932.1在同一分支上,表明L5菌株属于芽孢杆菌菌属(Bacillusgenus)。

图1 L5系统发育树
2.2 ARTP诱变
如图2所示,致死率随着诱变时间的延长显著上升。致死率在60 s时达到79.8%,90 s时趋近100%。诱变时间在30~60 s时正突变率与致死率呈正相关,60 s达到最高(正突变率5.1%),60 s后正突变率随诱变时间的延长而显著下降,表明最佳诱变时间为60 s。
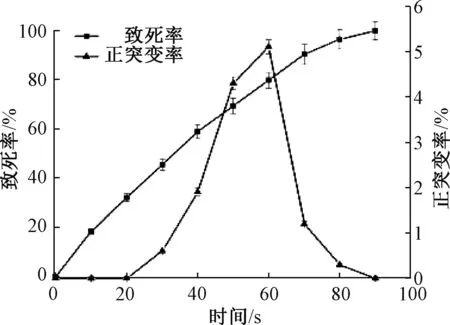
图2 L5菌株ARTP诱变致死率和正突变率曲线
利用水解圈法挑出218株突变菌进行摇瓶发酵验证,筛选出发酵产酶活力最高的4株正突变菌株G1(20.33 U/mL)、G2(19.68 U/mL)、G3(19.31 U/mL)、G4(22.01 U/mL),与出发菌株(10.83 U/mL)相比产酶活力分别提高了87.7%、81.7%、78.3%、103.2%。将普鲁兰酶高产突变菌株G4在斜面固体培养基上进行10次传代培养,并分别接种发酵培养基,进行产普鲁兰酶发酵稳定性的研究。结果表明,G4具有较好的产普鲁兰酶发酵稳定性,产酶活力波动范围在5%之内。
2.3 正交法优化菌株产酶条件
2.3.1 单因素试验
利用单因素试验初步确定G4菌株发酵培养基最佳的碳源、氮源及金属离子组合。结果表明,糊精与可溶性淀粉组合为最佳碳源,产酶活力为23.42 U/mL;蛋白胨与黄豆粉组合为最佳氮源,产酶活力为24.39 U/mL;金属离子中Ca2+、Fe2+、Zn2+对普鲁兰酶活力都有促进作用,与对照组相比,产酶活力分别提高了28.8%、45.1%、48.2%。综合各单因素结果,确定最佳组合为可溶性淀粉、糊精、蛋白胨、黄豆粉、Ca2+、Fe2+、Zn2+。
2.3.2 正交试验
在单因素试验的基础上,以可溶性淀粉、糊精、蛋白胨、黄豆粉、Ca2+、Fe2+、Zn2+为因素,设计七因素三水平正交试验优化普鲁兰酶发酵培养基,结果见表1。
如表1所示,7个因素对G4菌株产普鲁兰酶的影响:可溶性淀粉>Zn2+>Ca2+>糊精>蛋白胨>黄豆粉>Fe2+,并依据k值确定最佳组合为A3B2C1D3E1F2G3,即可溶性淀粉1.5%、糊精1.0%、蛋白胨0.5%、黄豆粉1.5%、Ca2+0.05%、Fe2+0.10%、Zn2+0.15%,产酶活力为27.22 U/mL,比优化前提高了23.7%。由表2可知,在α=0.05条件下,可溶性淀粉、糊精、蛋白胨、Ca2+、Zn2+的F值分别为230.469、72.378、25.643、110.520、156.622,均大于F0.05(19.000),表明这5个因素对菌株产普鲁兰酶有显著影响;而黄豆粉和Fe2+的F值分别为9.337、1.000,均小于F0.05(19.000),表明这两个因素对菌株产普鲁兰酶影响不显著。综上,影响菌株产普鲁兰酶的关键因素为可溶性淀粉、糊精、蛋白胨、Ca2+、Zn2+。
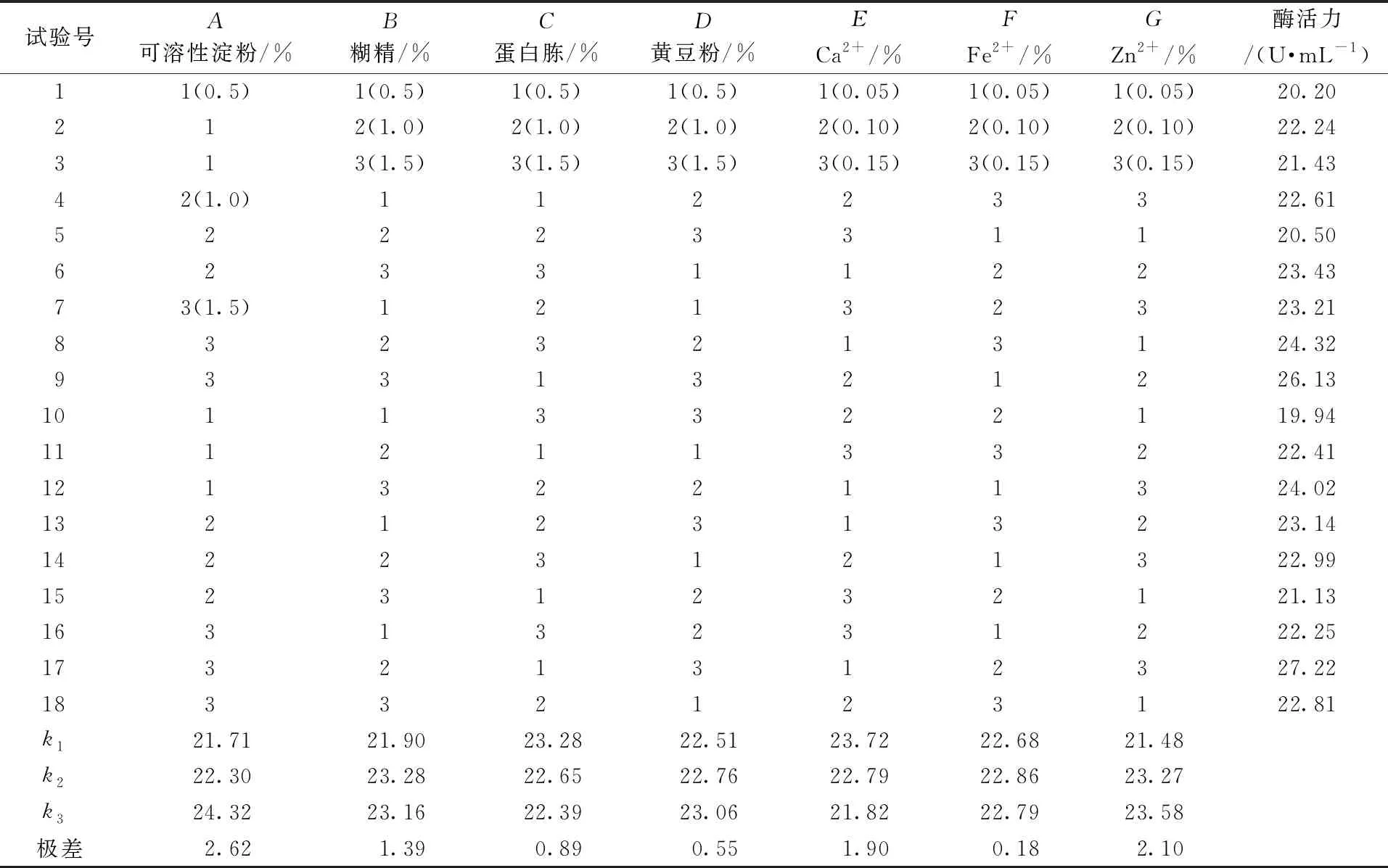
表1 正交试验设计与结果

表2 方差分析
2.4 发酵产酶性能
如图3所示,2 h后L5菌株和G4菌株均进入指数生长期,G4菌株在12 h后进入稳定期,相比L5菌株提前了4 h;G4菌株在12~40 h(稳定期)的OD600达到9.3~9.6,而L5菌株在16~40 h(稳定期)的OD600为8.1~8.5,小于G4菌株,综上,在各个生长阶段G4菌株均比L5菌株生长旺盛。0~24 h菌株L5的产酶活力随时间不断提高,在24 h达到最高值(13.5 U/mL);G4菌株在0~20 h产酶活力随着时间不断上升,在20 h达到最高值(26.9 U/mL),比L5菌株提前4 h达到最高值,且产普鲁兰酶活力提高了99.3%。综上,普鲁兰酶的合成属于初级代谢,与菌体生长呈正相关,因此突变菌株G4旺盛的生长能力是普鲁兰酶高产的重要因素之一。在菌体生长进入稳定期后,普鲁兰酶合成量的减少及本身的降解,导致L5菌株和G4菌株产酶活力下降。

图3 L5与G4菌株的生长和产酶曲线
2.5 酶学性质研究
2.5.1 酶最适反应温度与温度稳定性
如图4(A)所示,35~50 ℃时G4菌株所产普鲁兰酶活力随温度的升高而升高,当温度超过50 ℃时,酶活力明显下降,因此该酶的最适反应温度为50 ℃。随着温度的升高,G4菌株所产普鲁兰酶活力不断下降,在30~60 ℃保温2 h后相对酶活力仍能维持在80%以上,在70 ℃时还有60%的相对酶活力,说明此菌分泌的普鲁兰酶有良好的热稳定性。
2.5.2 酶最适反应pH值与pH稳定性
如图4(B)所示,当pH值小于6.5时,G4菌株所产普鲁兰酶活力随pH值的增大而增大;当pH值大于6.5时,酶活力随pH值的增大而减小,由此可判断该酶的最适反应pH值为6.5。根据普鲁兰酶在食品工业中的实际应用情况,选择pH 4~9分析酶的pH稳定性[20],在pH 5~9保存4 h后相对酶活力仍能维持在60%以上,在pH值为4时,相对酶活力为50%左右,表明此菌分泌的普鲁兰酶pH值范围广,在酸性和碱性条件下都具有一定的酶活力。

图4 G4菌株所产普鲁兰酶的酶学特性
2.5.3 酶反应动力学分析
用Lineweaver-Burk双倒数作图法,以酶促反应初速度倒数1/v对底物质量浓度倒数1/[S]作图,如图5所示。通过回归方程计算得:1/vmax=0.061,Km/vmax=0.061,vmax=16.393 μmol/min,Km=0.999 mg/mL。Km值较低,表明此酶对普鲁兰糖有强的亲和性[21]。
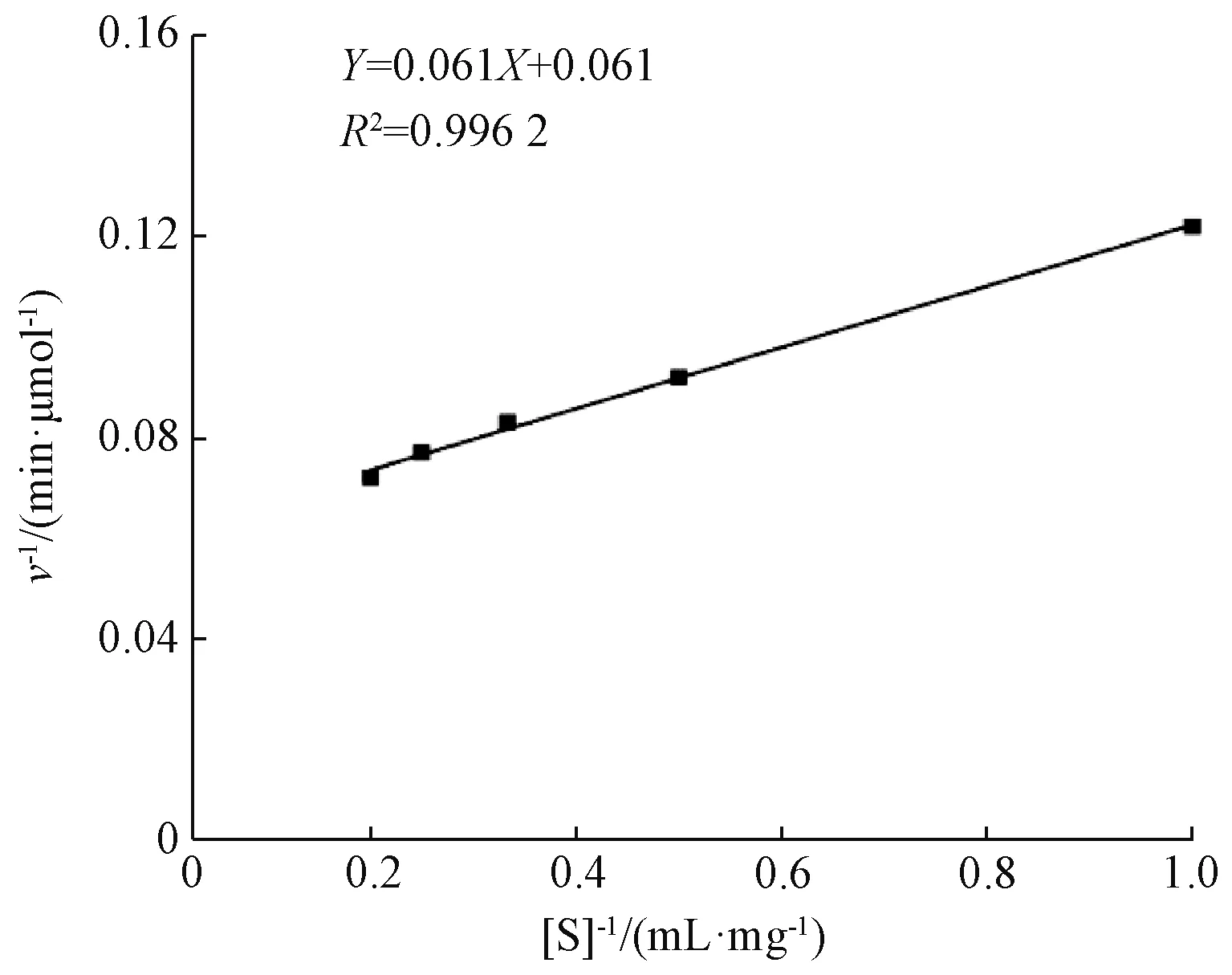
图 5 酶催化不同浓度普鲁兰糖的Lineweaver-Buk曲线
3 结论
本研究通过16S rDNA序列分析、构建系统发育树等方法对产普鲁兰酶菌株L5进行了鉴定,确定为芽孢杆菌菌属(Bacillusgenus)。采用常压室温等离子体(ARTP)诱变获得4株普鲁兰酶高产菌株,其中G4菌株的产酶活力最高(22.01 U/mL),较出发菌株约提高了2倍,在最优发酵条件下产酶活力达到27.22 U/mL,比优化前提高了23.7%。所产普鲁兰酶的最适反应温度为50 ℃、最适反应pH值为6.5,30~60 ℃保温2 h酶活能维持在80%以上,在pH 5~9保存4 h后酶活力仍能维持在60%以上,该酶具有良好稳定性。通过酶动力学试验验证,此酶对普鲁兰糖有强的亲和性。在大部分食品工业中,中性支链淀粉酶应用较广泛,L5菌所产普鲁兰酶与目前报道的普鲁兰酶相比,反应最适pH值靠近中性,热稳定性较好,具有潜在的工业应用价值。

