青岛沿海生物气溶胶中微生物活性的粒径分布特征❋
谢佳敏, 祁建华❋❋, 高冬梅
(1.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2.青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237)
生物气溶胶指大气颗粒中含有微生物或生物大分子等生命活性物质的微小粒子,包括真菌、细菌、病毒、花粉、植物和动物裂解碎片,以及其他带有生命活性的物质[1-2]。微生物是生物气溶胶的重要组成部分,每立方米空气中的微生物数量为104到105个[3]。生物气溶胶中的微生物活性可以反映微生物进行新陈代谢或正常生理活动的能力,而这种能力受到温度、紫外辐射等气象参数以及大气营养状况的影响[4]。微生物活性通常作为指示环境是否健康或土壤环境中生物修复是否有效的指标[5-6],但在大气环境中的研究非常有限。
生物气溶胶中微生物的活性水平与气候变化、大气物质转化和人体健康密切相关。研究发现,大气云水样品中76%的细菌都是具有生理活性的[7],可以充当冰核和云凝结核[8],但目前对微生物活性是否直接影响大气降水和云过程尚不清楚。大气中的微生物可以通过代谢活动参与有机物降解,改变大气中的化学组分[9]。微生物也可以作为引起呼吸道疾病和过敏的病原体,影响人类健康[10-11]。而且含微生物粒子的动力学直径对气溶胶的人体健康效应至关重要[12],粒径决定了颗粒物在人体呼吸道中的沉积部位。2.5~10 μm的颗粒物主要沉积在鼻腔部位,小于2.5 μm的颗粒物主要沉积在支气管和肺泡中[13],这种沉积可以导致单个器官甚至整个器官系统的健康并发症[14]。不同粒径上的微生物活性差异影响着空气中微生物潜在的环境健康风险,也同样影响着微生物可以参与有机物转化的能力。因此,对微生物活性的粒径分布特征进行研究是很有必要的,它可以为生物气溶胶的环境与健康效应提供重要参考。
微生物的活性可以用荧光素二乙酸酯(Fluorescein diacetate,FDA)水解法进行准确快速的测定,该方法广泛应用于土壤中微生物活性的测定[15]。Qi等[16]提出了用于测定大气中微生物活性的FDA水解法。钟茜[17]使用该方法测定出青岛地区2013年3月~2014年2月生物气溶胶中微生物的活性水平是5.49~102 ng·m-3荧光素钠,微生物活性的粒径分布随季节没有明显的变化,但其仅研究分析了0.65~2.1、2.1~4.7和大于4.7 μm三个粒径段上的活性水平。孟祥斌等[18]初步分析了青岛冬季微生物活性的粒径分布趋势,发现活性随着粒径的增大而增大,但对粒径分布的季节差异和影响因素未做系统研究。李孟哲[19]分析了不同天气条件下生物气溶胶中微生物活性的影响因素,发现晴天下生物气溶胶中微生物的活性主要受到AQI和PM10的影响,雾天下微生物的活性主要受到大气温度的影响。
虽然对生物气溶胶中微生物活性的水平、分布特征和影响因素研究取得了一定进展,但目前仍缺乏针对微生物活性粒径分布特征的系统研究,对活性粒径分布的影响因素仍不明确。本研究以青岛近海作为研究区域,于2017年3月~2018年2月连续采集了生物气溶胶样品,分析了生物气溶胶样品中微生物活性水平的粒径分布特征及其月季变化,探究了气象因素、气团来源和常规空气污染物对生物气溶胶中微生物活性粒径分布的影响。
1 材料与方法
1.1 采样时间与地点
采样地点位于中国海洋大学崂山教学楼五区楼顶平台(见图1,36°10′N,120°30′E),距离地面高度为9 m,到海岸线的直线距离约为7 km,周围绿地覆盖面积达50%。于2017年3月~2018年2月,每月采集5套平行样品,相邻采样时间间隔为4~6 d,每次采样时间为早上8:00,遇到特殊天气加采生物气溶胶样品。
图1 生物气溶胶采样点位置Fig.1 Location of the sampling site for atmospheric bioaerosols samples
1.2 样品的采集与处理
采用FA-1型六级筛孔撞击式空气微生物采样器(辽阳市康洁仪器研究所)收集生物气溶胶样品,采样器高度为1.5 m,采样流量为28.3 L·min-1,采样器分为0.65~1.1、1.1~2.1、2.1~3.3、3.3~4.7、4.7~7.0和大于7.0 μm的6个粒径范围,采样膜为灭过菌的0.22 μm孔径的聚碳酸酯膜,每个样品的采集时间为40 min。
本研究采用Qi等[16]提出的荧光素二乙酸脂水解法对生物气溶胶中的微生物活性进行测定。采样前将所用的实验材料在灭菌锅中于121 ℃灭菌20 min后放入60 ℃烘箱中烘干。采样器需要在无菌超净台中使用75%的酒精擦拭,并用紫外灯灭菌15 min,将灭菌后的聚碳酸酯滤膜放入采样塔各级平板上并组装好采样器。样品采集结束后在无菌操作台中将每级采样膜裁剪为八等份,分别放入预先装有20 mL 0.85%~0.9%氯化钠溶液的无菌锥形瓶中,在37 ℃的恒温振荡培养箱中振荡30 min,转速为150 r·min-1。振荡后在各样品中加入200 μL FDA溶液(浓度为100 μg·mL-1),在30 ℃恒温黑暗条件反应150 min。反应结束后将锥形瓶中的液体转移到50 mL的无菌离心管中,并加入1 mL终止剂(甲醇与三氯甲烷的体积比为1∶2)使反应终止,然后用转速为5 000 r·min-1的离心机将样品离心5 min,使用分子荧光光度计(Hitach,日立荧光光谱仪F-4600,日本)(λex=488 nm,λem=530 nm)对离心后样品的上清液进行测定,同时以空白聚碳酸酯滤膜作为空白对照组进行同样的处理。为消除不同荧光分光光度计的测定误差,样品的活性以荧光素钠作为标准品定量,因此配置浓度为0~10 ng·mL-1的荧光素钠标准溶液,测定其荧光强度并绘制标准曲线(相关系数应大于0.99),将测定出的生物气溶胶样品荧光强度扣除空白(空白荧光强度小于3时,样品视为有效样品,空白高时,则认为样品被沾污而不可用)后,通过标准曲线换算为溶液中微生物活性水平Ma,然后根据下式计算气溶胶中荧光素钠的浓度:
Ma(空气)= 1 000·V·Ma(溶液)/Q·t。
(1)
式中:Ma(空气)为单位体积空气中生物气溶胶微生物活性水平(ng·m-3);Ma(溶液)为单位体积提取液中生物气溶胶微生物活性水平(ng·mL-1);V为样品提取液体积(mL);Q为采样流量(L·min-1);t为采样时间(min)。
1.3 数据来源
本研究用到的气温、相对湿度和风速数据来源于青岛市气象局(http://qdqx.qingdao.gov.cn/),PM2.5、PM10和CO、NO2、SO2、O3浓度来源于中国环境监测总站(www.cnemc.cn),本文讨论中所用数据均为采样时段内1 h的平均值。
1.4 数据分析方法
在t-检验和Spearman相关性分析中,P<0.05表示在95%置信区间内具有统计学意义上的显著差异。
后向轨迹采用美国国家海洋与大气局(NOAA)大气资源实验室的HYSPLIT4模型(https://ready.arl.noaa.gov/index.php),气团后推时间为72 h,考虑边界层高度,分析时起始高度选为1 000 m。
2 结果与讨论
2.1 青岛近海生物气溶胶中微生物活性粒径分布特征
2.1.1 青岛近海生物气溶胶中微生物活性粒径分布的季节变化 2017年3月~2018年2月,青岛近海生物气溶胶中不同粒径微生物活性水平的季节变化如图2(a)所示。不同季节微生物活性在小于7 μm各粒径范围内差异较小(P>0.05),在大于7 μm粒径范围内,除了春、秋季节之间差异不明显(P>0.05),其他季节均存在显著差异(P<0.05)。夏季活性((11.81±9.05) ng·m-3荧光素钠)最高,相关性分析结果显示(见表1),在大于4.7 μm粗粒径范围内微生物活性与温度呈显著的正相关(P<0.01)。夏季的平均温度(25.5 ℃)相对于其他季节最高,较高的温度有利于微生物的生长繁殖[20],因此其活性更高。而冬季在该粒径段活性水平((3.20±2.60) ng·m-3荧光素钠)明显低于其他季节(P<0.05),这一方面是由于冬季下雪较多,大雪覆盖地面,低温造成水体表面结冰,地面、水体表面和动植物表面的微生物不容易扩散到大气中,使微生物的来源减少,进而导致微生物的活性水平较低;另一方面是由于冬季气温低(-1.0 ℃),低温条件下,细胞膜的流动性减弱,细胞酶活性降低[21]。春、秋季节在各粒径段上的活性水平均相差不大(P>0.05),这可能是由于春季的气象条件(温度为11.2 ℃, 相对湿度为67.3%)与秋季(温度为14.3 ℃,相对湿度为54.0%)相近,都较适宜于微生物的生长,并且存在较多的微生物源[22-24]。整体来看,微生物总的活性水平(不同粒径范围活性的总和)表现为夏季最高(22.91±14.42) ng·m-3荧光素钠),春季((17.97±8.79) ng·m-3荧光素钠)与秋季((18.99±9.02) ng·m-3荧光素钠)相近,冬季((8.76±5.82) ng·m-3荧光素钠)最低,这与之前在青岛的研究结果是一致的[18-19],说明微生物活性的季节分布特征不存在明显的年际变化。
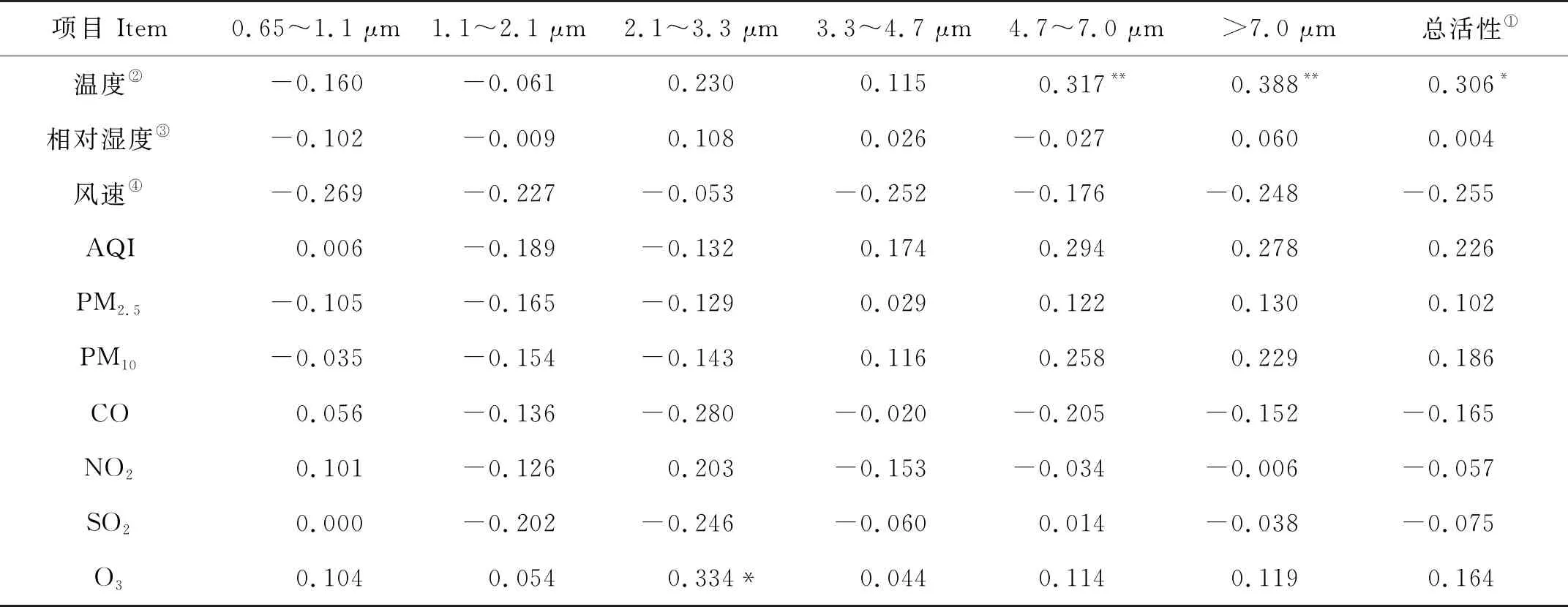
表1 不同粒径粒子中微生物活性与气象参数、颗粒物、气体污染物的相关性Table 1 Spearman correlation coefficients between microbial activity in different particle size and meteorological parameters,particulates and gas pollutants
生物气溶胶中各粒径段上微生物活性所占比例的季节变化如图2(b)所示。虽然不同粒径微生物活性水平的季节变化明显,但微生物活性的粒径分布比例基本一致,呈现随粒径增加活性增大的偏态分布,在大于7 μm的粒径范围内微生物活性所占比例最高,春、夏、秋、冬四季的比例分别为40.49%、46.19%、40.10%、33.80%。微生物活性最低值出现的粒径范围存在较大季节差异,春季和秋季最低值出现在1.1~2.1 μm粒径范围内,所占比例分别为8.37%和6.76%;夏季出现在0.65~1.1 μm粒径范围,所占比例为5.31%;冬季移动到了2.1~3.3 μm粒径范围,所占比例为7.04%。整体而言,微生物活性均主要分布在粗颗粒物(由于所用采样器的限制,本研究中粗颗粒物指的是大于2.1 μm的粒子)上,所占比例变化较小,分别为82.83%、88.75%、83.73%、82.73%,这与之前的研究结果一致[18-19]。一方面,相比较于粗颗粒物,细颗粒物在大气中的停留时间较长,表面微生物容易发生代谢和死亡;另一方面,细颗粒物富集有许多有毒物质,不利于微生物的存活[25],粗颗粒物可以为微生物的生长繁殖提供庇护,因此,其所负载微生物的活性水平更高。

((a)微生物活性水平;(b)微生物活性所占比例。(a)Microbial activity level;(b)The proportion of microbial activity.)
2.1.2 青岛近海生物气溶胶中微生物活性粒径分布的月变化 青岛近海生物气溶胶中微生物活性粒径分布的月变化如图3(a)所示,样品采集时的气象信息见表2。总微生物活性水平变化表现为3~5月活性水平波动较小,6月份出现活性月均最高值,6~8月表现为逐渐降低的趋势,9、10月份活性水平接近且比8月份有所升高,11~2月活性水平整体较低,1月份出现活性月平均最低值。统计检验显示3、4月份在0.65~1.1 μm粒径范围内差异显著(P<0.05),8月与7、9、10月份在大于4.7 μm粒径范围内差异显著(P<0.05),与6月在1.1~2.1 μm和大于3.3 μm粒径范围内差异显著(P<0.05),9、11月在大于7 μm粒径范围内差异显著(P<0.05),12、1月在3.3~4.7 μm粒径范围内差异显著(P<0.05),1、2月在大于7 μm粒径范围内差异显著(P<0.05)。5月与其他月份之间不存在显著性差异(P>0.05)。这说明生物气溶胶中微生物活性的粒径分布存在月变化,且随粒径而不同,但主要表现为粗粒子差异显著。

表2 生物气溶胶中微生物活性月平均值及样品采集信息Table 2 Monthly average of microbial activity and sampling information of bioaerosols sample
在0.65~1.1 μm的粒径范围内3月份活性水平高于4月份(P<0.05),虽然4月份温度有所回升,但由于该月青岛地区停止供暖,空气比较洁净,微生物浓度较低[26],导致其活性水平降低。6月份各粒径活性相对于5、7月份略有上升,但其差异性并不明显(P>0.05)。8月份微生物活性水平在大于4.7 μm的粗粒径范围低于邻近月份(P<0.05),而在1.1~2.1 μm和大于3.3 μm粒径范围内较6月份也有显著降低(P<0.05),这与8月份降雨较多有关,该月降水量为205 mm,占采样期间全年降雨量的40.5%。Li等[27]研究发现,雨天微生物浓度发生了明显的降低。生物气溶胶颗粒可以通过黏附在水滴中去除,进而导致整体活性水平降低。11月份各粒径段上微生物活性与10月份不存在显著差异(P>0.05),而大于7 μm粒径中活性((3.89±2.26) ng·m-3荧光素钠)较9月((11.51±2.07) ng·m-3荧光素钠)发生了明显的降低(P<0.05),这与该月份温度较低有关。进入冬季,12月在3.3~4.7 μm粒径范围内的活性水平高于2月(P<0.05),可能是12月较高的温度导致,而1月在大于7 μm粒径范围的活性较低(P<0.05),这是由于1月的相对湿度非常低,平均为30%,部分微生物细胞会因为干燥脱水而停止代谢活动,使微生物活性水平降低[28]。
虽然不同粒径上的微生物活性水平随月份变化较为明显,但各月微生物活性的粒径分布比例基本呈现偏态分布,峰值均出现在大于7 μm的粒径范围(见图3(b)),最低值在1.1~3.3 μm的粒径范围内变化。其中,5、6、7、9和10月的微生物活性最低值出现在1.1~2.1 μm的粒径范围内,所占比例的平均值为3.74%,3、8、12和2月的微生物活性最低值出现在2.1~3.3 μm粒径范围内,所占比例的平均值为5.42%。与大多数月份不同,11月份微生物活性最低值出现在3.3~4.7 μm的粒径范围内,所占比例为9.62%,1月份微生物活性最低值出现在0.65~1.1 μm的粒径范围内,所占比例为7.27%。总的来看,各月份微生物活性也主要分布在粗颗粒物上,所占比例的平均值为84.51%。Li等[3]在青岛的研究发现,生物气溶胶中的微生物主要分布在粗颗粒物上,粗颗粒物上较高的微生物浓度导致其表面微生物的活性水平更高。
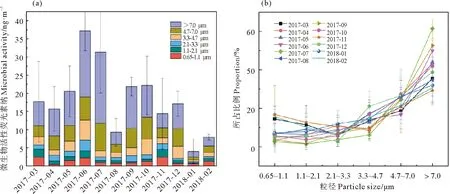
((a)微生物活性水平;(b)物活性所占比例。(a)Microbial activity level;(b)The proportion of microbial activity.)
2.2 气团来源对生物气溶胶中微生物活性粒径分布的影响
为了研究气团来源和传输路径对生物气溶胶中微生物活性粒径分布的影响,应用HYSPLIT模型[29]对样品进行聚类分析。结果显示,采样点的气团来源可以分为三类(见图4):第1类源于北方俄罗斯地区,所占比例为68%;第2类来自中部地区,所占比例为23%;第3类来自黄海海域方向,所占比例为9%。

图4 2017—2018年青岛近海地区生物气溶胶样品72 h后向轨迹聚类Fig.4 Cluster results of 72 h air mass back trajectories for aerosol samples in Qingdao coastal region during 2017—2018
不同气团来源微生物活性水平的粒径分布如图5(a)所示。来自不同气团的生物气溶胶中总的微生物活性水平呈现中部地区(第2类)最高,北方(第1类)和海洋(第3类)相近的趋势。这与孟祥斌等[18]测定的微生物活性水平表现为北方明显高于海洋的结果不同,可能是研究时段的差异,孟祥斌等的研究主要集中于冬季。统计检验显示,中部来源气团在小于3.3 μm粒径范围活性((5.04±2.46)ng·m-3荧光素钠)显著高于北方来源((3.26±3.19)ng·m-3荧光素钠)(P<0.05),海洋来源与其他来源均不存在明显差异(P>0.05)。中部气团来源活性较高是由于该气团途径山西、河南等人口密集地区,并且传输距离短,受人为影响较大。Gong等[30]的研究发现,人类活动密集地区气团来源的活细菌和总微生物浓度更高。而北方来源气团虽然也来自陆地,但传输距离长,远距离的传输过程中微生物更容易受到紫外辐射、低温等不利条件影响而发生死亡[31-32],从而导致活性降低。
不同气团来源生物气溶胶中微生物活性水平的粒径分布趋势类似,均呈现随粒径增加而活性增大的分布,在大于7 μm粒径范围内所占比例最高(见图5(b))。而不同气团来源活性最低值出现的粒径范围不同,北方来源活性最低值出现在1.1~2.1 μm范围内,所占比例为6.02%。中部来源活性最低值出现在3.3~4.7 μm粒径范围,所占比例为6.31%。海洋来源活性最低值出现在0.65~1.1 μm粒径范围,所占比例为4.61%。中部来源气团在3.3~4.7 μm粒径范围内与其他两类气团存在较大差异,其活性所占比例(6.31%)明显低于北方(12.84%)和海洋(14.88%)。
2.3 青岛近海生物气溶胶中微生物活性的影响因素
为了了解生物气溶胶中微生物活性的影响因素,本文分析了不同粒径粒子中微生物活性与气象因素(温度、风速、相对湿度)和大气污染因子(AQI、PM2.5、PM10、CO、NO2、SO2、O3)之间的Spearman相关性,结果如表1所示。

((a)微生物活性水平;(b)微生物活性所占比例。(a)Microbial activity level;(b)The proportion of microbial activity.)
不论粗细颗粒,生物气溶胶中微生物活性均与相对湿度和风速无显著相关(P>0.05)。孟祥斌等[18]研究发现,冬季风速与微生物活性呈显著正相关。这可能是由于高风速有助于土壤和植物表面微生物的释放,但是高风速也会促进当地生物气溶胶的扩散稀释[3,33],使大气中微生物的浓度降低,所以风速对微生物的活性影响复杂,是两种因素的综合作用,这是本文与之前研究结果有差异的原因。相对湿度对微生物生长也具有影响,生物气溶胶中大多数革兰氏阴性菌在较低的RH条件下存活时间更长,而革兰氏阳性菌在较高的RH条件下更易存活[21],当相对湿度条件很低时,部分细胞会干燥脱水而停止代谢[28]。本研究微生物活性与相对湿度未表现出相关性,与之前的研究结果一致[16-19,34]。由于采样期间相对湿度变化范围为28%~98%,平均值为67.8%±17.6%,多数采样天的湿度条件适合微生物的生长,并未达到其脱水阈值,但粒径大于4.7 μm粗粒子中的微生物活性和总微生物活性(各粒径微生物活性总和)与大气温度表现出正相关性(P<0.05)。Li等[3]的研究发现,大气温度与微生物浓度呈正显著相关,较高的温度有利于植物表面的微生物以及花粉释放到大气中,增加了微生物的来源[33]。此外,温度对微生物的酶促反应也有一定影响,在低于最适温度范围内,酶促反应速率会随着温度的升高而加快,而微生物多数酶的最适温度范围为25~60 ℃[28],因此,微生物活性随气温升高而增加。
各粒径生物气溶胶颗粒物中微生物活性与AQI、PM10、PM2.5均没有表现出相关性(P>0.05),与孟祥斌等[18]的研究结果一致。李孟哲[19]研究发现,晴天下粗粒径上的微生物活性与AQI和PM10呈正相关关系,可能是大气颗粒物的增加有助于微生物的附着与生长。一些研究[22,27,35]也发现微生物浓度与颗粒物存在正相关关系,较高浓度的颗粒物也可以为微生物抵挡紫外辐射的灭杀作用,并提供碳源等能量源[36]。而钟茜[17]的研究结果发现,在低污染天气下时,微生物活性与AQI表现出负相关关系,可能环境条件的恶化会使部分适宜在清洁环境中生长的微生物类群的活性降低,进而导致总活性降低。由于采样时间不同,微生物对不同环境条件的适应能力存在差异,颗粒物对微生物的具体影响还需要更多的研究分析。
一些研究[27,35,37]发现,微生物的浓度与CO、NO2和SO2呈正相关关系,认为这些污染物可以转化为碳、氮、硫元素作为营养物质被微生物吸收利用[35]。本研究微生物活性与CO、NO2、SO2均不存在相关性,与之前有关微生物活性的研究结果相同[17-18],可能由于采样天均为常规晴天,污染物浓度平均值较低(CO、NO2、SO2分别为(0.7±0.4) mg·m-3、(43.9±19.2) μg·m-3、(16.3±15.2) μg·m-3),对微生物影响较小。而2.1~3.3 μm粒径范围内的微生物活性与O3存在正相关性(P<0.05)。一些研究[27,35]表明,O3与生物气溶胶中微生物的浓度呈负相关,O3对微生物具有一定的毒性伤害[38],其强氧性对真菌孢子也具有破坏作用[39]。但也有研究[40]发现,O3与大气中的真菌浓度呈正相关关系,可能是颗粒物上O3发生化学反应导致[41]。由于目前本研究样品数较少,尚不清楚O3对微生物活性的影响作用和机制,还需进行更深入的机理性研究。
3 结论
(1)青岛近海地区在大于7 μm生物气溶胶粒子中微生物活性季节变化显著(P<0.05),表现为夏季最高、春季、秋季次之、冬季最低,而小于7 μm各粒径范围内不存在显著变化(P>0.05)。除5月份,其余月份不同粒径上微生物活性也存在显著差异(P<0.05)。
(2)微生物活性的粒径分布呈现随粒径增加而增大的偏态粒径分布,粗颗粒物中微生物活性水平显著高于细颗粒物,活性最低值出现的粒径范围随月季不同而有所不同。
(3)气团来源对微生物活性水平与粒径分布有一定影响。中部气团来源颗粒物在小于3.3 μm粒径范围内活性水平明显高于北方(P<0.05),而海洋气团来源与其他来源活性差异不明显(P>0.05)。中部气团来源样品中微生物活性的粒径分布与其他两个来源的差别较大。
(4)相关性分析结果表明,研究期间微生物活性与温度在大于4.7 μm粒径范围内存在显著正相关(P<0.01),与O3在2.1~3.3 μm粒径范围内存在显著正相关(P<0.05),与相对湿度、风速、PM2.5、PM10、CO、NO2、SO2等因子无显著相关(P>0.05)。
致谢:感谢中国海洋大学环境科学与工程学院李孟哲师兄在实验与数据分析过程中给予的帮助。
——以丹东市为例

