青春期前双酚A暴露对雌性大鼠生殖器官发育的影响
张莹莹,刘天龙,佘锐萍,田纪景,隋海霞,高 芃,包汇慧
(1.中国农业大学动物医学院,北京海淀100193 ;2. 国家食品安全风险评估中心国家卫生健康委员会食品安全风险评估重点实验室,北京朝阳100021)
双酚A(Bisphenol A,BPA)是一种重要的工业原料,广泛应用于食品接触材料的制造中。BPA是世界已知重要的环境雌激素之一,BPA的化学结构与乙烯雌酚类似,进入体内可模拟雌激素活性,对人体健康有一定风险,引起人们的普遍关注[1]。目前虽然有许多国家禁止BPA用于婴儿奶瓶的生产,但在餐具、玩具及自来水管等材料中仍广泛存在,国内外有大量文献报道在大多数食品中都可检出BPA,特别是动物性食品和罐装食品中[2-3]。流行病学研究表明,BPA暴露人群非常广泛,超过90%的个体尿中可检测到BPA,6~11岁儿童尿中BPA浓度在各年龄组中最高[4]。儿童BPA暴露是一个值得关注的问题,处于发育期的儿童下丘脑-垂体-性腺轴尚未发育成熟,体内性激素水平比较低,此时机体对外源性雌激素反应更敏感,BPA在体内模拟雌激素与受体结合,干扰内分泌信号通路,从而引起生殖系统发育异常。这个时期的儿童可通过多种途径暴露于BPA,特别是通过膳食和饮水暴露[5],可能短期内大剂量或高浓度暴露于BPA,因此青春期前儿童BPA暴露是高危人群。目前关于BPA对生殖系统影响的研究主要集中在其雌激素效应方面,如对雌性实验动物阴道开口时间、动情周期、子宫湿重等方面的影响[5],但对青春期前暴露BPA的雌性生殖器官发育,特别是对青春期前的卵巢和子宫组织结构和形态功能方面的研究较少。本研究以青春期前雌性大鼠为动物模型,从毒性病理学角度观察双酚A短期大剂量暴露对子宫和卵巢形态结构及卵泡发育的影响,为进一步揭示BPA对生殖器官的作用机制提供新思路。
1 材料与方法
1.1 主要仪器与试剂 Tissue-TEK脱水机、包埋机、封片机,均购自日本樱花公司;SHANDON病理切片机,购自英国SHANDON 公司;Leica全自动染色机、Leica光学显微镜及图像采集系统,均购自德国Leica公司;Motic电子图像采集模块和图像分析系统,购自迈克澳迪公司。
双酚A(纯度 99%,CAS NO.80-05-7),购自百灵威;精制橄榄油溶剂(化学纯),购自国药集团;BPA用无水乙醇配制成 5% 母液,经橄榄油稀释后使用;雌激素(E2)ELISA检测试剂盒,购自北京方程生物技术有限公司。
1.2 实验动物 清洁级21日龄雌性Wistar 大鼠40只,体重 50~55 g,由北京维通利华有限公司提供(许可证号:11400700029782),大鼠饲养于中国农业大学动物医学院动物房(许可证号:SYXK-0001)。大鼠自由采食和饮水,室内温度 20~25 ℃,湿度30%~70%,每天光照12 h。
1.3 试验方法 适应性喂养1周后开始试验。称重后随机将40只雌性Wistar大鼠分成4组,对照组给予溶剂橄榄油,BPA试验组给予不同浓度的BPA工作液,由BPA母液溶于橄榄油配制,根据BPA观察到不良作用的最低剂量[LOAEL,60 mg/(kg·bw)],未观察到不良作用水平[NOAEL,5 mg/(kg·bw)][6]及前期预试验结果确定BPA试验剂量,低、中、高剂量分别为20、60 mg/(kg·bw)和180 mg/(kg·bw),每组10只大鼠。为减少灌胃引起的肝首过效应,提高BPA的生物利用率,明确剂量-反应关系,参照BPA生殖毒性研究BPA给予方式[6],于大鼠28日龄开始腹腔注射,试验期间根据体重调整BPA注射量,1次/d,连续7 d至青春期,每天称重。给予BPA 7 d后称重、麻醉后采血处死,迅速取出肝脏、脾脏、子宫和卵巢,称重后用多聚甲醛-戊二醛固定液固定,计算肝脏、脾脏、子宫和卵巢的脏器指数(脏器指数= 脏器湿重(mg)/体重(g))。固定后的组织按常规石蜡切片方法制作4 μm 连续石蜡切片,常规H.E.染色后光镜观察。通过Motic 电子图像采集模块采集切片图像,不同观察视野下输出的图像经过处理后输入计算机,利用图像分析系统软件,对观察视野进行选取、图像处理、图像分析、测量等功能[7]。每只动物随机选取5张卵巢及子宫切片,每张切片随机选取10个视野,在光镜200倍视野下计数卵巢中各级卵泡数量,利用Motic软件测量子宫内膜厚度、子宫外腔直径和子宫腔面积,利用Motic组织病理参数分析软件对测量数据进行半定量分析。取平均值作为每只动物各级卵泡数量、子宫组织结构参数最终数据,用平均值±标准差表示,SPSS 22.0软件进行单因子方差(One-way ANOVA)分析,P<0.05 为差异有统计学意义。
采集的血液样品于 4 ℃冰箱静置 2 h 后,3 000 r/min 离心 20 min,分离后的血清采用ELISA方法进行血清雌二醇(E2)含量测定,具体按照试剂盒说明书操作。
2 结果
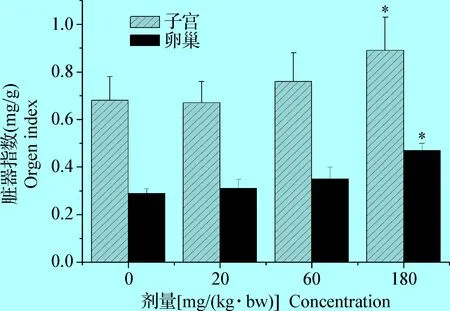
2.1 BPA对青春期前大鼠脏器指数及血清雌二醇的影响 BPA腹腔注射暴露7 d后各组大鼠子宫和卵巢指数以及血清雌二醇含量,见图1和图2。BPA试验组大鼠子宫和卵巢脏器指数均呈升高趋势,其中BPA 180 mg/(kg·bw)组大鼠子宫和卵巢脏器指数与对照组比较,差异有统计学意义(P<0.05);BPA腹腔注射暴露7 d后,BPA试验组血清雌二醇水平呈下降趋势,其中BPA 180 mg/(kg·bw)组大鼠血清雌二醇与对照组比较,差异有统计学意义(P<0.05)。
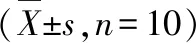
2.2 BPA对青春期前大鼠子宫组织结构的影响 如中插彩版图3所示,光镜观察发现对照组大鼠子宫内膜为排列整齐的单层矮柱状细胞,由内膜表面上皮细胞向固有层深陷形成的子宫腺较少,固有层结构致密,血管丰富; BPA试验组大鼠子宫组织结构发生不同程度变化,主要表现为内膜不同程度增厚,内膜上皮细胞由单层矮柱状上皮细胞变为高柱状上皮细胞,内膜向固有层深陷形成大量皱襞,子宫腺体增多,固有层结构疏松,间质增宽。BPA 180 mg/(kg·bw)组大鼠子宫内膜显著增厚、内膜上皮细胞为多层高柱状、核深染,内膜下颗粒细胞增多,内膜向固有层深陷形成的子宫腺大量增加,功能层厚度增加,固有层基质细胞和血管减少,结构疏松,间质极度增宽。
利用Motic组织病理参数分析系统对各组大鼠的子宫内膜厚度、子宫外腔直径及内腔面积进行测量分析。结果见表1,发现与对照组比较,BPA试验组大鼠子宫内膜厚度、子宫外腔直径和内腔面积均增高;BPA 180 mg/(kg·bw)组大鼠子宫内膜厚度和外腔直径与对照组比较,差异有统计学意义(P<0.05), BPA 180 mg/(kg·bw)组大鼠子宫内腔面积与对照组比较,差异有统计学意义(P<0.01)。
2.3 BPA对青春期前大鼠卵巢组织结构的影响 如中插彩版图4所示,切片观察发现对照组大鼠卵巢结构完整,皮质、髓质结构清晰;皮质内可见发育初期的卵泡,分布于皮质浅部的原始卵泡数量较多,皮质结缔组织致密;髓质结缔组织较疏松,髓质内可见少量血管。BPA试验组与对照组比较,皮质浅部的原始卵泡随剂量增加而数量减少,初级卵泡、次级卵泡数量增多;皮质、髓质结缔组织疏松,血管扩张; BPA 180 mg/(kg·bw)组大鼠皮质浅部仅见个别原始卵泡,皮质和髓质内可见大量初级卵泡和次级卵泡,皮质和髓质结缔组织疏松,血管扩张充血。
利用Motic组织病理参数分析系统对各组大鼠卵巢中初级卵泡、次级卵泡、成熟卵泡及卵泡总数进行半定量分析。结果见图5,发现与对照组比较,BPA试验组各级卵泡数量增加,其中BPA 60 mg/(kg·bw)组大鼠卵巢中初级卵泡及BPA 180 mg/(kg·bw)组大鼠卵巢中次级卵泡、卵泡总数显著增多,差异有统计学意义(P<0.05)。
3 讨论
双酚A是在生活中经常接触到的环境雌激素,经常作为食品和饮料包装材料、金属罐内涂层等食品接触材料,进而由食物链进入生物体内并与雌激素受体相互作用,干扰正常激素在体内的产生、释放、运输、代谢等作用,从而影响生物的生殖功能[8]。研究表明,BPA对雄性小鼠生精细胞造成损伤、生殖细胞变性,BPA还可能通过破坏支持细胞骨架和改变支持细胞形态而损害雄性生殖功能[9];BPA与17-β-雌二醇类似,诱导雄性产生卵黄蛋白原从而发挥雌激素作用[9]。BPA对雌性生殖系统的影响主要表现为动情周期不规律、性行为异常、卵巢萎缩、受孕率下降、生殖道发病率增加等[9],BPA加了体内雌激素实际负荷量,加剧了子宫、卵巢、乳房等激素敏感器官病变的可能性,BPA可通过模拟雌激素作用,刺激子宫内膜上皮细胞和基质增生,增加子宫腺体数目,从而影响雌性生殖器官发育[10];研究显示,40.9% 的性早熟女童血清中检测出BPA,而正常女童仅 2% 检出,同时发现血清BPA含量与子宫体积、卵巢体积呈正相关[10]。双酚A在成年生物肝脏代谢酶的催化下可生成水溶性的葡萄糖醛酸-双酚A而失去生物学活性[11],但是幼龄生物体内葡萄糖醛酸代谢酶系发育还不完善,因此幼龄生物暴露双酚A后,血液中双酚A的浓度高于成年生物,所以对幼龄生物BPA暴露的研究更具有现实意义[12]。
表1 BPA 暴露7 d青春期前大鼠子宫内膜厚度、外腔直径及内腔面积的影响Tabel 1 Effects of 7-day BPA exposure on endometrial thickness, external cavity diameter,and internal cavity area in adolescent rats
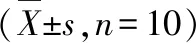
剂量组Group子宫内膜厚度/μmEndometrial thickness子宫外腔直径/μmExternal diameter of uterus子宫内腔面积/mm2Intrauterine cavity area0 mg/(kg·bw)234.77±24.58951.06±125.6569.46±15.4520 mg/(kg·bw)263.75±35.651 053.11±145.36118.86±25.4760 mg/(kg·bw)286.15±25.861 074.72±184.25118.35±25.14180 mg/(kg·bw)322.25±45.24∗1 599.85±178.54∗183.53±23.55∗∗
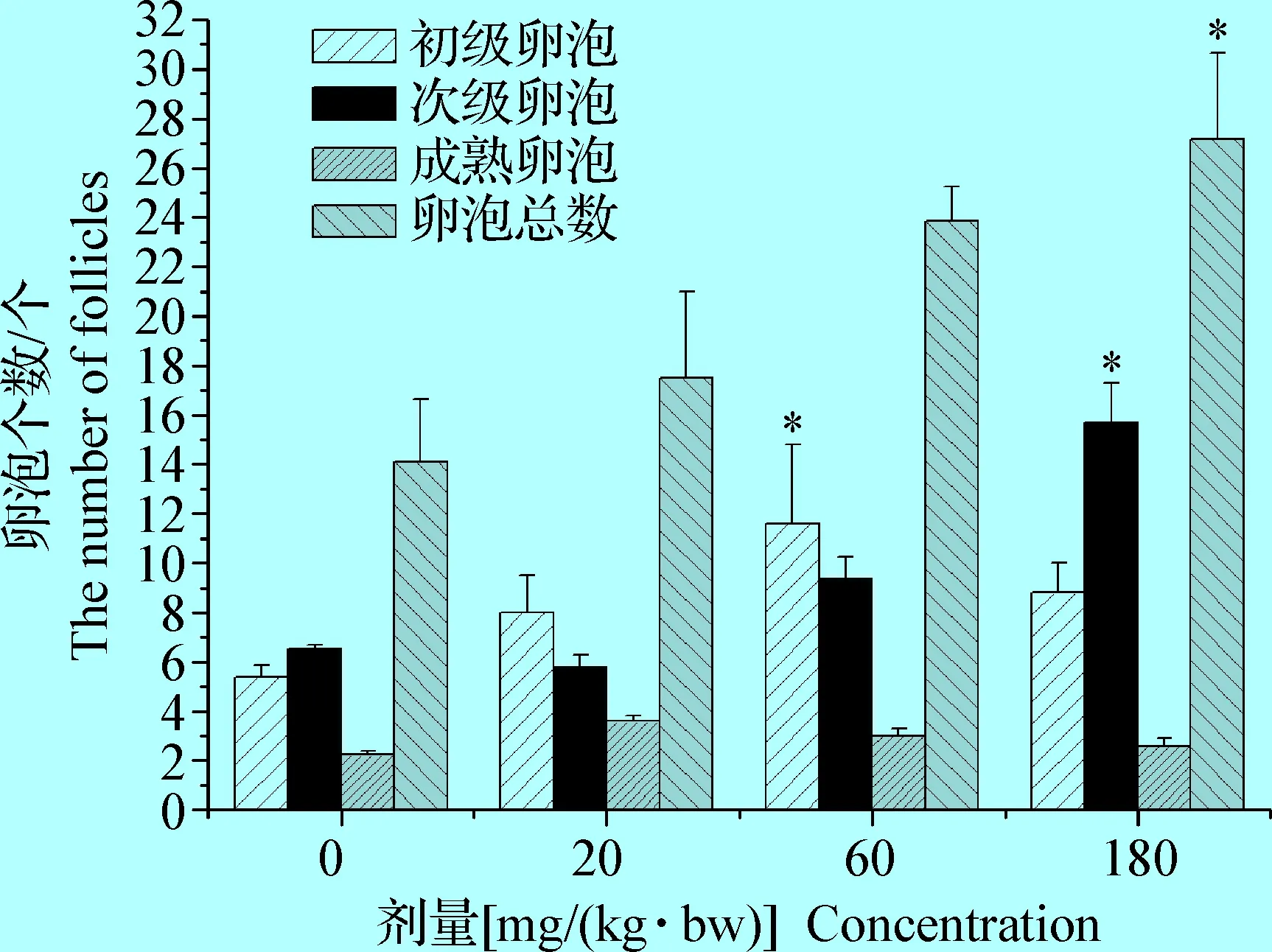
本试验从毒性病理学角度观察BPA暴露对雌性生殖器官组织结构和形态的影响,结合血清雌激素水平和临床指标,观察BPA对幼年雌性生殖器官结构和形态功能影响机制。卵巢和子宫解剖结构、血清雌激素水平是雌性生殖发育的重要指标,子宫内膜厚度、子宫腔面积和外径是衡量子宫发育的重要指标,各级卵泡数量是卵巢发育和功能的重要指征[13]。病理观察结果发现,随着BPA剂量的增加,青春期前大鼠子宫内膜厚度、子宫腺数量均呈上升趋势,子宫内面积逐渐增大,子宫指数增加,表明青春期前短期暴露可以显著促进雌性大鼠生殖器官发育,提示BPA暴露可能会使实验动物青春期提前。王慧等[14]研究发现,BPA可使子宫系数增加,使子宫腺体及腺管结构发生改变,与本研究结果一致。另外,本试验病理观察发现,BPA短期暴露会引起青春期前大鼠卵巢指数升高,卵巢原始卵泡数量减少,其他各级卵泡数量增加,未观察到明显的卵泡闭锁现象,提示BPA暴露可能会使雌性大鼠卵巢提前发育,而李昱辰等[15]研究发现,BPA能够使未成年大鼠子宫湿重及脏器系数降低,卵巢原始/初级卵泡比例减少,闭锁卵泡比例增加,这可能与实验动物在青春期前、青春期BPA暴露及染毒剂量不同等因素有关。青春期前BPA暴露可能使大鼠提前进入青春期,但在青春期的BPA暴露,由于存在与内源性雌激素竞争受体结合,从而影响青春期雌激素对生殖器官发育的促进作用,从而呈现出假性成熟。
另外,本试验发现青春期前大鼠BPA高剂量暴露可引起血清雌二醇水平显著降低,这可能与外源性环境雌激素引起下丘脑-垂体-性腺轴(HPG)的负反馈机制有关。一定浓度条件下,BPA与垂体和下丘脑的雌激素受体结合,从而阻止内源性雌二醇与受体结合,这种结合可能会替代雌二醇对垂体和下丘脑的反馈调节,引起雌激素介导的下丘脑促性腺激素释放激素(GnRH)和垂体促性腺激素的合成和改变,进而影响血清性激素水平[16]。Kovanecz等[17]
研究发现,长期给予大鼠低剂量的BPA体重虽然没有变化,但血清雌激素水平下降。Ferguson等[17]研究认为,高剂量BPA可使大鼠HPG轴发育不全,导致生殖系统无法正常发育,促性腺激素合成下降。Heum等[18]认为,BPA通过雌激素样效应干扰机体正常的青春期发育是由抑制下丘脑中雌激素活性,破坏GnRH脉冲发生器正常功能,从而使雌激素正常分泌受损。Brannick等[19]认为,BPA可能通过性腺、类固醇代谢、转运蛋白或受体途径干扰HPG负反馈机制,进而影响青春期发育。本研究观察到的血清中雌激素水平下降与HPG负反馈机制的关系尚需进一步研究证实。

