犬冠状病毒的进化和致病性研究进展
刘玉秀,黄柏成,习向锋,田克恭
(国家兽用药品工程技术研究中心,河南洛阳471000)
长期以来,人冠状病毒(Human Coronavirus,HCoV)因仅在健康人群中引起轻度症状而一直未被重视。直到2003年严重急性呼吸综合征(Severe acute respiratory syndrome,SARS)疫情的暴发[1],其病原SARS冠状病毒(SARS-CoV)高传播力和高致死率,才引起人类对动物冠状病毒作为直接和间接人兽共患病潜在病原的兴趣。2019年底,由SARS-CoV-2感染暴发的新冠肺炎(COVID-19)[2]在全球广泛流行并造成巨大损失。由于冠状病毒基因组的易突变性,所形成的新型病毒可能在增强病毒致病力和强流行性中起到重要作用。冠状病毒基因组的易突变性也造成犬冠状病毒(Canine coronavirus,CCoV)新毒株的出现。近年来,犬群中出现与经典犬冠状病毒(CCoV)具有不同生物学和遗传学特性的毒株,对犬类疾病鉴别诊断及防控造成了极大挑战。本文对近年来CCoV在基因演变、组织嗜性变化上的发展进行了综述,并对CCoV疫苗保护效果不足的临床应用现状进行了讨论,以期为新型冠状病毒防控及疫苗开发提供一些借鉴。
1 冠状病毒分类与基因组组成
冠状病毒(Coronaviruses,CoV)属于单股正链RNA病毒,可在哺乳动物和鸟类中引起支气管炎、胃肠炎、肝炎、传染性腹膜炎和脑炎等多种疾病。冠状病毒科(Coronaviridae)分为α、β、γ和δ四个属[3]。α属包括8个种,即α冠状病毒1、人冠状病毒229E、人冠状病毒NL63、长翼蝠冠状病毒HKU1、菊头蝠冠状病毒HKU2和猪流行性腹泻病毒等。其中犬冠状病毒(Canine coronavirus,CCoV)、猫冠状病毒(Feline coronavirus,FCoV)和猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)是α冠状病毒1的成员;β属包括7个种,即β冠状病毒1、人冠状病毒HKU1、小鼠肝炎病毒(Mouse hepatitis virus,MHV)、家蝠冠状病毒HKU5、果蝠冠状病毒HKU9、SARS-CoV、MERS-CoV和SARS-CoV-2等。其中犬呼吸道冠状病毒(Canine respiratory coronavirus,CRCoV)和牛冠状病毒(Bovine coronavirus,BCoV)、人冠状病毒OC43、马冠状病毒(ECoV)和猪血凝性脑脊髓炎病毒(Porcine hemagglutinating encephalomyelitis virus,PHEV)同属于β冠状病毒1成员;δ属包括7个种,多为鸟类和禽类冠状病毒如赤颈鸭冠状病毒HKU20,γ属包括白鲸冠状病毒和鸡传染性支气管炎(Avian infectious bronchitis virus,IBV)等[3]。2019年底,引起全球流行新冠肺炎(2019-nCoV)的SARS-CoV-2为β冠状病毒属,S基因同源性进化结果显示,其与α冠状病毒属的CCoV和FCoV的核苷酸和氨基酸同源性分别为44.2%~46.4%和22.5%~24%;与同是β冠状病毒属的犬呼吸道冠状病毒CRCoV的核苷酸和氨基酸同源性为45.3%和28.8%。SARS-CoV-2与先前描述的任何动物冠状病毒都没有密切关系,如图1所示。
CoV的基因组约27~32 kb,含7~11个开放阅读框(ORF)编码结构蛋白和非结构蛋白。基因1由2个部分重叠的ORF1a和ORF1b组成,翻译病毒复制酶(Rep)前体蛋白。复制酶基因下游的4~5种基因ORF(5’-Rep-S-E-M-N-3’)或(5’-Rep-HE-S-E-M-N-3’)编码结构蛋白[5],分别是棘突蛋白S(Spike protein)、核衣壳蛋白N(Nucleocapsid protein)、膜蛋白M(Mermbrane protein)、小膜蛋白E(Small membrane protein)和血凝素酯酶HE(Hemagglutinin esterase)。
成熟的S蛋白具有多种生物学功能,包括与宿主受体结合、诱导病毒包膜与细胞膜融合、诱导机体产生中和抗体、与病毒毒力强弱密切相关,其还影响某些冠状病毒的血凝性,如PHEV和IBV等具有血凝特性[5]。M蛋白是横跨于病毒囊膜上的糖蛋白,主要负责病毒颗粒的组装[5]。M蛋白糖基化序列高度保守,其糖链主要由N-(主要是α-和γ-CoV)或O-(主要是β-CoV)方式连接到膜蛋白上[2,5],M蛋白能诱导机体产生干扰素[6]。E蛋白是一种在CoV中含量很少的小包膜蛋白,与M蛋白共表达形成E-M蛋白复合体,产生病毒样粒子,E蛋白缺失可导致病毒粒子的复制量大大减少,病毒最终形态的形成与E蛋白密切相关[6]。HE蛋白主要存在于β冠状病毒(如PHEV、CRCoV和MHV),也见于γ冠状病毒禽冠状病毒中,而SARS-CoV是β冠状病毒典型的非HE病毒[7]。HE蛋白介导病毒与细胞膜最初的吸附。HE蛋白具有乙肽脂酶活性,能在乙肽化的神经氨酸上切割乙肽基团,防止或逆转S蛋白或HE引起的凝血或血细胞吸附效应[8]。HE蛋白对于病毒复制非必需,在β冠状病毒中高度变异,在连续病毒传代过程中频繁发生突变和缺失,它的存在与否可改变病毒在动物体内的致病性[8]。
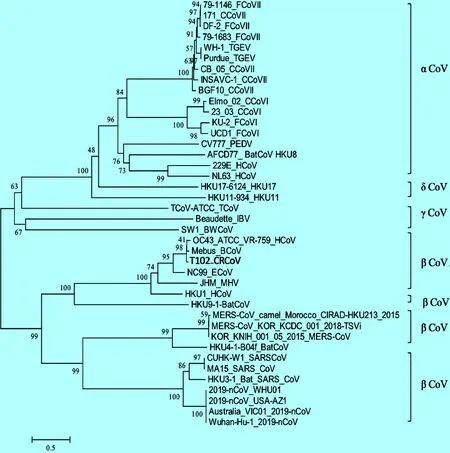
图1 SARS-CoV-2与犬猫不同基因型冠状病毒遗传进化关系
2 犬肠道型冠状病毒
1971年Binn等首次在急性肠炎犬中分离到CCoV[9]。CCoV感染常局限于消化道,引起轻度或重度胃肠炎,以高发病率和低死亡率为特征。CCoV有2种基因型:CCoV-I和CCoV-II,2种基因型S基因相似率54%[10],通过扩增基因组ORF2和ORF5片段即可鉴别[11]。此外,CCoV-I型基因组含有独特的ORF3(624 nt),该基因片段在CCoV-II和与其相关的FCoV-1和TGEV的基因组中仅有少量残留[12]。CCoV-II存在2种亚型,CCoV IIa和CCoV IIb,前者为经典的CCoVs毒株,后者是CCoV II和TGEV重组的TGEV样毒株,在犬群中广泛存在[13]。与其他CoV类似,CCoV基因很容易突变,过去十几年出现多株具有潜在强毒力和基因差异的新CCoV毒株;澳大利亚流行的可导致急性致死性胃肠炎的CCoV II型毒株(UWSMN-1株)的ORF1b、S基因和5′端与经典CCoV II毒株相似率分别为96.1%、86.1%和93.0%;系统进化显示,UWSMN-1株有别于经典CCoV和FCoV,单独形成一个分支,表明突变是在其整个病毒基因组中逐渐积累而成,不是CCoV和FCoV之间的重组产物[14]。2004年英国暴发了由CCoV II型高致病性毒株引起的疫情,流行株的基因组存在一个超长的编码非结构蛋白基因3b(250aa)和高度分化M基因[15];在意大利腹泻犬中检测到几种CCoV在M基因出现点突变,有向FCoV I型的遗传漂移的趋势,其S蛋白序列与FCoV相似性达81%[16]。
3 泛嗜性犬冠状病毒
2005年,意大利病死犬的脑组织中分离的CCoV II型变种(CB/05株)可引起感染犬严重系统性疾病[17],包括发热(39.5~40.8 ℃)、嗜睡、消化道症状(呕吐、腹泻)、严重白细胞减少和神经症状(共济失调和惊厥),发病后2 d内死亡。肺、肝、肾和脾有严重病变,在肺、脾、肝、肾和脑组织中均检测到CCoV II型RNA;此后2008-2009年在法国、比利时和希腊均有泛嗜性CCoV引起严重致死性疾病流行。研究显示,CB/05株与肠道型CCoV-II在ORF2氨基酸序列高度相似,S蛋白与FCoV II毒株79-1683株相似性最高,但CB/05株在ORF3b有1个38 nt基因缺失标记,是泛嗜性CCoV遗传标记[18],目前该病毒泛嗜性相关遗传变化尚待确定。脑组织中分离的CB/05株有力地表明,CCoV可改变原有的组织感染嗜性,获得了从肠道传播至其他内脏的能力[19]。泛嗜性CCoV是否因基因的变化变成可识别其他受体还未知,期望可建立反向遗传系统来研究病毒毒力和组织感染嗜性变化等相关研究。
4 犬呼吸道冠状病毒
2003年出现人SARS-CoV后,加强了犬群中冠状病毒流行病学调研。同年,英国从患地方性呼吸道疾病犬中分离1株CoV[18],轻度上呼吸道症状犬中该毒株感染率较高,被称为犬呼吸道冠状病毒(CRCoV)。CRCoV的复制酶基因和S基因与BCoV遗传关系密切。T101株CRCoV的S基因与BCoV和HCoV-OC43株S基因相似率分别为97.3%和96.9%,提示3种病毒有相近的共同祖先,并在不同宿主生物中重复转移[20-21]。BCoV经典毒株可感染幼犬,这为CRCoV来源于牛源病毒提供了佐证[22]。基因水平显示CRCoV与CCoV无关,其S基因与肠道CCoV同源性仅21.2%[18]。
CRCoV在主要结构蛋白和非结构蛋白中与BCoV亚群遗传关系密切。BCoV基因组S基因和E基因中间有3个不同的ORF,分别编码4.9、4.8 kDa和12.7 kDa的非结构蛋白,而CRCoV基因组在该区域由于2 nt的缺失引起对应BCoV基因组编码4.9 kDa非结构蛋白的终止密码子缺失而导致形成8.8 kDa联合蛋白的翻译,导致只含有2个ORF分别编码8.8 kDa和12.8 kDa的非结构蛋白[23]。与肠道CCoV I和CCoV II型不同,单纯的CRCoV仅引起犬轻微呼吸道症状,但CRCoV在呼吸道上皮细胞中的复制可能损害黏液纤毛系统,导致由其他呼吸道病原体感染引起更严重的临床过程。
5 犬冠状病毒感染的防控
CCoV具有高传染性,一旦暴发传播就难以控制,感染犬可连续排毒6个月[17]。CCoV灭活疫苗(Duramune P C, Fort Dodge)是CoV中为数不多获得生产许可的疫苗。该CCoV灭活疫苗皮下免疫后免疫保护欠佳,虽能诱导机体产生较高水平抗体,攻毒后没有明显保护作用[24-25],不能有效减少感染后排毒,不能有效阻断病毒传播。经口鼻免疫减毒活疫苗也不能对疾病和感染产生完全保护[26];在血清水平,CCoV I型和CCoV II型之间交叉反应性较差[27],即使是减毒活疫苗也不能预防CCoV I型攻毒后的感染。
此外,新型肠道CCoV基因型和泛嗜性CCoV病理类型的出现,对肠道CCoV疫苗的保护效力提出新的挑战。泛嗜性CCoV的CB/05毒株具有明显淋巴嗜性,犬感染1周后T淋巴细胞大量消耗,CD8+细胞和B淋巴细胞在感染后第7天恢复至正常水平,外周血CD4+T淋巴细胞长期消耗可能影响体液免疫和细胞免疫,从而损害有效免疫应答的产生和维持能力[28],严重损害犬对并发病原或疫苗抗原的免疫反应。犬舍和动物收容所的幼犬暴露于多种病原中,同时感染泛嗜性CCoV可能会加剧其他病毒的临床进程,从而导致幼犬迅速死亡。其次,CCoV灭活疫苗推荐的首免时间是40~60日龄,也是CCoV感染几率最高的时机。
目前,所有商品化肠道CCoV灭活疫苗不能保护幼犬来自泛嗜性CCoV的攻毒,免疫犬感染泛嗜性CCoV会出现亚临床症状,导致淋巴细胞减少,这可能是机会性病原体和由“真”病原体(CDV、CAV和CPV等)诱发更严重疾病的一个易感因素,且犬在康复后6个月还能检测到排毒[18]。至于能否抵抗CRCoV感染尚不明确。CCoV灭活疫苗产生的免疫效力和持续时间尚未得到证实。减毒活疫苗接种后有较高频率的副反应,人们对CCoV疫苗在田间试验提供的免疫保护力存在较大争议。
6 展望
基因组点突变积累及插入或缺失都是导致RNA病毒微进化的主导力量,导致病毒株、血清型和基因亚型的增多[4]。几十年来,CCoV通过某些区域基因的点突变和积累而不是基因重组经历了一次次遗传进化。ORFs2群体特异基因的变化被认为是CCoV II型毒力增强的原因[16]。S基因点突变也被认为与泛嗜性CCoV的发生有关[18]。CRCoV可能是1株BCoV的宿主从牛到犬的变种[18, 20]。因此,在HCoV(如SARS-CoV和SARS-CoV-2)的研究中,我们要研究CoV的非人类宿主来源,更需要关注是哪些基因的突变累积或插入或缺失使新型CoV的致病力和传染性增强?
CCoV在长期的毒株进化演变过程中,突变出致病力更强,对宿主组织嗜性更广泛的犬泛嗜性CCoV,引起感染犬短时间淋巴细胞大量消耗,增加了感染其他致死性病原的风险,造成不可逆转全身性疾病;泛嗜性CCoV的出现,对CCoV感染的防控提出新的挑战,也是对HCoV进化的重要提示,HCoV由原来仅引起人普通感冒的毒株,进化演变成严重下呼吸道、肺炎的严重疾病,是否也存在人冠状病毒某些突变导致可识别新的受体引起?
犬冠状病疫苗田间试验免疫接种的益处未达预期,CCoV I型和CCoV II型交叉保护性低。新基因型CCoV、泛嗜性CCoV及呼吸道CRCoV的出现,使肠道CCoV灭活疫苗接种后不能有效抵抗野毒感染。此外,CCoV疫苗不能有效降低感染后排毒和阻断病毒传播。期望人新型CoV疫苗的研发过程中,要规避犬冠状疫苗的缺陷,真正起到预防控制疾病作用。
我们还需要进一步研究来揭示导致CoV病理生物学改变的分子机制,为理解CoV致病性和免疫机理提供新的见解。同时,持续的流行病学监测将有助于发现具有不同遗传生物学特性的毒株,为深入了解动物CoV的致病机制提供科学依据。

