肺鳞癌结肠转移伴直肠原发腺癌1例及文献复习
程芳,米玉玲,王宏羽
1北京市朝阳区三环肿瘤医院肺癌中心,北京100122
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京100021
原发性肺癌的消化道转移不常见,文献报道多为个案病例报道,临床发生率为0.30%~1.77%[1]。1996年日本肿瘤中心研究了1635例原发性肺癌患者,发现胃肠道转移30例,总发生率约为1.8%[2]。原发性肺癌的胃肠道转移为血行转移,其发生往往提示疾病晚期且预后不佳。一项回顾性研究显示,肺癌消化道转移患者的中位生存期约为66天[3]。本文结合相关文献对1例肺鳞癌结肠转移伴直肠原发腺癌患者的临床资料进行分析和探讨,现报道如下。
1 病历资料
患者男,67岁,因“右肺下叶鳞状细胞癌切除术,胸部放疗后18年,肿瘤进展5个月”入院。该患者2000年10月初因间断性咳嗽半年,胸闷3周行胸部计算机断层扫描(CT)发现右肺下叶肿物,支气管镜细胞学提示右下肺叶背段高分化鳞状细胞癌。2000年10月30日行右肺下叶根治性切除术,术中可见肿瘤大小约8.0 cm×8.0 cm×7.5 cm,术后病理提示右肺下叶高分化鳞状细胞癌,肿瘤侵犯叶支气管及部分胸膜,累及肺内静脉,伴大片坏死及癌旁纤维组织增生和炎症细胞浸润,叶支气管切缘未见肿瘤;淋巴结转移性鳞状细胞癌4/31(肺内淋巴结3/5,下段食管旁淋巴结1/1)。2000年11—12月行纵隔及肺门放疗,58 Gy/29 f/40 d。然后定期复查,均未见肿瘤复发及进展。2018年10月因咳嗽性哮喘进一步检查颈胸腹部CT:门腔间隙、腹膜后淋巴结增大;颈深链及右侧颈后三角淋巴结。2019年2月22日行全身正电子发射断层成像(positron emission tomography,PET)‐CT检查:支气管断端复发,邻近胸膜多处转移,邻近肋骨受累;左颈上深、右颈中下深、锁骨上、右腋窝、右膈脚后、腹腔、腹膜后淋巴结转移;直肠下段肠壁增厚,考虑恶性病变(直肠癌可能);结直肠多处代谢增高,部分肠壁略厚,建议镜检;直肠周围脂肪间隙、骶前间隙、左侧盆壁多发淋巴结转移。肠镜:直肠环周溃疡隆起病变(距肛门缘2~8 cm),肿瘤可能;结肠多发隆起,腺瘤可能;降结肠、乙状结肠隆起伴溃疡病变,恶性不除外;乙状结肠距肛门20 cm处黏膜散在大片充血水肿,溃疡性结肠炎活动不除外;结肠黑便病。分别行右侧锁骨上淋巴结穿刺活检及肠镜活检。右侧锁骨上淋巴结穿刺活检病理:鳞状细胞癌,结合病史提示转移。肠镜病理:直肠活检提示中分化腺癌;降结肠38 cm处及乙状结肠20 cm处活检提示分化差的肿瘤,免疫组化支持为鳞状细胞癌,考虑为转移性。2019年3月20日至6月初行帕博利珠单抗+注射用紫杉醇(白蛋白结合型)+卡铂21天方案治疗4个周期,治疗期间出现1级骨髓抑制和1级胃肠道反应。治疗后咳嗽、咳白痰有所改善,大便不成形改善不明显,仍每日解不成形稀软便3~4次,疗效评价为疾病稳定,2个周期后颈部、锁骨上淋巴结及胸膜转移瘤略有缩小,残端肿物、腹腔和腹膜后淋巴结、结肠转移瘤及直肠肿物稳定;4个周期后颈部、锁骨上淋巴结较前缩小,直肠壁增厚较前减轻,腹腔及腹膜后淋巴结较前缩小,残端肿物、胸膜转移瘤及结肠转移瘤稳定(图1)。患者治疗前及治疗后一般状况良好,美国东部肿瘤协作组(Eastern Co‐operative Oncology Group,ECOG)体能状态评分为0分,精神和饮食状况良好,睡眠可,小便正常,大便不成形,每日解稀软便3~4次,无基础疾病,体重无减轻。既往吸烟20年,已戒;社交性饮酒。目前诊断:P右肺下叶鳞状细胞癌、P直肠中分化腺癌、右肺下叶切除术后、胸部放疗后、残端肿瘤复发、锁骨上及颈部淋巴结转移、胸膜转移、腋窝淋巴结转移、腹腔及腹膜后淋巴结转移、结肠转移、盆腔淋巴结转移、盆壁淋巴结转移、化疗4个周期后。
2 临床特点
全身多发淋巴结转移,直肠下段肠壁增厚,经病理证实为肺鳞癌结肠转移及直肠腺癌双原发。淋巴结转移途径:颈部、锁骨上及腋窝淋巴结转移考虑肺转移,锁骨上淋巴结转移已经病理证实;直肠癌系第二原发癌,腹膜后、腹腔及盆腔多发淋巴结转移,考虑直肠癌转移可能性大。
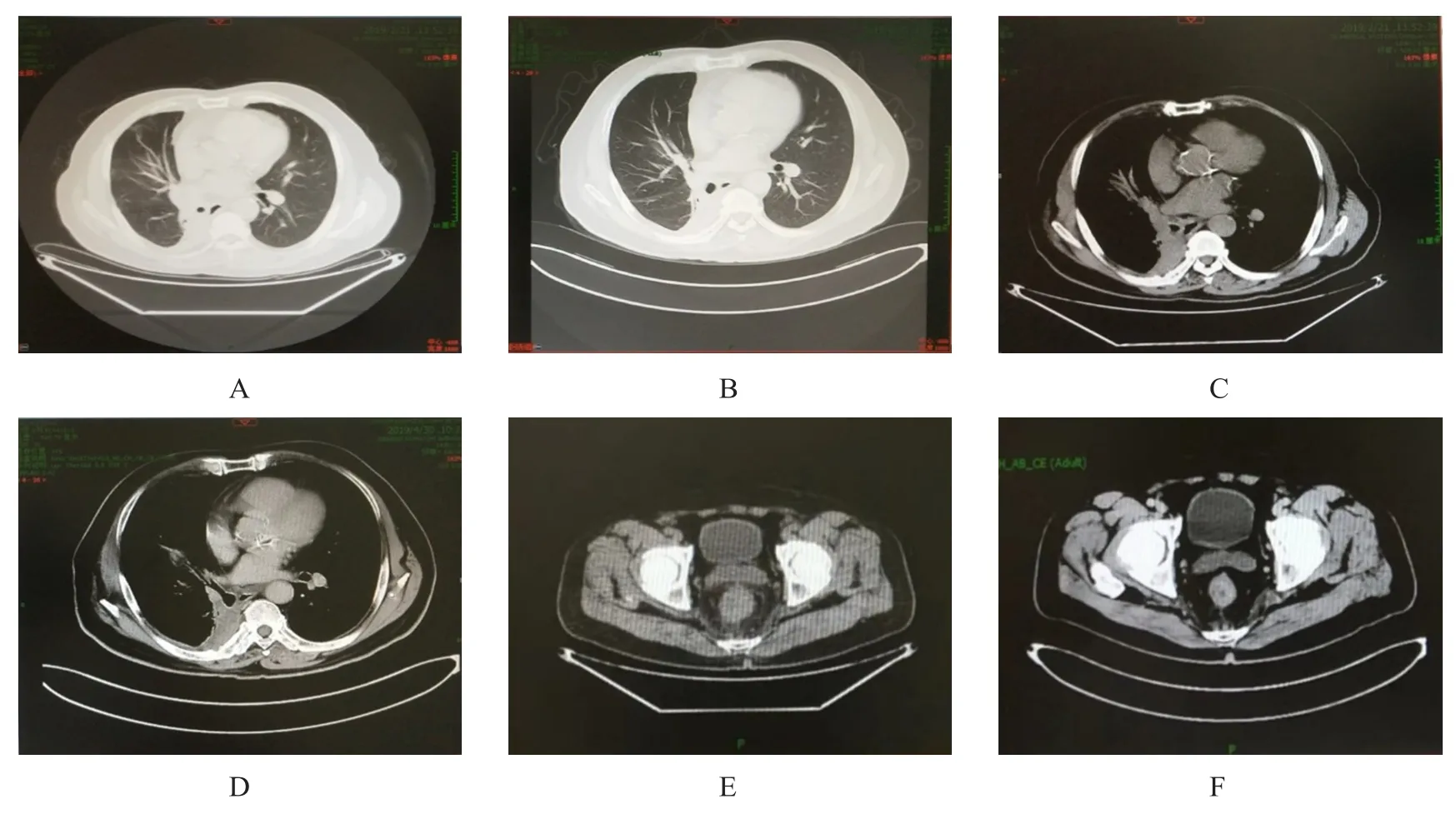
图1 肺鳞癌结肠转移伴直肠原发腺癌患者治疗前后的CT图像
3 讨论
中国绝大多数肺鳞癌患者的表皮生长因子受体(epidermal growth factor receptor,EGFR)/间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因突变为阴性[4],肺鳞癌的治疗手段非常有限,生存预后不理想。CheckMate 063是一项Ⅱ期、单臂、多国家、多中心研究,旨在评估纳武单抗(Nivolumab)在既往治疗过的晚期难治性鳞状非小细胞肺癌患者中的安全性和抗肿瘤活性。结果显示,治疗后患者的客观缓解率为14.5%(17/117),中位疾病进展时间为3.3个月,17%的患者出现3~4级不良反应,包括乏力(4%)、肺炎(3%)和腹泻(3%)。该研究提示Nivolumab对复发难治性肺鳞癌患者具有一定的疗效,且不良反应可耐受。约1/4的患者疾病稳定,最长可达10.91个月,证实了Nivolumab在难治性鳞状非小细胞肺癌患者中的临床有效性[5]。CheckMate 017是针对一线治疗失败的晚期肺鳞癌患者开展的一项随机对照Ⅲ期临床试验,共纳入272例一线化疗期间或之后疾病进展的晚期肺鳞癌患者,对比Nivolumab与多西他赛的疗效和安全性,该试验奠定了二线治疗肺鳞癌患者的新标准。Nivolumab和多西他赛治疗后患者的客观缓解率分别为20%和9%(P=0.008);总生存期分别为9.2个月和6.0个月(HR=0.59,95% CI:0.44~0.79);中位无进展生存期分别为3.5个月和2.8个月(HR=0.62,95% CI:0.47~0.81)。该研究的3年总生存期数据显示,肺鳞癌患者应该尽早接受Nivolumab治疗以获得长期生存。基于上述研究中Nivolumab的良好疗效和可耐受的不良反应,美国食品药品管理局(Food and Drug Administration,FDA)批准Nivolumab用于既往治疗后疾病进展的局部晚期或转移性肺鳞癌患者[6‐7]。美国综合癌症网络(National Comprehensive Cancer Network,NCCN)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)及美国临床肿瘤学会(Ameri‐can Society of Clinical Oncology,ASCO)一致推荐Nivolumab作为肺鳞癌患者二线治疗的首选方案之一[8‐10]。KEYNOTE‐407 是一项随机、双盲Ⅲ期临床研究,共入组559例初治转移性肺鳞癌患者,结果显示,与安慰剂联合化疗组相比,Keytruda(200 mg,q3w)联合卡铂/紫杉醇或白蛋白结合型紫杉醇可以显著延长患者的总生存期(15.9个月vs11.3个月,HR=0.64,P=0.001),其生存获益与程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD‐L1)的表达水平无关,Keytruda联合化疗组患者的中位无进展生存期也明显长于安慰剂联合化疗组(6.4个月vs4.8个月,HR=0.56,P<0.01),两组患者的客观缓解率分别为57.9%和38.4%;不良反应方面:Keytruda联合化疗组患者3级或以上不良反应的发生率为69.8%,而安慰剂联合化疗组为68.2%。这项关于晚期肺鳞癌的研究提示,在标准一线含铂双药化疗的基础上加用Keytruda可以使患者的总生存期延长4.6个月,无进展生存期延长1.6个月,达到了研究的主要终点[11]。
本研究中的患者治疗时依据CheckMate 063、CheckMate 017、KEYNOTE‐407等研究,方案选择时考虑与直肠原发腺癌相比,肺鳞癌肿瘤负荷大,优先选择以肺鳞癌为主的一线治疗,治疗方案选择了免疫治疗联合化疗,治疗期间耐受性良好,全身肿瘤稳定。该患者确诊为肺鳞癌结肠转移,同时直肠腺癌第2原发至今,生存时间近4个月,肿瘤稳定,后续需继续治疗,并密切随诊及观察,必要时可行直肠癌外科姑息手术治疗或局部放疗。

