迟播对冬小麦灌浆后期高温胁迫下旗叶光合能力和产量的影响
费立伟,初金鹏,郑飞娜,孙立臣,代兴龙,贺明荣
(山东农业大学农学院/作物生物学国家重点实验室/农业部作物生理生态与耕作重点实验室, 山东泰安271018)
小麦是我国重要的粮食作物,在保障我国国家粮食安全中占有举足轻重的地位。黄淮麦区是我国的小麦主产区之一,但该地区小麦灌浆后期易遭受高温影响,进而导致叶片早衰、青枯,籽粒灌浆受到抑制,粒重降低[1-4]。因此,增强灌浆后期小麦的抗高温能力,对于提高区域小麦产量,确保国家粮食安全,具有重要的意义。
光合作用是对高温胁迫最为敏感的生理过程[5]。光合作用的降低会影响小麦的生长和籽粒产量[6-7]。关于高温对于作物光合作用的影响研究报道较多。研究表明,高温胁迫通过引起叶绿体结构和功能的紊乱、叶绿素含量的降低影响光合作用[4,8-9]。高温胁迫对于作物PSⅡ的影响较大,尤其是受体侧转运[10-11]。类囊体膜是植物进行光合作用的关键光合膜,因此高温下的损伤会对光合作用造成较大的影响[12-13]。高温胁迫也会导致叶片抗氧化酶活性的降低[13-16]。谷类作物的产量形成主要依赖开花后的光合作用,小麦旗叶是花后最重要的光合器官[10-12],此时的高温胁迫会造成作物大幅度减产[4]。推迟小麦播期可在提高茎秆抗倒伏能力[20]的同时,优化群体、个体、叶片和细胞水平上氮素的分配,增大旗叶最大羧化速率,增强二氧化碳扩散能力,从而提高旗叶光合能力和冠层光合氮素利用率[21-22]。目前关于高温胁迫和推迟播期单因素的影响研究较多,而关于推迟播期条件对冬小麦灌浆后期高温胁迫下旗叶光合系统是否具有调控效应未见报道。因此,本研究设置两个播期,采用开放式大田增温的方法,分析了推迟播期对冬小麦灌浆后期高温胁迫条件下旗叶光合能力、抗氧化酶活性、类囊体膜脂组分含量变化以及粒重和产量的影响,以期为冬小麦抗逆高产稳产栽培提供理论依据。
1 材料与方法
1.1 试验材料与设计
试验于2017-2018年在山东省泰安市山东农业大学农学实验站进行。试验地土壤类型为壤土,播前0~20 cm土层有机质、全氮、速效磷、速效钾含量分别为13.16 g·kg-1、0.81 g·kg-1、25.61 mg·kg-1、103.01 mg·kg-1。播前基施纯氮120 kg·hm-2、P2O5120 kg·hm-2和K2O 120 kg·hm-2,拔节期追施纯氮 120 kg·hm-2。
试验采用大穗型品种泰农18为供试材料,种植密度为225万株·hm-2。设置10月8日(常规播期)和10月22日(推迟播期)2个播期。记录各播期下的开花时间,且均以开花时间为起点,于花后21 d开始进行高温胁迫,持续时间3 d。小区完全随机排列,三次重复,小区面积为3 m2。
高温处理采用开放式大田增温方式:借助工业用大功率暖风机(20 kW),由自带风扇输送出的热风依次到达总输风带、小麦行间的支风带,热风由支风带上大小分布均匀的风口扩散到田间,从而达到均匀增温的效果。高温胁迫时间为 10:00-16:00,胁迫期间田间气温比周围自然环境温度高4~7 ℃,湿度维持在43.52%左右,高温期间日均温湿度见图1。其他管理措施与高产田相同。
1.2 测定项目与方法
1.2.1 温湿度监测
将迷你型温湿度实时监测记录仪(RC-4HA/C)悬挂于旗叶层位置,每隔1 min测定一次空气温湿度,直至高温胁迫结束。
1.2.2 光合作用相关参数的测定
每个处理均从花后18 d开始,每4 d测定一次光合参数,共计4次。采用CIRAS-3(PP Systems公司,英国)便携式光合作用测定系统,于每天上午9:00-11:30测定旗叶光合速率、气孔导度和胞间CO2浓度等指标。
1.2.3 叶绿素含量的测定
从花后18 d开始在各小区长势均匀一致的区域选取15片旗叶。参照Lichtenthaler[23]的方法提取叶绿素,应用紫外可见分光光度计在470、649和665 nm下测定吸光度值(A470、A649和A665)。每4 d取样一次,共计4次。按照公式“叶绿素含量=1 000A470-20.05Ca- 114.8Cb)/245”、“Ca=13.95A665-6.88A649”、和“Cb=24.96A649-7.32A665”计算叶绿素 含量。
1.2.4 快速叶绿素荧光动力学曲线测定
在测定前将小麦旗叶暗适应30 min,然后暴露在饱和脉冲光(PFD=3 000 μmol·m-2·s-1)下1s,用M-PEA连续激发式荧光仪(Hansatech,UK)测定快速叶绿素荧光诱导动力学曲线(OJIP荧光诱导曲线)及相关参数[24]。根据Öz等[25]的方法, 将OJIP曲线进行标准化, 通过JIP-test对OJIP曲线进行分析。在同一处理小区内测定6株。

NT:自然温度;HT:高温处理温度;NH:自然湿度;HH:高温处理湿度。
1.2.5 抗氧化酶活性和丙二醛含量的测定
自花后18 d起每4 d取旗叶样一次,4次样品-80 ℃下保存。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用过氧化氢法测定。丙二醛(MDA)含量参照赵世杰等[26]的方法测定。
1.2.6 旗叶类囊体膜组分及其配比的测定
根据Dunahay等[27]方法进行类囊体膜的制备,参照俞红国等[28]方法提取膜脂,膜脂甲酯化后,取上清液,采用日本岛津公司GCMS-QP2010 Plus型气质联用仪检测脂肪酸。脂肪酸标准样品购自Sigma公司。计算不饱和脂肪酸指数(IUFA)。
IUFA=[W(C16∶1)+W(C18∶1)+2× W(C18∶2)+3×W(C18∶3)]
式中,C16∶1、C18∶1、C18∶2和C18∶3分别代表棕榈烯酸、油酸、亚油酸和亚麻酸;W为脂肪酸相对含量(%)或摩尔数。
1.2.7 植株干物质的测定
开花期和成熟期在各小区选取长势均匀的区域,随机取50个小麦植株单茎,按茎(包括叶鞘)、叶、颖壳(包括穗轴)或穗、籽粒进行分样,于烘箱105 ℃下杀青30 min后,并在75 ℃下烘干至恒重,称干物重。
1.2.8 籽粒产量的测定
在各个小区随机选取长势均匀的区域3 m2(2 m×6行),3次重复,进行人工收割、脱粒,自然风干,并进行室内考种,测定小麦的含水量和千粒重,最终以籽粒含水量折合为13%计算产量。
1.3 数据处理
所有数据用Excel 2016及DPS 7.05进行统计分析和差异显著性检验。
2 结果与分析
2.1 迟播对灌浆期高温胁迫下小麦产量及其构成因素的影响
与自然温度(CN)相比,灌浆期高温(CH)胁迫不影响小麦单位面积穗数和粒数,但显著降低粒重和产量(表1)。在自然温度下,相对于常规播期,迟播处理的单位面积穗数降低6.50%,而穗粒数则提高6.26%,单位面积粒数、粒重和产量均无显著变化。在高温胁迫下,迟播处理的粒重和产量比常规播期分别提高4.70%和4.86%,差异均显著,说明推迟播期可缓解高温胁迫对小麦粒重的负效应,进而提高产量。
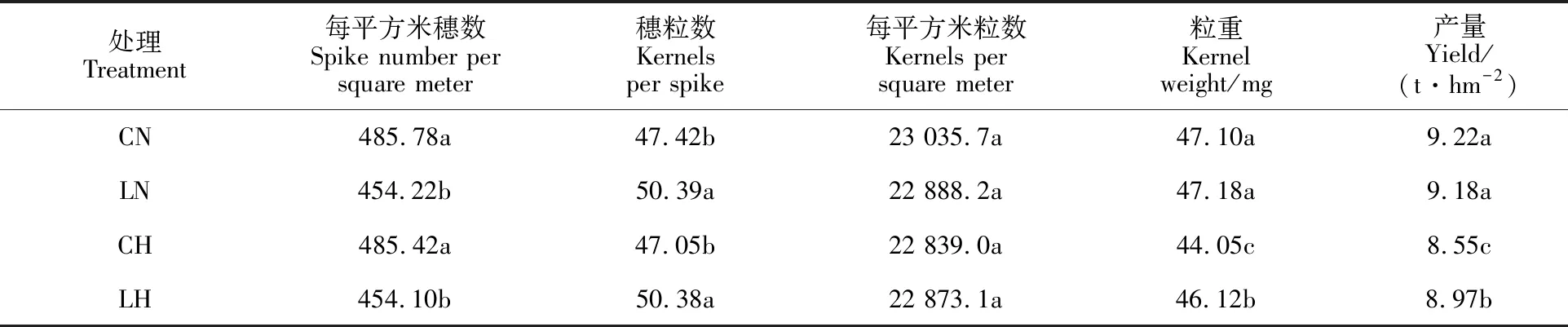
表1 迟播对灌浆期高温胁迫下冬小麦籽粒产量及其构成的影响Table 1 Effect of delayed sowing on grain yield and its components of winter wheat under heat stress at late grain-filling stage
2.2 迟播对灌浆期高温胁迫下小麦花前贮存干物质转运和花后干物质生产的影响
在相同播期下,与正常温度相比,高温胁迫显著增加了小麦花前营养器官贮存干物质的转运量、转运效率和对籽粒产量的贡献率,降低了花后干物质生产量和贡献率(表2)。在高温胁迫下,与常规播期相比,迟播小麦的花前干物质转运量、转运效率及贡献率分别减少25.70%、17.36%和29.18%,花后干物质生产量和贡献率分别增加14.21%和8.86%,表明高温条件下推迟播期可促进提高小麦花后干物质生产,有助于提高粒重和产量。
2.3 迟播对灌浆期高温胁迫下小麦旗叶叶绿素含量与光合参数的影响
随小麦花后的生长发育,各处理旗叶净光合速率、气孔导度和叶绿素含量均呈降低趋势,胞间CO2浓度则呈上升趋势,且自然温度下光合速率、蒸腾速率和叶绿素含量高于高温胁迫,胞间CO2浓度则相反(图2)。在正常温度下,迟播的光合速率较常规播种增加2.32%~ 3.01%;而在高温条件下,迟播的光合速率较常规播种增加 2.49%~37.25%。播期也显著影响小麦旗叶气孔导度、胞间CO2浓度和叶绿素含量(图2)。与常规播种相比,迟播小麦的气孔导度、胞间CO2浓度和叶绿素含量在自然温度下分别增加 3.98%~6.25%、0.62%~1.87%和 3.77%~12.44%,高温条件下分别增加 3.98%~ 29.50%、0.72%~3.06%和3.77%~ 54.88%。由此说明推迟播期可缓解高温胁迫对小麦光合作用的抑制效应。

图2 推迟播期对冬小麦灌浆后期高温胁迫下旗叶光合速率的影响
2.4 迟播对灌浆期高温胁迫下小麦旗叶抗氧化酶活性和丙二醛含量的影响
播期显著影响冬小麦旗叶SOD、POD、CAT活性和MDA含量(图3)。相对于常规播期,在正常温度和高温胁迫下迟播小麦的SOD活性分别提高3.11%~8.23%和3.11%~25.05%,POD活性分别提高6.18%~7.33%和4.97%~17.35%,CAT活性分别提高12.86%~31.44%和12.86%~56.69%,而MDA含量分别降低 7.96%~20.21%和12.59%~23.62%。这表明推迟播期可显著提高小麦灌浆后期活性氧清除能力,减轻灌浆后期高温胁迫对小麦造成的过氧化损伤。

图3 推迟播期对冬小麦灌浆后期高温胁迫旗叶抗氧化酶活性和MDA含量的影响
2.5 迟播对灌浆期高温胁迫下小麦旗叶类囊体膜脂肪酸组分相对含量及配比的影响
由测定结果(表3)可知,与常规播期相比,迟播冬小麦的旗叶类囊体膜中棕榈酸(C16∶0)、硬脂酸(C18∶0)和油酸(C18∶1)相对含量降低,棕榈烯酸(C16∶1)和亚麻酸(C18∶3)相对含量增加,而亚油酸(C18∶2)相对含量无明显变化规律。其中,在正常温度和高温胁迫下,亚麻酸含量增幅分别为2.05%~5.75%和0.89%~ 18.02%,棕榈酸含量降幅分别为3.83%~ 8.80%和3.94%~ 16.81%,硬脂酸含量降幅分别为8.67%~27.75%和 25.52%~34.64%。播期也显著影响冬小麦旗叶类囊体膜不饱和脂肪酸含量、饱和脂肪酸含量、不饱和脂肪酸指数(图4)。与常规播期相比,迟播小麦的不饱和脂肪酸含量在正常温度和高温胁迫下分别增加 2.14%~4.04%和2.14%~ 13.07%,饱和脂肪酸含量分别减少8.33%~ 11.84%和11.84%~ 20.29%,不饱和脂肪酸指数分别增加2.14%~ 4.13%和2.14%~ 13.07%。这表明,推迟播期条件下小麦旗叶类囊体膜不饱和脂肪酸含量的增加主要是由亚麻酸相对含量的增加而引起的,饱和脂肪酸含量的降低主要是由于棕榈酸和硬脂酸含量的共同降低所致,从而导致小麦具有相对较高的不饱和脂肪酸指数。
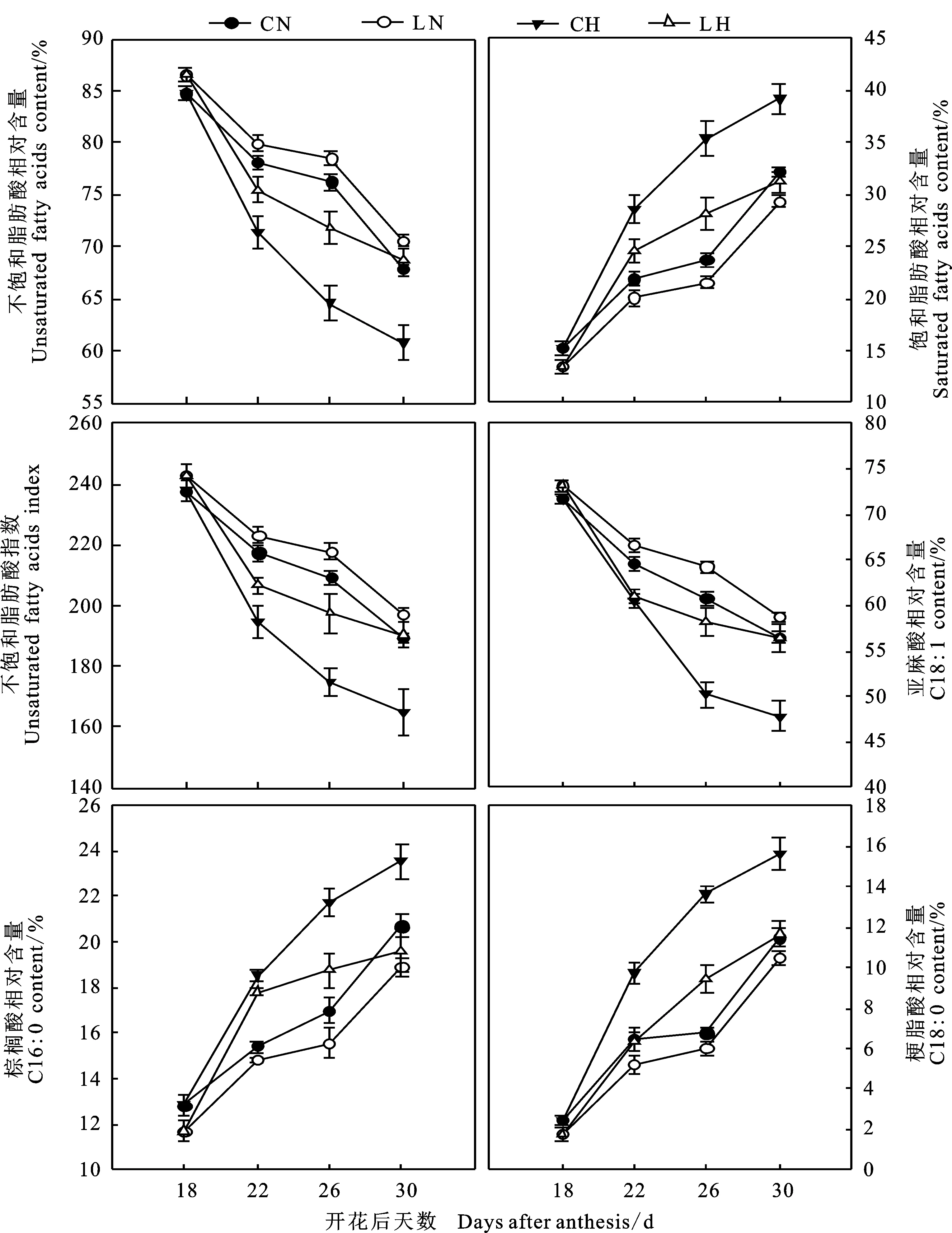
图4 推迟播期对冬小麦灌浆后期高温胁迫下旗叶类囊体膜相关脂肪酸指标的影响

表3 推迟播期对冬小麦灌浆后期高温胁迫下旗叶类囊体膜脂肪酸组分相对含量的影响Table 3 Effect of delayed sowing on relative content of fatty acid composition of thylakoid membrane in wheat under heat stress at late grain-filling stage %
2.6 迟播对灌浆期高温胁迫下小麦旗叶荧光特性的影响
由灌浆期旗叶快速叶绿素荧光诱导动力学曲线(OJIP曲线)可知,高温胁迫前JIP-test曲线基本不受播期的影响,说明此时播期对PSⅡ供体侧和受体侧的影响较小。而高温胁迫后,迟播处理的JIP-test曲线在J点和I点显著低于常规播期,表明高温胁迫下常规播期处理叶片QA-QB的电子传递过程受阻严重(图5)。
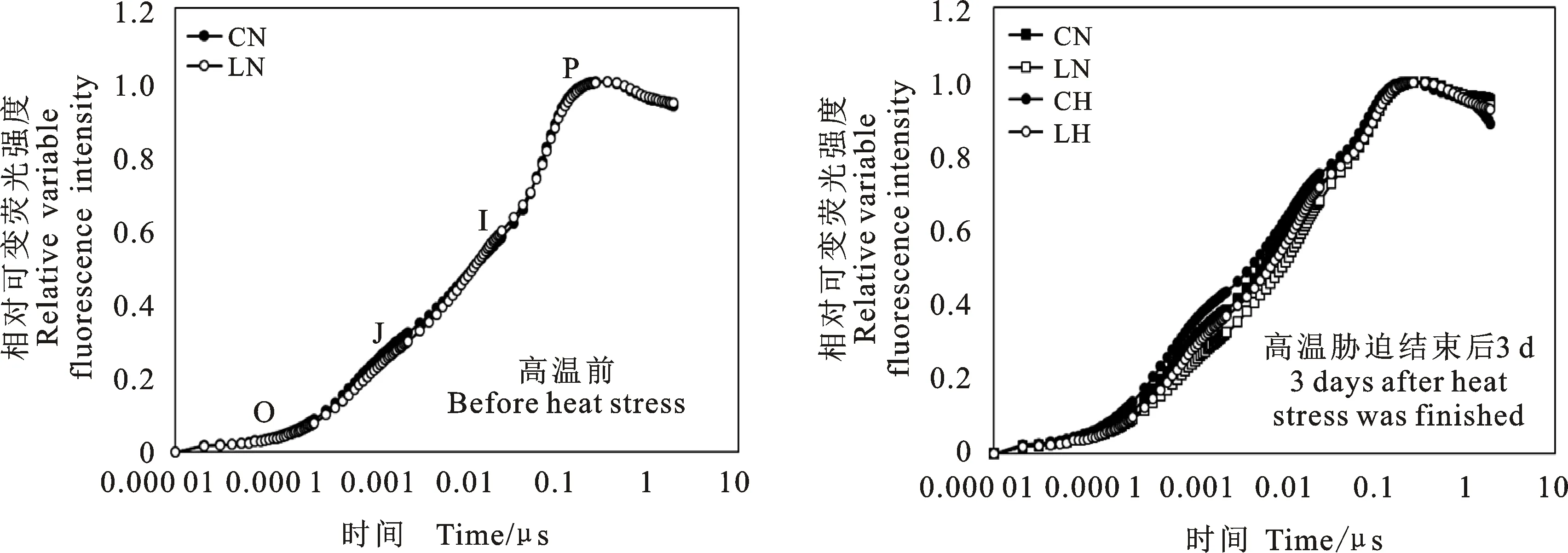
图5 推迟播期对冬小麦灌浆后期高温胁迫下相对可变荧光强度的影响
播期显著影响冬小麦旗叶单位面积内有活性的反应中心数目(RC/CSm)、捕获的光能(TRo/CSm)、电子传递的量子产额(ETo/CSm)和用于热耗散的能量(DIo/RC)。在正常温度和高温胁迫下,与常规播期相比,迟播条件下,RC/CSm分别增加4.32%~38.55%和4.32%~101.17%,TRo/CSm分别增加0.58%~16.51%和0.58%~39.24%,ETo/CSm分别增加4.56%~ 11.76%和4.56%~50.03%,而DIo/RC分别降低5.24%~13.51%和0.98%~6.86%(表4)。在吸收光能的分配比率方面,播期显著影响最大光化学效率(ΦPo)、捕获的电子向电子传递链传递的效率(ψo)、用于电子传递的量子产额(ΦEo)以及用于热耗散的量子比率(ΦDo)。在正常温度和高温胁迫下,迟播小麦较常规播期ΦPo分别增加 1.19%~9.05%和1.48%~11.44%、ψo分别增加1.10%~ 24.46%和4.08%~48.88%、ΦEo分别增加2.94%~28.55%和 5.46%~69.43%,而ΦDo分别降低3.10%~9.32%和2.15%~ 23.57%(表5)。以上结果表明,迟播小麦的旗叶中有较高比例的能量进入电子传递,提高了光化学反应中可以利用的能量,而常规播期下旗叶中有较高比例的能量用于热耗散方面,且高温胁迫下推迟播期效应更显著。

表4 推迟播期对冬小麦灌浆后期高温胁迫旗叶单位横截面积能量分配的影响Table 4 Effect of delayed sowing on the energy fluxes per cross sectional area in wheat flag leaves under heat stress at late grain-filling stage
3 讨 论
冬小麦灌浆后期是籽粒充实的关键时期,此阶段高温胁迫会影响小麦籽粒灌浆进而影响产量[29-30]。本试验中,在自然温度下,由于两播期间单位面积粒数和粒重均差异不显著,因此两播期下产量也无显著差异,这与Dai等[20]和Yin等[21]研究结果一致。而相对于常规播期,高温胁迫下推迟播期可在单位面积粒数不变条件下通过提高小麦粒重实现增产,表明推迟播期是一项有效应对小麦灌浆后期高温胁迫的栽培管理措施。而从籽粒光合产物的来源角度分析,高温胁迫下推迟播期主要是提高了花后干物质的生产量及其对产量的贡献率,进而提高了小麦产量。由此亦说明高温胁迫下较强的光合能力是迟播小麦耐高温胁迫的生理基础。
高温胁迫显著影响冬小麦光合作用,光合电子传递链是光合器官中产生活性氧(ROS)的主要来源[31]。高温胁迫下,PSⅡ的过剩激发能增加,造成大量ROS产生,进而对光合机构造成损伤[32-33]。本试验中,与常规播期处理相比,高温胁迫后迟播小麦的SOD、POD、CAT活性增加,有利于清除更多的ROS,维持ROS的产生与清除的动态平衡,并降低膜脂过氧化程度,提高冬小麦抗高温能力。
光合作用过程中的光化学反应和电子传递反应都发生在类囊体膜上,而类囊体膜的功能是以流动性和完整性为基础的。脂肪酸组成能够影响生物膜的流动性和膜结合酶活性的高低[34-35]。高温胁迫下类囊体膜的流动性和电子载体的完整性是PSⅡ对高温响应敏感的重要原因[4]。本研究中,与常规播期处理相比,推迟播期通过提高高温胁迫后旗叶亚麻酸含量,增加不饱和脂肪酸的相对含量,通过减少棕榈酸和硬脂酸相对含量,进而降低饱和脂肪酸的相对含量,由此提高了不饱和脂肪酸指数。不饱和脂肪酸指数是判断类囊体膜损伤程度的重要标志,较低的不饱和脂肪酸指数值会降低膜的流动性,不利于类囊体膜的稳定[36]。本研究中,与常规播期处理相比,推迟播期后小麦旗叶高温胁迫下的不饱和脂肪酸指数值较高,提高了类囊体膜的稳定性,进而保持了光化学反应和电子传递反应的稳定性。
在光合机构捕获光能发生电子传递的同时,还有一部分能量以热和荧光的形式耗散掉,这三者之间互相竞争,任何一者的改变都会导致其他二者发生变化[37]。OJIP标准化曲线的J点、I点分别与QA的氧化还原状态、质体醌的氧化还原状态有关[24]。本试验中,常规播期处理的J点、I点均比推迟播期处理高,表明高温胁迫后常规播期的小麦QA-QB电子传递受阻。与常规播期相比,推迟播期可以利用更多的有活性的反应中心来捕获更多能量,使更多的激发能进入电子传递链,从而减少热耗散,提高在高温胁迫下光合系统的同化能力。
在Rubisco等酶的催化作用下,植物利用光反应所提供的NADPH和ATP,将细胞间隙的CO2转化为糖等有机物。胞间CO2作为暗反应的底物,其浓度显著影响光合速率;胞间CO2浓度与CO2的扩散密切相关,而其扩散受到气孔阻力的影响[38-39]。本研究表明,推迟播期后冬小麦气孔导度、胞间CO2浓度、光合速率和叶绿素含量均大于常规播期处理。这说明,与常规播期相比,推迟播期通过提高气孔导度提升了胞间CO2浓度,保障了在高温胁迫下光合作用的底物供应,进而获得较高的光合速率。
综上所述,高温胁迫下推迟播期通过提高小麦旗叶类囊体膜不饱和脂肪酸指数,确保了类囊体膜的稳定性,减轻了高温对小麦旗叶光合机构的损伤,并通过提高小麦旗叶的活性氧清除能力,保障光合电子传递链上的能量传输,进而提高光化学反应中可利用能量的分配比例,提高光合系统的同化力;同时通过提高气孔导度提升胞间CO2浓度,确保光合作用的底物供应。总之,迟播冬小麦可在灌浆期高温胁迫下保持旗叶较高光合速率,保障花后干物质生产,进而提高粒重和产量。

