小麦表皮蜡质脂肪醇合成基因 TaFAR10的克隆及功能验证
刘晓宇,吴洪启,石善党,李春莲,汪 勇,王中华
(西北农林科技大学农学院,陕西杨凌 712100)
小麦是世界上重要的粮食作物之一,为全球五分之一的人口提供食物,其稳产与高产具有重要意义。近年来,全球气温升高严重影响着小麦的生长和产量[1]。研究发现,植物表皮蜡质覆盖于植物最外层,与外界直接接触,并形成了一道天然的疏水屏障,不仅具有防止非气孔性水分散失、提高植物光合效率的作用,还具有保护植物免受外来机械损伤、病虫害入侵、紫外线灼伤等作用[2-6]。因此,研究蜡质合成相关基因的功能能够为提高小麦的抗逆性和产量奠定一定的基础。植物表皮蜡质由超长链脂肪酸及其衍生物如初级醇、次级醇、烷烃、酯类、醛类、单酮和二酮等组成,一些物种的表皮蜡质中还含有三萜类和酚类[7-9]。植物表皮蜡质在不同生长时期、不同器官中的含量和组成存在很大差异[8-9];其成分和含量也受环境影响,如光照、水分、温度等[10-12]。植物表皮蜡质的晶体结构主要有片状、柱状、管状、光滑薄膜状等,这些蜡质晶体覆盖在植物叶片或者茎上,形成白霜状或者灰白状蜡质层[13]。
目前,对拟南芥表皮蜡质的合成途径研究已较为清楚,首先是在质体中形成脂肪酸前体,然后这些脂肪酸前体在内质网中延伸为超长链脂肪酸,最后经过酰基还原途径将超长链脂肪酸转化为初级醇和酯,或者经过脱羰途径将超长链脂肪酸转化为烷烃、次级醇、酮等[7,14-15]。初级醇的合成存在两种说法,在甘蓝中,首先是依赖NADH的脂肪酰基辅酶A还原酶将脂肪酸还原为醛,然后依赖NADH的醛还原酶将醛转换为初级醇[16];玉米gl5突变体的表型化学分析也证明了这两个过程的存在[17]。但后续研究发现,在豌豆的叶片中能够利用单一的酶直接将超长链脂肪酸还原为初级醇[18]。研究还发现,在拟南芥中,CER4、FAR2、FAR1、FAR4、FAR5和FAR6均能够直接将脂肪酸还原为初级醇[19]。普通小麦的植株表面覆盖有丰富的蜡质层,初级醇是小麦表皮蜡质的重要组分之一[20]。目前小麦蜡质合成的分子机制还不是很清楚,有研究在小麦突变体中精细定位了两个与蜡质合成相关的基因Iw1和Iw2,并且推测这两个基因可能抑制β-二酮的合成[21-22]。近年来研究发现,TaFAR1、TaFAR2、TaFAR3、TaFAR4和TaFAR5/TAA1b参与小麦表皮蜡质初级醇的生物合成[20,23-25]。
有研究表明,小麦花药绒毡层细胞中特异表达的TaTAA1a基因能够调控脂肪醇的产生[25],但是该基因是否参与小麦叶片表皮蜡质成分中初级醇的生物合成仍不清楚。为探究这一问题,本研究拟从小麦品系CP98(11)中克隆该基因,并通过序列分析、酵母异源表达、胁迫处理等方法,对该基因的结构、功能和表达模式等进行研究和分析,以期为进一步理解小麦叶片表皮蜡质合成途径的分子机制奠定基础。
1 材料与方法
1.1 材料与处理
试验材料为普通六倍体小麦CP98(11)(低蜡品系)和其他表型差异的材料,其中,A14、静2001、CP98(11)为低蜡品种,陕垦99(46)、明988、9(54)为高蜡品种,种植于西北农林科技大学科研试验田。为了检测非生物胁迫条件下基因的表达量,将CP98(11)种植于西北农林科技大学科研温室,生长45 d左右后将材料小心取出,用自来水将基质冲洗干净,将冲洗好的材料置于洗干净的烧杯中,加入适量自来水,在原来生长环境下恢复两天。将材料从烧杯中取出,用滤纸将根上的水吸干,分别进行以下处理:暴露于空气中进行干旱处理;放在装有500 mL 20% PEG 6000中;放在100 μmol·L-1ABA中;放入装有500 mL自来水的烧杯中并置于4 ℃环境下。
1.2 小麦总RNA的提取
在四叶期取小麦叶片,在小麦开花期取不同的器官,使用Trizol法提取小麦总RNA。
1.3 cDNA第一链的合成
取3 μg总RNA,按照Prime Script 反转录试剂盒(Genstar)说明书进行cDNA第一链的 合成。
1.4 目的基因的克隆
根据小麦中的TaFAR4基因序列,分别在NCBI(https://www.ncbi.nlm.nih.gov/)和Ensembl Plants (http://plants.ensembl.org/Triticum_aestivum/Tools/Blast?db=core)的小麦数据库中进行BLASTN搜索,找到了与TaFAR4相似性较高的基因TaTAA1a,对其进行克隆。利用Primer Premier 5设计引物F1/R1(ATGGTTGACACACTGAGTGAAGAGA/TC ACTTGAGCATGTACTTTATGACC),由生工(Sangon)生物工程(上海)股份有限公司合成。以1.3中得到的cDNA为模板,利用引物F1/R1进行PCR扩增。扩增体系(50 μL):2×PCR Buffer for KOD FX 25 μL,dNTPs(2 mmol·L-1)10 μL、ddH2O 10 μL,KOD FX(1.0 U·μL-1)1 μL,上下游引物各1 μL,cDNA 2 μL。扩增程序:94 ℃预变性2 min;98 ℃变性 10 s,62 ℃退火30 s,68 ℃延伸90 s,35个循环;68 ℃延伸10 min。扩增产物在150 V、200 mA的条件下,经1%琼脂糖凝胶电泳检测后,利用胶回收试剂盒(Genstar)回收并纯化目的片段,加入rTaq酶和dNTPs,72 ℃保温30 min,完成末端加A。末端加A的基因片段与pMD18-T(TaKaRa)连接,连接产物转入大肠杆菌DH5α,经过抗性筛选,挑取单克隆,摇菌后送生工生物工程(上海)股份有限公司进行序列测序,使用软件DNAMAN对测序结果进行多序列比对。
1.5 pYES2载体的构建及酵母转化
根据酿酒酵母表达载体pYES2和目的基因的编码区序列,设计带有酶切位点的引物F2/R2(AGGGAATATTAAGCTTATGGTTGACACA CTGAGTGAAGAGA/GATATCTGCAGAATTCTCACTTGAGCATGTACTTTATGACC(下划线为酶切位点);以带有目的基因的pMD18-T为模板,利用引物F2/R2扩增目的基因带有酶切位点的完整编码序列,将扩增得到的片段和pYES2载体经HindIII和EcoRI双酶切后用T4DNA连接酶连接,转入大肠杆菌DH5α,经过菌落PCR和测序鉴定,确定目的基因序列无碱基突变后,将重组载体和空载体pYES2质粒分别转入酿酒酵母(INVSc1)菌株中,利用尿嘧啶缺陷型培养基(SC-Ura)筛选阳性单克隆。酵母的转化方法参照Gietz和Woods[28]。
1.6 酵母蜡质的提取及其色谱分析
酵母蜡质的诱导和提取参照Wang等[27]的方法,将提取的酵母表达产物用正己烷回溶并转入气相色谱分析瓶中。利用气相色谱-质谱联用仪(GC/MS-QP2010,日本岛津公司)对酵母提取物进行检测。检测条件为:载气为氦气(He),进样量1 μL,进样口温度280 ℃,分流比为2∶1,检测器温度320 ℃,扫描离子50~600 amu。升温程序为:50 ℃保持2 min,以20 ℃·min-1升温至240 ℃,保持2 min,再以1.5 ℃·min-1升温至320 ℃,保持15 min。各化合物因沸点不同得到分离,根据计算机质谱数据库中醇、酸、醛、酯等化合物的特殊离子峰对酵母提取物进行鉴定。
1.7 目的基因序列分析
利用DNAStar 软件包的EditSeq程序和ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/) 寻找最大的开放阅读框;在NCBI(http://www.ncbi.nlm.nih.gov/BLAST) 对核苷酸序列进行BLAST分析;运用SMART(http://smart.Embl-heidelberg.de/) 和InterPro(http://www.ebi.ac.uk/interpro/) 对蛋白的功能结构域进行分析;运用DNAMAN 8.0软件对氨基酸序列进行同源比对;使用MEGA 6.0 构建蛋白进化树。
1.8 实时荧光定量PCR分析
在比较小麦其他FAR基因序列基础上,对目的基因序列设计特异的实时荧光定量PCR引物(F/R:TGGCTTCCTTCCACCTATTT/TA CTTGCGTGCTTGGTCGTG),内参为小麦TaActin(F/R:TGTTGTTCTCAGTGGAGGTTCT/CTGTATTTCCTTTCAGGTGGTG)。实时荧光定量PCR体系为20 μL,按照试剂盒2 × Realstar Power SYBR Mixture(Genstar)说明书进行扩增,反应程序为95 ℃预变性 60 s;95 ℃变性15 s,58 ℃退火30 s,72 ℃延伸60 s,40个循环。反应在ABI PRISM 7700 荧光定量PCR仪上进行(Applied Biosystems)。每个样品4次重复,采用2-ΔΔCT法进行定量分析。
2 结果与分析
2.1 目的基因的克隆及其序列分析
利用特异性引物F1/R1对小麦CP98(11)叶片cDNA进行目的基因的扩增,经过1%琼脂糖凝胶电泳检测后,得到一条大小约1 500 bp的特异性条带(图1)。对特异性条带进行切胶回收后,连接到pMD18-T载体上,连接产物转入DH5α,经菌落PCR鉴定后,选取三个阳性克隆进行测序,测序结果显示,三个阳性克隆序列一致,大小为1 524 bp,且与报道的TaTAA1a序列一致,我们将其命名为TaFAR10。DNAMAN软件分析显示,该基因编码的蛋白由507个氨基酸组成,进一步分析发现,该基因的氨基酸序列中包含一个NAD(P)H 结合位点,一个活性位点和一个跨膜螺旋位点(TM,transmembrane)(图2)。通过URGI(https://wheat-urgi.versailles.inra.fr/Seq-Repository/BLAST)分析发现该基因位于小麦基因组的4B染色体长臂上。
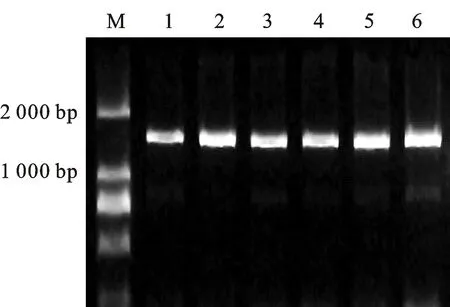
M:DL2000(TaKaRa) ; 1~6:PCR扩增产物。
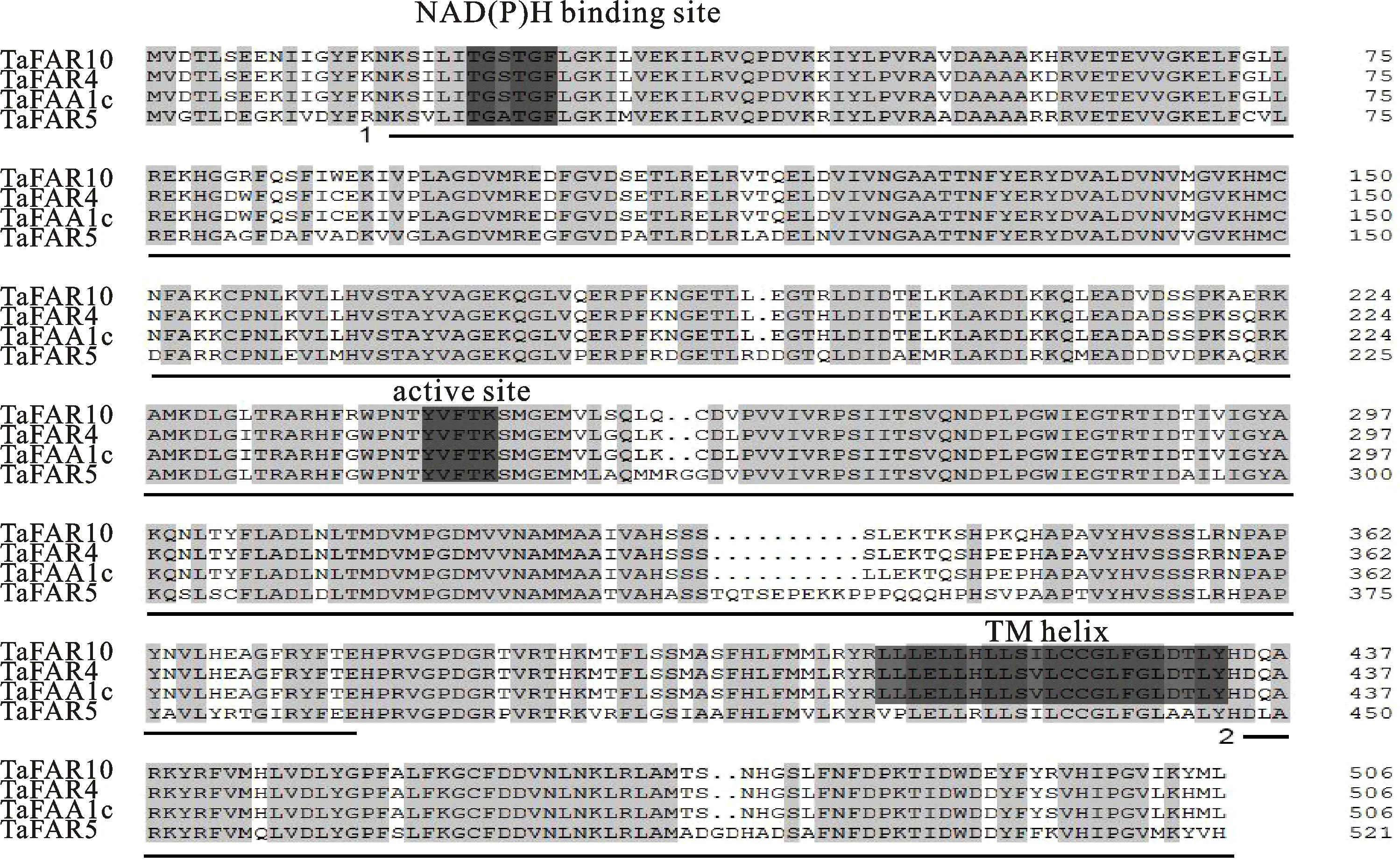
1和2分别代表FAR-N_SDR_e、FAR_C区域。
2.2 小麦 TaFAR10系统进化树分析
利用TaFAR10的氨基酸序列与来自小麦和其他物种中的FAR氨基酸序列构建进化树,结果(图3)表明,19条氨基酸序列主要聚为两大支,其中,TaFAR10、TaFAR4、TaTAA1c亲缘关系较近,并且与拟南芥的AtFAR4聚为一类。TaFAR10与TaFAR4相似性达到95.27%,说明TaFAR10可能具有与TaFAR4相似的功能。
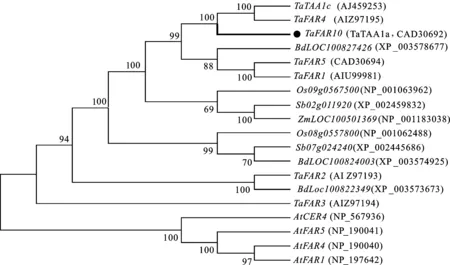
At:拟南芥;Ta:普通小麦;Os:水稻;Bd:二穗短柄草;Zm:玉米;Sb:高粱。
2.3 TaFAR10基因在酵母中的异源表达
按照1.5中提到的方法构建酵母表达载体,将构建好的重组载体和空载体pYES2质粒分别转入酿酒酵母(INVSc1)菌株中,利用尿嘧啶缺陷型培养基(SC-Ura)筛选阳性单克隆,并按照Wang等[27]的方法进行诱导,从酵母产物中提取蜡质成分,经反应后,使用气相色谱质谱联用仪(GC-MS)对其进行鉴定。结果显示,与空载体相比,TaFAR10基因表达产物含有C18:0脂肪醇的离子峰(图4),表明TaFAR10基因具有合成C18:0脂肪醇的功能。
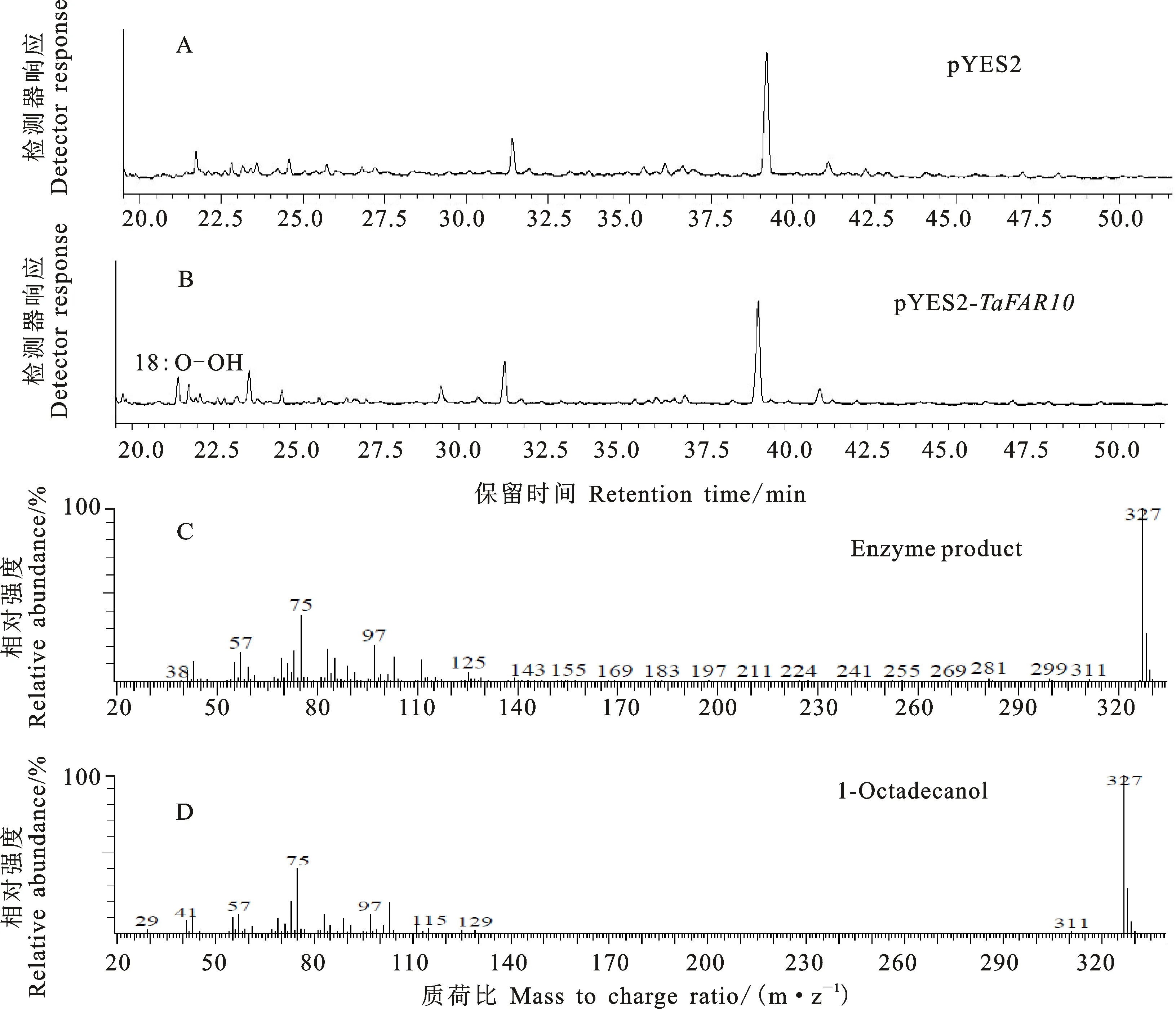
A:pYES2空载;B:pYES2- TaFAR10表达载体;C:酶产物; D:C18:0脂肪醇。
2.4 TaFAR10在不同组织及品种中的表达
由图5可知,TaFAR10在旗叶、苗期叶片、叶鞘、穗下茎、颖壳、茎节、芒、花药和根中均有表达,其表达量由高到低依次为:旗叶、苗期叶片、叶鞘、穗下茎、颖壳、茎节、芒、花药、根。该基因在以上组织中的表达量分别是根的80.7、53.8、19.8、19、13.2、10.8、6.1和5倍。说明TaFAR10基因主要在旗叶和苗期叶片中大量表达。推测TaFAR10基因在小麦叶片表皮蜡质合成途径中起着重要的作用。
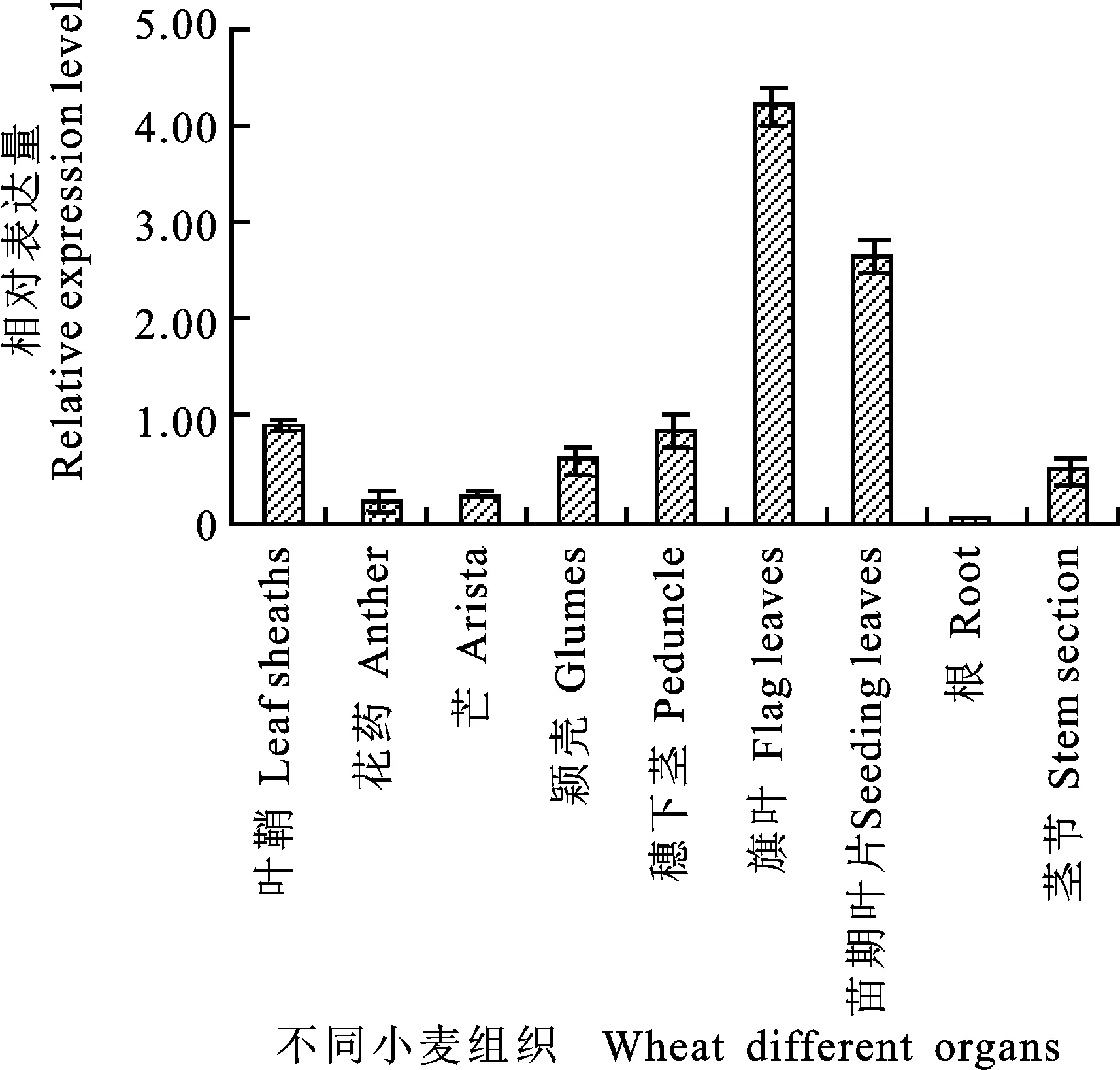
图5 TaFAR10在不同组织表达的qRT-PCR分析
对小麦品种A14、静2001、CP98(11)、陕垦99(46)、明988、9(54)进行定量PCR分析发现,TaFAR10基因在各品种中均有表达,但其在高蜡品种中的表达量明显高于低蜡品种(图6)。
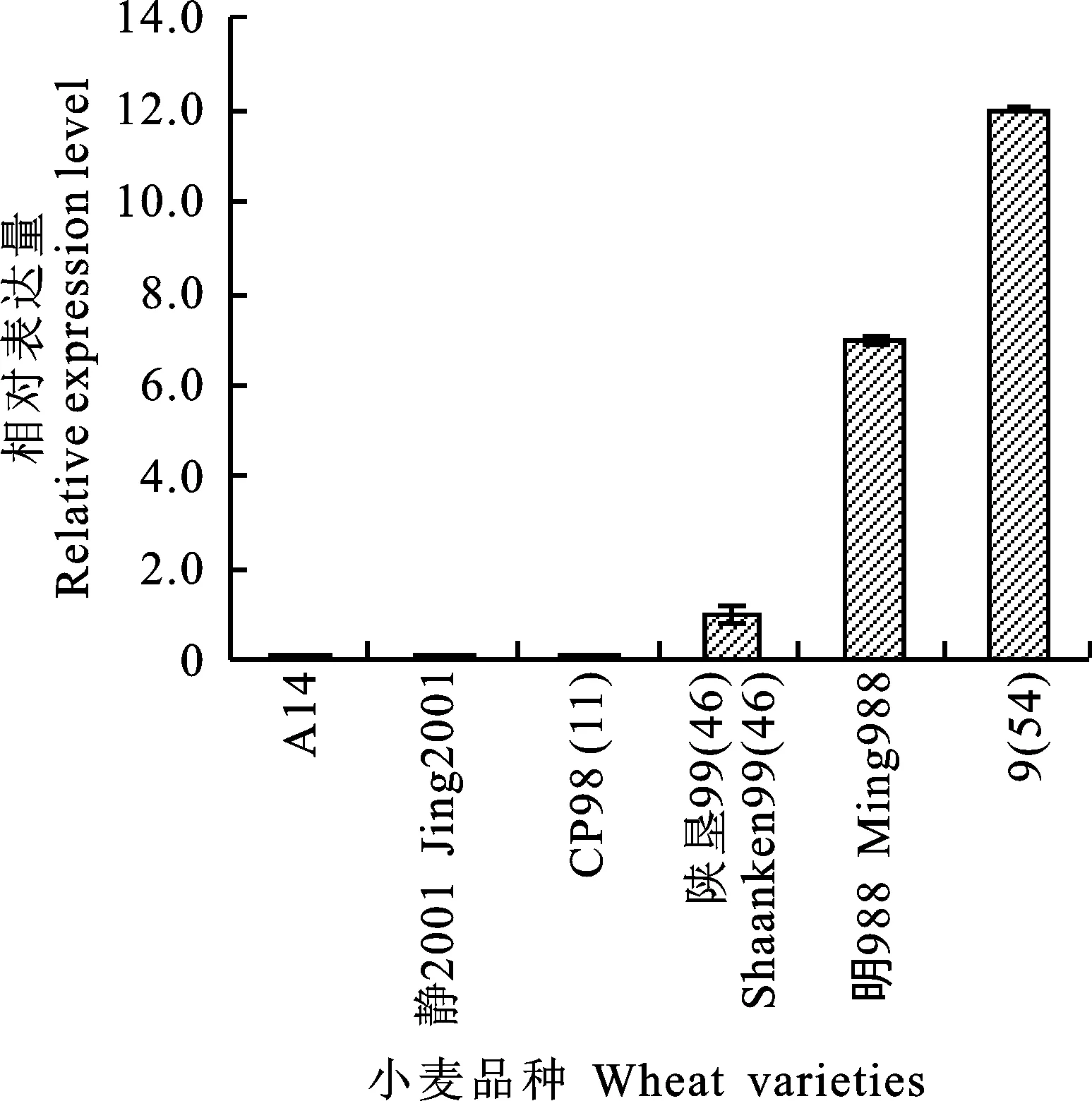
图6 TaFAR10基因在不同小麦品种中的表达分析
2.5 非生物胁迫条件下 TaFAR10表达的分析
对生长一个月的苗期小麦进行干旱、PEG 6000、ABA和4 ℃胁迫诱导表达分析,结果(图7)表明,TaFAR10在ABA、干旱和PEG胁迫条件下表达情况基本一致,在处理2 h内表达量变化不明显,2 h以后明显地受到抑制,虽然其表达量在ABA和干旱处理2 h内均有所增加,但都没有达到显著性水平;而在4 ℃胁迫条件下,TaFAR10的表达一直受到抑制。推测TaFAR10并不能受非生物胁迫诱导。
3 讨 论
FAR基因作为超长链脂肪醇合成过程中的关键基因,对初级醇的形成有着决定性作用。目前在拟南芥、小麦中克隆到了部分FAR基因,并对其功能进行了分析。在本研究中,我们通过同源克隆方法得到了含有完整编码序列的小麦TaTAA1a基因,并将其命名为TaFAR10。该基因的开放阅读框全长为 1 524 bp,编码507个氨基酸残基。结构域分析表明,TaFAR10蛋白分别在N端和C端含有FAR-N_SDR_e和FAR_C结构域,这些结果都与已克隆得到的FAR基因所编码的蛋白质结构域相吻合[20,23-24]。Wang等[20,23-24]将TaFAR蛋白定位在内质网上,我们推测TaFAR10蛋白可能也定位于内质网上,这还有待于进一步的研究。进化树分析结果显示,TaFAR10基因与TaFAR4基因具有很高的同源性,推测TaFAR10可能具有与TaFAR4相似的 功能。
蛋白序列多重比对结果表明,TaFAR10在N端含有NAD(P)H结合位点,中间含有活性位点,在C端含有一个跨膜位点,并且这些关键的功能结构域序列较为保守,且TaFAR10蛋白序列与其他TaFAR蛋白序列的活性位点氨基酸序列一致,说明TaFAR10蛋白与其他TaFAR蛋白的功能具有一致性,推测TaFAR10基因可能具有催化合成超长链脂肪醇的功能。
为了验证TaFAR10具有合成初级醇的功能,我们将TaFAR10基因在酵母中表达,结果显示,TaFAR10基因具有合成C18:0脂肪醇的功能。先前的研究发现,将CER4基因在酵母中表达可以合成C24:0脂肪醇和 C26:0脂肪醇[19]。将拟南芥的FAR1、FAR4、和FAR5转入酵母中,发现这三个基因能够利用不同或者相同的底物产生链长为C18:0到C24:0的脂肪醇[28]。将眼虫的FAR基因转化酵母后,发现该基因能够合成C14:0脂肪醇和C16:0脂肪醇[29]。将荷荷巴的FAR基因转化大肠杆菌,发现该基因具有合成C16:0脂肪醇和C18:1脂肪醇的功能[30]。将小麦中的TaFAR基因在酵母中进行异源表达,发现TaFAR1和TaFAR5基因可以合成C22:0脂肪醇,TaFAR2能合成C16:0-C20:0脂肪醇,TaFAR3能合成C22:0-C30:0脂肪醇,TaFAR4合成C22:0-C26:0脂肪醇[20,23-24]。这些研究充分证明了在酵母中进行异源表达可以验证FAR基因的功能,不同小麦TaFAR基因对底物脂肪酸的链长偏好不同。TaFAR10与其他TaFAR所编码的酶相比,底物范围较窄,TaFAR10只能以C18碳链饱和脂肪酸为底物或者优先还原C18:0脂肪酸。
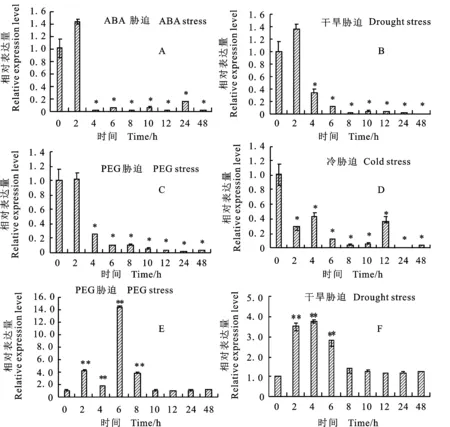
A、B、C、D分别为 TaFAR10在ABA、干旱、PEG、冷胁迫条件下的表达情况,E、F为 TaFER-5B(阳性对照)在PEG和干旱胁迫条件下的表达情况。*:P<0.05;**:P<0.01。
初级醇是小麦旗叶表皮蜡质的主要成分。Wang等[25]的研究表明,TaTAA1a基因在花粉发育过程中具有重要作用,在花药组织中,该基因的产物只存在于绒毡层,并且仅在花粉粒外细胞壁形成的特定阶段表达。转基因结果显示,该基因的表达有助于脂肪醇的产生,但并未证明该基因是否参与表皮蜡质的生物合成[25]。本研究表明,TaFAR10基因在酵母中具有合成C18:0脂肪醇的功能,而且在小麦旗叶和苗期叶片中均具有较高的表达水平,另外,TaFAR10基因在高蜡品种中的表达量明显高于低蜡品种,而TaFAR10基因克隆自低蜡品种,说明该基因是小麦中普遍存在的一个基因,推测其在小麦叶片表皮蜡质的合成过程中起着非常重要的作用。蜡质的主要成分包括初级醇、烷烃、醛、酯等。花粉壁含有蜡酯和其他脂类形式的脂肪醇。研究已经证实,一些有关蜡质产生的突变体能够影响花粉的发育或花粉育性[25]。由此推测,生物合成网络的遗传基础在表皮和花药组织之间可能是共享的。
植物表皮蜡质能够限制非气孔性水分的丧失,从而在干旱条件下发挥重要作用[2]。研究发现,拟南芥中蜡质的组成以及蜡质合成相关基因的表达均受干旱、盐、ABA胁迫的诱导[31]。CER1是拟南芥中合成烷烃的一个重要基因,在干旱、ABA、NaCl胁迫条件下表达量显著升高;CER6是拟南芥中一个极长链脂肪酸缩合酶,在ABA胁迫条件下表达量升高[32]。拟南芥中的DSO也能够在高盐、高糖、ABA胁迫条件下表达量显著升高[33]。研究发现,小麦中参与初级醇合成的基因TaFAR1和TaFAR5的表达受干旱、PEG、ABA和冷胁迫的诱导而上调表达[20,23],TaFAR2、TaFAR3、TaFAR4的表达受PEG、ABA、盐胁迫和冷胁迫的诱导[24]。而在本研究中,TaFAR10基因在ABA、干旱、PEG、4 ℃胁迫条件下,表达量整体呈下调的趋势。目前,小麦蜡质的合成途径还不清楚,推测可能该基因在胁迫条件下的作用较小,也有可能该基因是蜡质合成途径中的一个微效基因,具体的分子调节机制还有待于进一步的研究。
4 结 论
本研究从小麦4B染色体长臂上克隆了一个TaTAA1a基因,并将其命名为TaFAR10,该基因的ORF长为1 524 bp,编码一个507个氨基酸的蛋白质,具有其他TaFARs共有的保守结构域。酵母异源表达结果显示,TaFAR10具有合成C18:0脂肪醇的功能。TaFAR10基因在旗叶、苗期叶片、叶鞘、穗下茎、颖壳、茎节、芒、花药和根中均表达,在旗叶和苗期叶片中大量表达,呈现组织特异性。TaFAR10在低蜡材料中的表达明显低于高蜡材料。在ABA、干旱、PEG 6000和4 ℃冷胁迫条件下,TaFAR10基因的表达量呈下降趋势,表明该基因不能受非生物胁迫诱导。TaFAR10参与了小麦叶片表皮蜡质脂肪醇的合成。

