抗条锈病小麦-滨麦Lm#3Ns二体异附加系的分子细胞遗传学鉴定
杜 欣,杜少帅,马 兵,王艳珍,陈春环,吉万全,王长有
(1.西北农林科技大学农学院,陕西杨凌 712100;2.农业部作物基因资源与种质创制陕西科学观测实验站,陕西杨凌 7121003;3.杨凌国家农作物新品种试验站,陕西杨凌 712100)
滨麦(Leymusmollis,2n=4x=28,NsNsXmXm)是赖草属(LeymusHochst)的一个四倍体多年生的物种,具有大穗多花、茎秆粗壮、抗旱、耐盐碱以及对多种真菌病害表现免疫等优良性状,是小麦遗传改良的重要三级基因源;主要分布在中国北部沿海地区、俄罗斯、朝鲜、日本和北美[1]。目前就滨麦的基因组组成争议较大,普遍接受的基因组组成是NsNsXmXm;Ns基因组来自于新麦草属,然而,Xm基因组的起源仍然未知[2]。研究表明,Xm基因组可能源自旱麦草的F基因组或冰草的P基因组[3]。Anamthawat-Jónsson[4]以新麦草基因组DNA作探针与赖草属染色体进行基因组原位杂交和Southern杂交,发现滨麦染色体组为NsNs(Ns1Ns2)。
小麦条锈病是由条锈菌(Pucciniastriiformisf. sp.tritici)引起的最广泛和最具破坏性的真菌病害之一,导致小麦产量减少10%~30%甚至100%[4]。研究表明,栽培抗病小麦品种是最经济、有效和环保的控制条锈病的途径[5-7]。因此,利用新种质的抗性基因来培育抗性品种是十分有必要的,远缘杂交是将近缘种属中优异的基因导入到普通小麦中的一种有效方法[2]。
苏联育种家在20世纪50-70年代,通过胚培养相继获得了小麦-滨麦第一个杂交种、杂种的双二倍体以及硬粒小麦与滨麦的不完全双二倍体材料。20世纪80年代,我国育种学家将普通小麦7182与滨麦杂交,通过胚胎拯救和秋水仙素处理获得的第一个杂交种[8]。随后,在回交和杂交后代获得各种衍生系,包括八倍体小滨麦和部分双二倍体等[9]。八倍体小滨麦M842与小麦4D、5A缺体系杂交创制了三个附加系和两个代换系[9-11]。两个小麦-滨麦代换系山农0096和山农6343分别具有条锈病和白粉病抗性[12]。3D(3Ns)代换系10DM57,具有条锈病抗性[13]。Yang等[1]从普通小麦7182和滨麦的杂交后代中获得三个衍生系,利用细胞学、原位杂交、分子标记及田间抗病性鉴定等技术对小麦-滨麦衍生后代进行了分析,获得了M42、M47、M51和7Ns(7D)代换系等[14-18]。Li等[19]将 M852-1-2-26和Norin26+3C杂交,利用GISH技术检测其F2代植株,共获得了具有不同染色体易位的8个单株。孙文静等[20]对307份小滨麦种质系苗期和成株期进行条锈病鉴定,获得49份高抗条锈病的小滨麦种质系,其中8份小麦-滨麦渐渗系具有大穗多花、结实性好、高抗条锈病等优良性状,可以作为优异抗条锈病材料。
M11005-1-2-7-10-1-1(M11005A)是选自普通小麦7182与滨麦衍生后代M42(2n=54)F6代的株系,染色体数目为44,本研究拟通过形态学、细胞学、原位杂交、分子标记(EST和PLUG标记)等方法确定M11005A外源染色体的同源群归属和条锈病抗性,为该种质在小麦改良中的利用提供依据。
1 材料与方法
1.1 材 料
供试材料为普通小麦7182、滨麦、华山新麦草、小麦-滨麦衍生后代M42、新创制的小麦-滨麦衍生系M11005-1-2-7-10-1-1(M11005A)和辉县红,均由西北农林科技大学农学院小麦远缘杂交及染色体工程实验室提供。鉴定条锈病抗性所使用的条锈菌生理小种CYR29、CYR32、CYR34及CYR32和CYR33混合小种均由西北农林科技大学植物保护学院提供。
1.2 方法
1.2.1 细胞学鉴定
在适宜的时间和温度下在田间取供试材料的根尖和幼穗,根尖和幼穗的处理方法根据Yang等[14]方法,根尖采用卡诺氏固定液Ⅰ(V无水乙醇∶V醋酸=3∶1)室温固定48 h,用1.0%的醋酸洋红染色12 h,镜检;幼穗用卡诺氏固定液Ⅱ (V无水乙醇∶V氯仿∶V醋酸=6∶3∶1)在室温下固定48~72 h,用1.0%的醋酸洋红染色、压片和镜检。根尖和幼穗的镜检均在Olympus BX-43显微镜下进行,分别观察体细胞染色体数目、统计花粉母细胞中染色体的配对情况并进行染色体构型分析。
1.2.2 原位杂交
(1)根尖处理:将M1005A的室内根尖经笑气(N2O)处理并用1.0%果胶酶和2.0% 纤维素酶混合酶处理,用分裂相良好的染色体制片。
(2)DNA提取:根据Cota-Sanchez等[21]CTAB法提取滨麦、华山新麦草、普通小麦7182及M11005A幼嫩叶片的全基因组DNA,并对用于制备基因组原位杂交探针的DNA进行纯化。
(3)原位杂交:基因组原位杂交(genomicin situhybridization,GISH)鉴定利用Fu等[22]方法,分别以滨麦、华山新麦草全基因组DNA为探针与M11005A的根尖染色体进行杂交。荧光原位杂交(fluorescenceinsituhybridization,FISH)鉴定采用寡核苷酸探针Oligo-pSc119.2(绿色)、Oligo-pTa535(红色)与体细胞染色体进行杂交,根据Tang等[23]方法进行。FISH-GISH同步鉴定以滨麦/华山新麦草全基因组DNA、Oligo-pSc119.2(绿色)、Oligo-pTa535(红色)为探针同时与体细胞染色体进行杂交。用Olympus BX-53荧光显微镜进行观察并用Adobe Photoshop CS6处理图像。
1.2.3 EST-STS和PLUG标记分析
通过分子标记分析,根据M11005A中是否有滨麦的特异条带来确定外源染色体同源群归属。本研究分别选取70对EST-STS、70对PLUG引物,分布于小麦的1~7部分同源群;其中,EST-STS引物来自网站http://wheat.pw.usda.gov/SNP/new/pcr_primers.shtml,PLUG引物来自Ishikawa等[24]发表的引物序列,引物均由北京奥科鼎盛生物技术有限公司合成。PCR反应体系(10 μL)为:1.0 μL 1×PCR Buffer(Mg2+),0.8 μL 2.5 mmol·L-1dNTPs,0.8 μL 5 μmol·L-1,0.06 μL引物,5 U·μL-1Taq DNA酶,1.0 μL 100~120 ng·μL-1DNA,6.34 μL ddH2O。反应程序为:94 ℃预变性3 min; 94 ℃变性30 s,50~60 ℃退火45 s,72 ℃延伸 60~90 s,32~35个循环;72 ℃终延伸5~10 min,4 ℃保存。PLUG总反应体系为20 μL,反应程序中变性时间为45 s,60 ℃退火45 s,延伸 2 min,循环38次,其余程序与EST-STS标记相同。PLUG的PCR产物用TaqI或HaeIII进行酶切[25]。PCR产物均用8%的变性聚丙烯酰胺胶进行电泳检测,银染、显影并照相,具体参照吴金华等[26]方法。
1.2.4 农艺性状调查
成株期调查农艺性状,包括株高、穗型、穗长和芒性,收获后考察千粒重等,根据李立会等[27]方法进行。M11005A与亲本间的差异显著性通过T检验来检测。
1.2.5 条锈病抗性鉴定
为了鉴定M11005A对条锈病的抗性,分别对苗期和成株期进行了小种鉴定,反应型(IT)分为6级标准[28],IT=0为免疫,IT=0;为近免疫,IT=1为高抗,IT=2为中抗,IT=3为中感,IT=4为高感。
(1) 苗期条锈病鉴定:苗期的抗条锈病鉴定于西北农林科技大学植物保护学院进行,将M11005A进行分小种鉴定,以感病品种辉县红作为对照,分别接种CYR29、CYR32及CYR34于供试材料上,接种15 d后,辉县红充分发病时,记录各材料的反应型,3 d后重复一次。
(2)成株期条锈病鉴定:3月下旬在田间接种CYR32和CYR33的混合条锈菌菌种,将感病对照辉县红诱发行喷上水雾,然后将孢子均匀地抖散到鉴定植株上,5月初至上旬当辉县红完全发病时,记录鉴定材料的反应型,7 d后重复一次。
2 结果与分析
2.1 细胞学鉴定
通过对M11005A的49个根尖细胞进行镜检,结果(图1a)显示,M11005A体细胞在有丝分裂中期染色体条数为44。在花粉母细胞(PMCs)的镜检中,观察并统计了123个花粉母细胞,平均染色体配对为21.6个二价和0.8个单价,无三价体或四价体(图1b)。在减数分裂后期I,M11005A同源染色体可以均等分离(图1c)。说明,M11005A具有高度稳定的细胞学和遗传学特性,初步推测其携带了一对滨麦染色体。
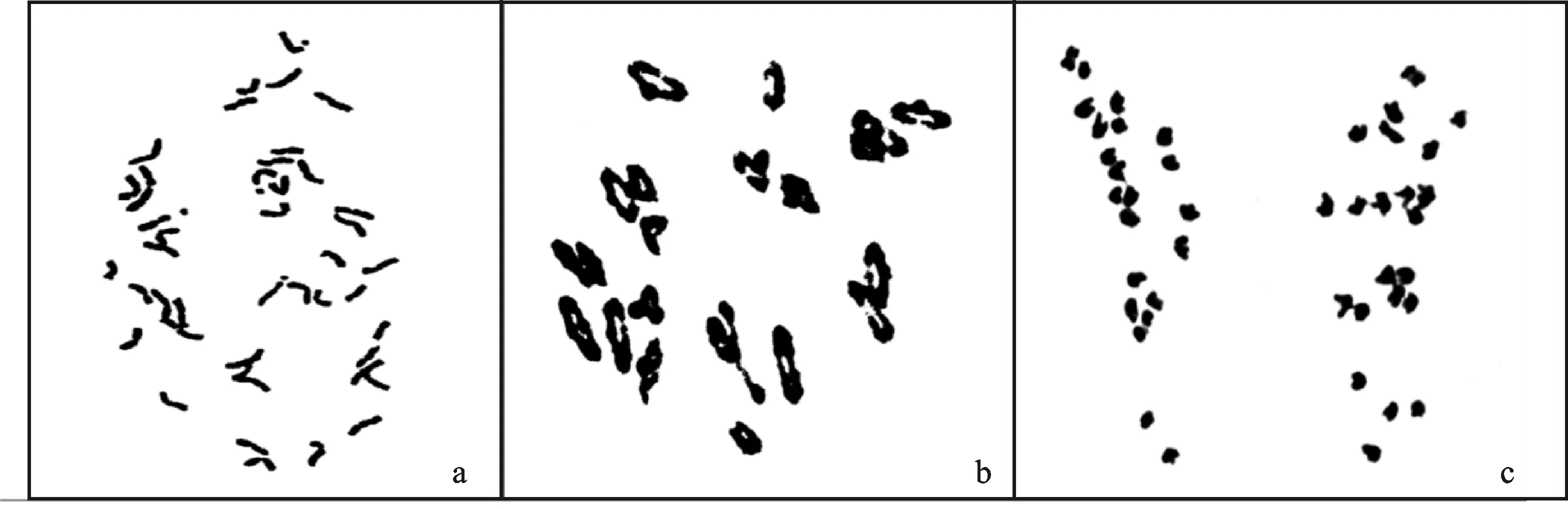
图1 M11005A有丝分裂中期(a)、减数分裂中期I(b)及减数分裂后期I(c)的染色体观察
2.2 GISH、FISH及FISH-GISH鉴定
以滨麦及华山新麦草全基因组DNA作为探针,分别与M11005A根尖染色体进行原位杂交,结果(图2)显示,M11005A有两条染色体被杂交上红色信号,而其余42条染色体均呈现为蓝色,表明M11005A附加了两条滨麦的Ns基因组染色体。分别以Oligo-pTa535、Oligo-pSc119.2为探针与亲本7182(图3a)和M11005A根尖染色体(图3b)进行荧光原位杂交,以滨麦或华山新麦草全基因组DNA为探针与M11005A染色体杂交,结果显示,M11005A的42条染色体的FISH信号与亲本7182的FISH信号相同,其余2条端部有相同红色信号的染色体在7182中找不到对应的FISH信号,推测这两条染色体为滨麦的一对染色体,FISH-GISH的结果与单独的FISH结果一致(图3c、图3d)。GISH、FISH、FISH-GISH结果表明M11005A附加了一对滨麦Ns基因组的染色体。

a:以滨麦全基因组DNA(红色)为探针与根尖染色体进行基因组原位杂交;b:以华山新麦草全基因组DNA(红色)为探针与根尖染色体进行基因组原位杂交;箭头所指为外源染色体(蓝色为DAPI复染)。
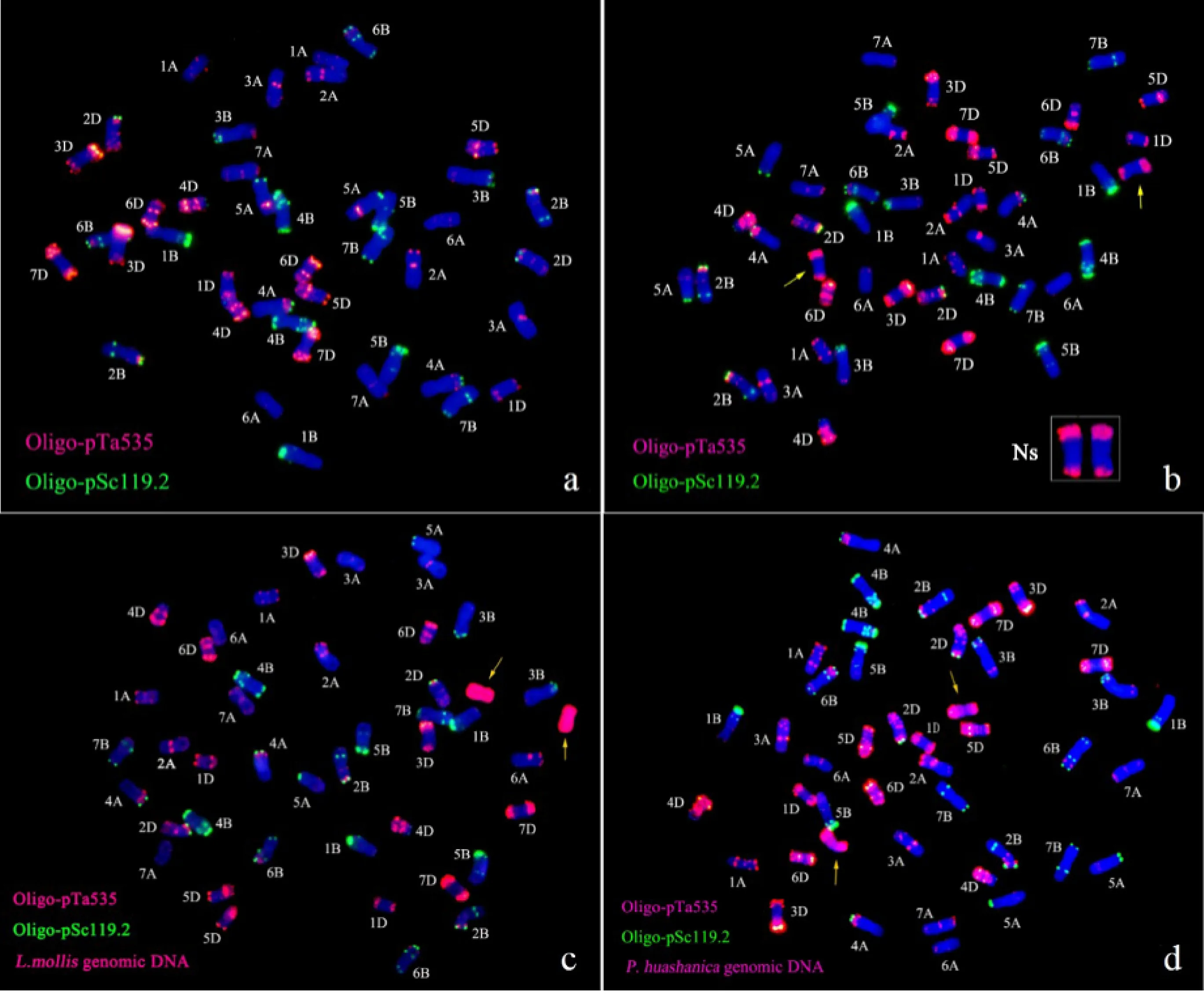
a:以Oligo-pTa535(红)、Oligo-pSc119.2(绿)、滨麦全基因组DNA为探针与普通小麦7182根尖染色体杂交;b:以Oligo-pTa535(红)、Oligo-pSc119.2(绿)为探针与M11005A根尖染色体杂交;c:以Oligo-pTa535(红)、Oligo-pSc119.2(绿)及滨麦全基因组DNA与M11005A根尖染色体杂交;d:以Oligo-pTa535(红)、Oligo-pSc119.2(绿)及华山新麦草全基因组DNA与M11005A根尖染色体杂交;箭头所指为外源染色体;蓝色为DAPI。
2.3 分子标记分析
利用分布在小麦1~7同源群的70个EST和70个PLUG分子标记对M11005A中附加的两条滨麦染色体的同源群归属进行分析。从中筛选出了8个EST特异标记(BM134465、CD373475、CD454742、CD454575、BF291730、BG263365、CD452844、BE637806)和6个PLUG特异标记(TNAC1301-TaqI/HaeIII、TNAC1326-TaqI/HaeIII、TNAC1252-TaqI、TNAC1644-TaqI/HaeIII、TNAC1286-TaqI、TNAC1291-TaqI)(表1),以上标记均在M11005A中扩增出了滨麦的特异性条带(图4和图5),且都位于小麦的第三部分同源群染色体上。在筛选出的这些特异标记中,有1个 EST标记CD452844(图4d)、4个PLUG标记TNAC1301-HaeIII(图5e)、TNAC1301-TaqI(图5f)和TNAC1326-HaeIII(图5g)和TNAC1644-HaeIII(图5h)均能在M11005A扩增出滨麦和华山新麦草的特异性条带。结果表明,M11005A中附加一对滨麦第三部分同源群染色体,将其命名为Lm#3Ns,故M11005A是一个小麦-滨麦Lm#3Ns二体异附加系。

表1 M11005A中附加的滨麦第三部分同源群染色体Lm#3Ns连锁的EST-STS及PLUG多态性标记Table 1 EST-STS and PLUG polymorphic markers located on the third homoeologous groups applied to linkage analysis of the Lm#3Ns
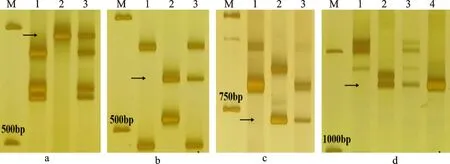
M:DL2000; 1:7182; 2:滨麦; 3:M11005A; 4:华山新麦草; a: CD454742; b: CD454575; c: BF291730; d: CD452844. 箭头为特异条带。
2.4 农艺性状调查
从株高、分蘖数、穗长、小穗数、小穗粒数、千粒重和芒性等农艺性状对M11005A、亲本7182、M42的成株期进行综合评价,结果(表2和图6)显示,M11005A的株高、分蘖数与亲本7182和M42差异显著,表现为矮秆,多分蘖;穗型、穗长、小穗数、穗粒总数及千粒重与亲本7182相近,表明M11005A有矮秆、多分蘖等优良农艺性状,可以作为小麦育种的中间材料。

M:DL2000; 1:7182; 2:滨麦; 3:M11005A; 4:华山新麦草. a: TNAC1326-TaqI;b: TNAC1291-TaqI; c: TNAC1252-TaqI;d: TNAC1644-TaqI; e: TNAC1301-HaeIII; f: TNAC1301-TaqI;g: TNAC1326-HaeIII; h: TNAC1644-HaeIII. 箭头为特异条带。

表2 M11005A,7182和M42的农艺性状调查Table 2 Agronomic traits of common wheat parent cultivar 7182,M42 and M11005A
2.5 苗期及成株期条锈病抗性鉴定
苗期对单个条锈菌小种CYR29、CYR32、CYR34的抗性鉴定结果(表3和图7 )表明,对照辉县红发病充分,M11005A苗期对三个小种均表现为高感(IT=4);亲本7182除了对CYR34表现为中抗以外,对CYR29、CYR32分别表现为高感和中感;亲本M42与M11005A的抗性基本相同,对CYR29均表现为高抗或免疫,对CYR32表现为中感。成株期对条锈菌混合小种CYR32和CYR33的反应结果(图8)表明,感病对照辉县红表现为高感(IT=4),亲本7182表现为中感(IT=3),滨麦和回交亲本M42表现为免疫(IT=0),M11005A为高抗(IT=1)。与苗期相比,M11005A和亲本M42在成株期对CYR32和CYR33混合小种表现为高抗,根据系谱分析,M11005A成株期对条锈病的抗性可能来源于亲本M42,追溯到滨麦的第三部分同源群染色体,即滨麦Lm#3Ns染色体。因此,推测滨麦Lm#3Ns上携带抗条锈病基因。
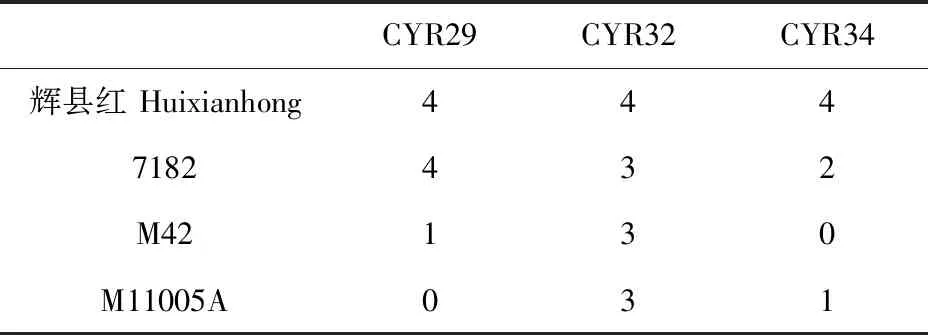
表3 M11005A苗期及其亲本对三种不同条锈菌小种的抗性Table 3 Identification of resistance to three different stripe rust race in the seedling stage of M11005A

a:植株;b:穗子;c:小穗及籽粒1:M42; 2:7182; 3:M11005A。

a:M11005A及其亲本对CYR29条锈小种的抗性鉴定; b:M11005A及其亲本对CYR32条锈小种的抗性鉴定。1:辉县红;2:7182; 3:M42; 4:M11005A。
3 讨 论
通过GISH和FISH可以识别小麦近缘种属与普通小麦远缘杂交后代中的外源染色体或者小片段[29],连续FISH-GISH可以在同一染色体制片上将外源染色体的FISH信号与GISH信号相对应[15,17],根据Yang等[16]的同步FISH-GISH技术,快速确定M11005A附加了一对滨麦Ns组染色体,提高了试验的准确性和效率,同时加快了对外源染色体和普通小麦染色体的识别,尤其是对易位系的鉴定。本研究通过比对M11005和亲本7182的FISH核型,明确了滨麦Lm#3Ns染色体与Oligo-pTa535探针杂交的FISH核型,为今后滨麦染色体FISH核型的揭示奠定了基础。
分子标记是在小麦背景中追踪和确定外源染色体部分同源群关系的有用工具,已经在卵穗山羊草、冰草、滨麦、华山新麦草、簇毛麦、长穗偃麦草、黑麦等近缘种属与小麦的衍生后代中得到广泛应用。通过EST及PLUG分子标记鉴定,从普通小麦的第三个部分同源群标记中筛选出8个EST-STS和6个PLUG标记,其中只有1个EST和4个PLUG标记在M11005A中均能清晰地扩增出滨麦和华山新麦草的特异性条带,大多数EST和PLUG标记扩增出的滨麦条带均不同于华山新麦草。结果表明了M11005A的外源染色体为滨麦的3Ns染色体,滨麦与华山新麦草的3Ns染色体存在一定的差异,滨麦与华山新麦草Ns染色体组之间的关系还需进一步证明。这些特异的标记可以作为一种快速、有效的工具来追踪后代中3Ns染色体,为进一步鉴定后代中滨麦外源片段及研究滨麦的基因组组成奠定基础。

1:辉县红; 2:7182; 3:滨麦; 4:M42; 5:M11005A。
条锈病是世界范围内最具毁灭性的病害之一。到目前为止,许多来自野生近缘种属的抗条锈病基因已经被导入普通小麦中[30-31]。近年来,将滨麦1~7不同部分同源群染色体的优良基因导入普通小麦中来提高抗条锈病等性状,在小麦育种中发挥了重要作用[12-14,17,32]。关于小麦近缘种属的第三部分同源群及Ns基因组的报道较多[15,17,33-35],在小麦3AL端部渗入了长穗偃麦草3E片段的重组株系增强了小麦体内的Na+“排斥”[36];Kang等[37]育成了高抗条锈病的小麦-华山新麦草渐渗系T3BL-3NsS;多重代换系05DM6有三对Ns染色体具有高抗条锈病特性[38];小麦-华山新麦草二体异附加系3Ns具有高抗条锈病[7];Pang等[13]创制了抗叶锈病的小麦-滨麦二体异代换系3D(3Ns#1);小麦-滨麦第三同源群单体附加系具有高抗条锈病特性[39]。本研究中,M11005A在苗期时与亲本M42对小种CYR29及CYR34都表现出良好的抗性,而亲本7182对CYR29却表现为高感,对CYR34表现为中抗,推测M11005A的3Ns染色体上可能携带了对条锈菌小种CYR29的抗性基因;M11005A与亲本M42在苗期对CYR32表现为中感。在成株期,二者对CYR32和CYR33的混合小种分别表现为高抗和免疫,由此可以推测3Ns染色体上携带了对CYR32和CYR33小种的成株期抗性基因。推测小麦近缘种属第三部分同源群上携带了诸多可以用于改良小麦的基因。
二体异附加系不仅为研究物种的起源和进化、染色体同源关系、基因定位、基因克隆、基因表达和相互作用提供了桥梁,而且还可以用于创制外源染色体代换系和易位系[40]。与附加系和代换系相比,因为小片段易位系可以被直接利用,因此育种家更倾向于易位系的创制和利用[41]。Fu等[42]创制了绵阳11和4R二倍体小麦-黑麦T4RS-5DS·5DL和T5DS-4RS·4RL易位系。Du 等[43]从黑麦的6RLKu微染色体中创制了小麦-黑麦6D/6RLku的小片段易位系。Zhang等[44]利用具有高抗条锈病的中国春-簇毛麦3V附加系和普通小麦中国春杂交产生了小麦-簇毛麦高抗条锈病渗入系CD-3。利用60Coγ辐射[45],杀配子染色体[46]和中国春ph1b[32]能有效地引起染色体变异。M11005A的多分蘖、矮秆、抗条锈病等优良性状,具有改良小麦育种的应用潜力,因此可以通过上述方法对M11005A进行处理,用来创制具有抗条锈病基因的渐渗系或小片段易位系,并通过连续回交和自交,以获得高抗条锈病等优良性状的新种质。

