颈动脉重度狭窄患者斑块最大厚度对颈动脉支架成形术后再狭窄预测价值研究
胡利刚 唐景峰 张 洁 唐建勋
桂林医学院第二附属医院,广西 桂林 541199
颈动脉是头面部及脑部主要供血动脉,调查显示重度颈动脉狭窄者虽有效药物治疗后仍有26%的患者在2 a内有发生脑缺血的风险。高脂饮食、吸烟、人口老龄化等原因导致颈动脉狭窄的发生率明显上升,脑卒中已成为仅次于心脏病及肿瘤的第三位致死性疾病,同时该病的致残率也较高。在所有可引起缺血性脑卒中的疾病中,因颈动脉粥样硬化斑块脱落或血栓脱落而诱发的颅内动脉栓塞占据了相当大的比例,据统计临床上60%的缺血性脑卒中因颈动脉狭窄引起[1]。颈动脉支架成形术(CAS)因具有创伤小、适用范围广、安全性高等优势而逐渐在临床上得到广泛的应用,目前该技术已成为颈动脉狭窄性疾病的常用疗法之一,该术式的整体疗效及并发症发生率均与颈动脉内膜切除术相当[2]。但CAS术后再狭窄是颈动脉支架置入治疗不可回避的问题,据统计CAS术后出现狭窄程度超过70%的再狭窄的发病率为3%~28%[3]。颈动脉术后再狭窄的发生机制较为复杂,病理类型繁多且与不同发生时间机制有所不同,对于术后1周内出现血栓者多因手术操作不当所致,同时血小板的电荷间吸引作用使其容易在支架内表面聚集而形成微血栓。术后2 a内出现再狭窄者则多因支架口径选择过大引起异物刺激导致局部动脉内膜增生加速所致。对于术后2 a后出现再狭窄者则主要是因患者长期未规范服用药物导致病情进展,支架内脂质沉积、纤维增生所致。目前关于颈动脉支架成形术后再狭窄影响因素方面的研究已有报道,主要有性别、糖尿病、高脂血症、术者经验、支架类型等,但关于颈动脉重度狭窄患者斑块最大厚度对颈动脉支架成形术后再狭窄预测价值方面的研究较少[4],根据颈动脉狭窄程度、斑块大小、厚度、性质而选择合适的治疗方式是提高CAS术后再狭窄治疗效果的重要环节,因此本研究旨在通过分析颈动脉重度狭窄患者斑块最大厚度对颈动脉支架成形术后再狭窄预测价值,以期为此类患者临床治疗方案的选择提供参考依据。
1 资料与方法
1.1一般资料选择2016-02—2019-10在桂林医学院第二附属医院行CAS治疗的患者171例进行研究。纳入标准:(1)颈动脉狭窄程度≥75%,符合CAS手术条件者;(2)凝血功能正常;(3)经CT、MRI等影像学检查除外脑出血、脑梗死及其他严重的颅内疾病患者;(4)彩色多普勒超声、数字减影血管造影(DSA)、MRI等影像学资料齐全,可清晰分析颈动脉斑块厚度者;(5)患者神志清醒,可配合进行相关治疗及检查;(6)患者已知情同意。排除标准:(1)术后随访不足6个月者;(2)严重肝肾功能不全或其他脏器重症疾病者;(3)既往有CAS手术史的患者;(4)既往有颅内肿瘤放疗史的患者。本研究171例患者中33例(19.30%)出现支架内再狭窄,其中7例患者管腔直径缩小50%及以上。再狭窄组与未狭窄组患者性别、年龄、体重指数(BMI)、基础病史比较差异均无统计学意义(P>0.05)。见表1。
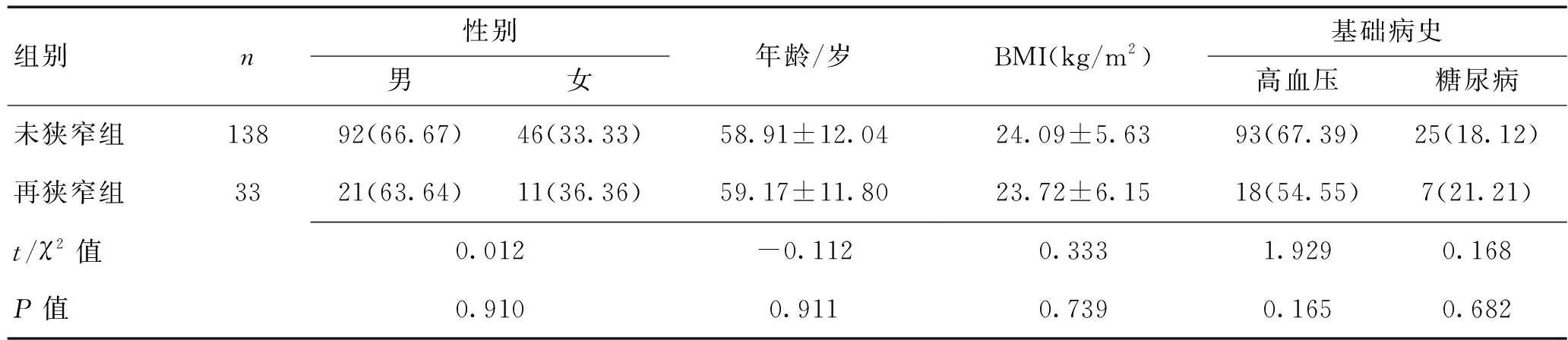
表1 2组患者一般情况比较
1.2方法(1)术前资料的收集:术前收集患者颈动脉CTA、MRI等影像学资料,患者均由同一组具中级以上技术职称,并具5 a以上临床经验的医生采用荷兰飞利浦公司生产的IE33型彩色多普勒超声,探头频率为7.5 MHz,对患者颈总、颈内动脉粥样硬化情况进行检查,测量颈总动脉粥样硬化斑块切面最厚部分进行3次测量,以平均值作为斑块最大厚度。(2)CAS术:患者均由同一组具5 a以上临床经验医师参照《2007年颈动脉支架成形术专家共识》[5]进行手术,视患者病情选择合适的支架型号及其配套球囊与保护伞。在围术期及术后6个月给予阿司匹林肠溶片(由拜耳医药保健公司生产,批准文号:国药准字H20120235,规格100 mg/片)100 mg口服,1次/d;硫酸氢氯吡格雷片(由赛诺菲(杭州)制药有限公司生产,批准文号:国药准字J20180029,规格75 mg/片)75 mg口服,1次/d。有阿司匹林使用禁忌者则给予负荷剂量氯吡格雷(300 mg/d)。(3)术后血管狭窄评价标准:参照文献[6-7]方法要求患者术后6个月回院行DSA检查对支架情况进行判断,以管腔直径较CAS术后缩小30%以上则认为存在轻度的支架内狭窄,管腔直径缩小50%以上则视为明显的支架内再狭窄,本研究中管腔直径缩小30%均认为存在支架内再狭窄。根据患者术后6个月有无出现支架内再狭窄将患者分为2组,比较2组管腔缩小率及颈动脉斑块最大厚度,并对管腔缩小率与颈动脉斑块厚度进行相关性分析,以ROC法判断颈动脉斑块厚度对CAS术后再狭窄的预测价值。
2 结果
2.12组管腔缩小率及颈动脉斑块最大厚度比较再狭窄组管腔缩小率及颈动脉斑块最大厚度均明显大于未狭窄组(P<0.05)。见表2。
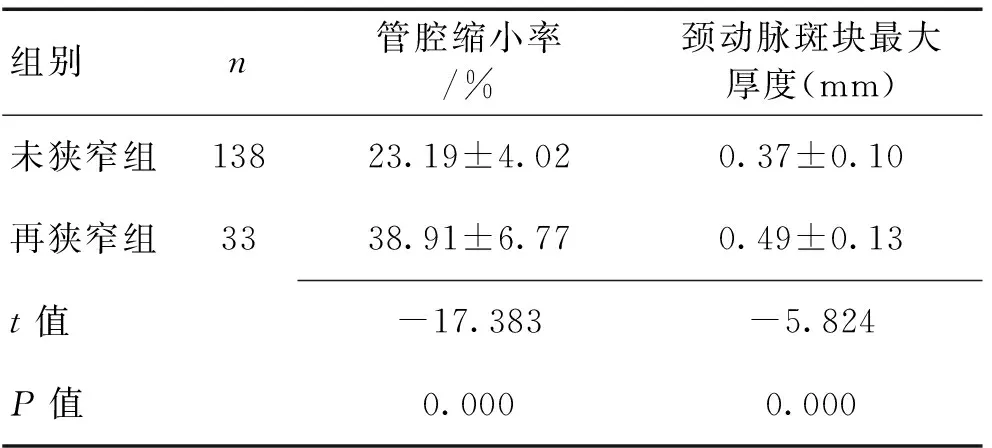
表2 2组管腔缩小率及颈动脉斑块最大厚度比较
2.2CAS管腔缩小率及颈动脉斑块最大厚度相关性分析相关性分析显示,CAS术后管腔缩小率与颈动脉斑块最大厚度呈显著的正相关关系(r=0.574,P=0.000),见图1A。
2.3ROC分析ROC曲线分析显示颈动脉中毒狭窄患者斑块最大厚度对CAS术后再狭窄诊断截断值为0.437mm,AUC为0.841,P=0.000,敏感度为81.8%,特异性为86.2%,见图1B。
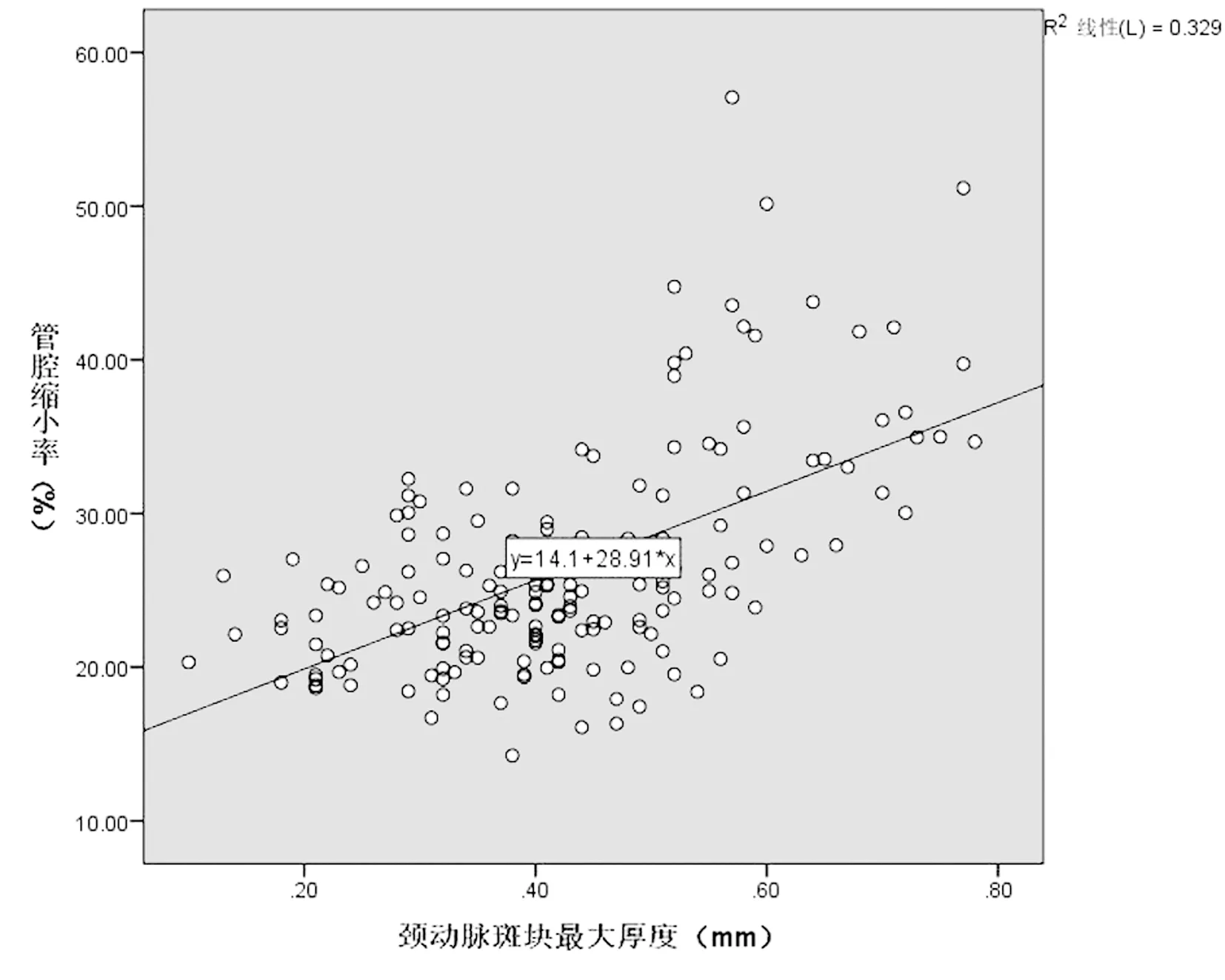
图1 A:CAS管腔缩小率及颈动脉斑块最大厚度相关性分析Figure 1 A:Correlation analysis of CAS lumen reduction rate and carotid plaque maximum thickness

图2 ROC分析Figure 2 ROC analysis
3 讨论
缺血性脑卒中为人类死亡的重要原因,据统计每年脑卒中的发病率以8.7%的速度上升,由此而带来400多亿人民币的经济负担,对于颈动脉狭窄程度75%以上者,5 a内缺血性脑卒中发生率为30%~37%,因此对颈动脉狭窄进行干预对于缺血性脑卒中的预防具有重要的作用[8]。目前对于颈动脉狭窄的治疗方法主要有内科保守治疗及手术治疗,随着血管内治疗及支架技术的发展,CAS技术在神经血管狭窄治疗中逐步得到推广,自从20世纪80年代末期美国学者SIGWART首次将血管内金属支架用于冠状动脉狭窄的治疗以来,支架治疗在血管狭窄性疾病中的治疗中逐步得到应用[9-11]。大量研究证实CAS对于颈动脉狭窄有确切的疗效,同时因该疗法创伤小、术后护理方便、恢复快等优势使越来越多的医师及患者选择CAS术进行治疗[12]。
随着CAS术临床应用的增加发现该术式术后再狭窄的发生率较高,术后再狭窄早期多无特异性表现,但其可能对CAS术的安全性及有效性造成不良的影响,因此临床上多采用氯吡格雷或阿司匹林以预防CAS术后再狭窄的发生。但患者一旦出现症状性再狭窄,药物治疗已难以控制,多需采取再次颈动脉支架置入术、血管成形术等手术方法进行治疗,因此临床上若能在再狭窄早期尚未出现临床症状时对CAS术后再狭窄进行预测可有效减少二次手术率。本研究显示,171例患者中33例(19.30%)出现支架内再狭窄,其中7例患者管腔直径缩小50%及以上,与相关研究结果相一致[13-15]。颈动脉出现再狭窄与多种脑血管事件的发生密切相关,CAS术后再狭窄受操作技术、术后规范抗血小板治疗、支架类型等多方面因素有关,为排除上述因素对本研究结果的影响,本研究患者均由同一组具 5 a以上临床经验的医护人员进行手术,围术期及术后均采用相同的方案进行抗血小板治疗。除上述因素外颈动脉斑块性质也被证实与CAS术后的再狭窄有关,但关于颈动脉斑块最大厚度与CAS术后颈动脉狭窄的关系方面的研究较少[16]。本研究显示,再狭窄组管腔缩小率及颈动脉斑块最大厚度均明显大于未狭窄组(P<0.05),且相关性分析结果显示CAS术后管腔缩小率与颈动脉斑块最大厚度呈显著的正相关关系(r>0,P<0.05),可能因CAS术中所置入的支架实质上为一类特殊的金属,其具有一定的疲劳性,置入体内后经长时间不对称的斑块挤压后可导致支架出现疲劳及变形,使其原有的扩张血管作用受损而导致患者出现术后再狭窄[17]。进一步经ROC分析显示,ROC曲线分析结果显示颈动脉重度狭窄患者斑块最大厚度对CAS术后再狭窄诊断截断值为0.437 mm,AUC为0.841,P=0.000,敏感度为81.8%,特异性为86.2%,提示当斑块最大厚度超过0.437 mm时CAS术后患者出现再狭窄的风险明显更高。目前临床上大部分患者所采用的的自膨式支架,该支架横截面均为规则的对称性结构,而厚度较大的斑块因纤维结缔组织增生或脂质沉淀等原因导致在支架撑开时斑块更易脱落,加上重度狭窄患者动脉管壁的顺应性较差,在支架撑开后无法完全与狭窄的管壁贴合,同时CAS术中可对动脉血管内壁造成一定的挤压而使支架周围更易出现血栓形成再狭窄[18-19]。虽然CAS术与其他术式相比创伤较小,但仍为创伤性治疗手段,对于重度狭窄的患者,支架周围出现风险更高,虽然脑保护装置的使用可一定程度降低脑卒中的发生率,但长期的应力挤压及血栓形成机化可导致支架寿命缩短而增加再狭窄的风险。
颈动脉重度狭窄患者斑块最大厚度与CAS术后管腔缩小率呈正相关关系,斑块最大厚度>0.437 mm患者再狭窄的风险较大。基于以上结果建议对于斑块最大厚度在0.437 mm以上的患者选择手术方式时应慎重血肿CAS术,可视患者病情选择颈动脉内膜切除术,同时手术风险高、难度大,对此类患者进行治疗时应注意手术的实施时机。本研究仍存在一定的不足,因本研究为单中心研究,样本量较小且选择的指标较单一,取得的结果可能存在一定的偏差,下一步本笔者团队将采取多中心、增加样本量的研究以进一步证实本研究结果。

