AXL表达与乳腺癌预后及临床病理特征关系的Meta分析
李娜,宋若飘,贾友超,臧爱民
(1.河北大学临床医学院,河北 保定 071000;2.河北省肿瘤放化疗机制与规程研究重点实验室,河北 保定 071000;3. 河北大学附属医院肿瘤内科,河北 保定 071000)
乳腺癌是全球女性最常见的恶性肿瘤之一,每年约有63万女性死于乳腺癌[1]。其中受体状态是乳腺癌评估的重要标准,雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)与人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)阳性的患者可接受靶向治疗[2-3]。而三阴性乳腺癌恶性度高,缺乏有效的治疗靶点,易转移、耐药,目前仍以化疗为主要手段,预后不良[4-5]。近年来,AXL抑制剂在乳腺癌中的研究获得了重要进展,Leconet等[6]发现在AXL高表达的三阴性乳腺癌患者异种移植(patient-derived xenograft,PDX)模型中,加入抗AXL抗体20G7-D9可阻断AXL下游的信号通路,抑制肿瘤的生长和骨转移。Liu等[7]发现,AXL高表达也是HER-2阳性和ER阳性乳腺癌继发耐药的重要表型,在耐药细胞系中加入AXL多靶点小分子抑制剂GSK1363089(foretinib),可恢复耐药细胞对曲妥珠单抗及帕妥珠单抗的敏感性。目前已有AXL多靶点小分子抑制剂被批准用于转移性肾透明细胞癌[8],且很多抑制剂正处于临床、临床前试验阶段,其中Ⅰ型抑制剂BGB324(R428)已进入非小细胞肺癌(NCT02872259)、胰腺癌(NCT03824080)和三阴性乳腺癌(NCT02922777)临床Ⅰ/Ⅱ期试验。以AXL为靶点的治疗有望成为一项新的抗肿瘤策略。AXL异常表达对肿瘤患者预后评价作用的研究在胰腺癌[9]、非小细胞肺癌[10]、肝细胞癌[11]等多种肿瘤逐渐增多,而AXL表达与乳腺癌预后及临床病理特征的相关性存在一定争议。为探讨AXL异常表达在乳腺癌预后及临床病理特征中的意义,本研究主要针对公开发表的AXL表达与乳腺癌预后的研究数据进行Meta分析,以期为乳腺癌临床治疗、判断预后拓展新途径。
1 资料与方法
1.1 纳入标准
研究对象为病理诊断证实、未接受放化疗、病理资料完整的乳腺癌组织。采用免疫组织化学法(immunohistochemistry,IHC)检测AXL蛋白的表达。结局指标包括:生存资料,如总生存期(overall survival,OS)、无复发生存期(relapse free survival,RFS)、无疾病生存期(disease free survival,DFS)的风险比(hazardratio,HR)及95%CI;临床病理资料,如AXL表达与乳腺癌年龄、临床分级、组织分级、淋巴结转移、ER表达、PR表达及HER-2表达的关系。
1.2 排除标准
(1)重复发表的研究;(2)非乳腺癌或未检测AXL表达水平的文献;(3)综述和会议摘要;(4)未采用免疫组化检测AXL表达水平的文献;(5)无生存结局的研究。
1.3 文献检索策略
在中国知网(CNKI)、万方医学网(Wanfang Data)、Cochrane Library、Embase、PubMed和Medline数据库中系统筛查有关AXL表达与乳腺癌预后的研究,检索时限均为从建库至2019年10月。中文检索词包括:AXL、AXL受体酪氨酸激酶、AXL蛋白、乳腺癌、乳腺肿瘤、预后。英文检索词包括:“AXL receptor tyrosine kinase”“AXL protein”“breast cancer”“breast neoplasms”“breast tumor”“prognosis”“prognostic”“outcome”“survival”。
1.4 文献筛选及资料提取
由2名研究者按照纳入与排除标准独立筛选文献、提取资料和评价纳入研究的偏倚风险。如遇分歧,通过讨论解决或交由第三人裁定。提取资料的内容包括:(1)纳入研究的基本信息,研究题目、第一作者、时间、样本量等;(2)乳腺癌的临床病理特征,研究对象的基线特征、组织分级、临床分期、有无淋巴转移等。
1.5 文献质量评分
由2名研究者根据纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS) 评分标准[12]评价纳入研究的质量。如遇分歧,通过讨论解决或交由第三人裁定。评分原则:(1)暴露组是否真正具有代表性1分;(2)非暴露组是否来自同一人群1分;(3)暴露因素的确定方法是否清楚1分;(4)研究起始时是否确定要观察的结局指标1分;(5)设计和统计分析时是否考虑具有可比性2分;(6)研究对于结果评价是否充分1分;(7)结果发送后随访是否够长1分;(8)暴露组和非暴露组的随访是否充分1分。
1.6 Meta统计分析
采用REvMan 5.3.0软件对纳入文献的数据进行统计分析,以HR及95%CI评价AXL表达与乳腺癌生存数据的关系,以比值比(odds ratio,OR)和95%CI评估AXL表达与乳腺癌临床病理参数的关系。应用I2检验对各研究结果进行异质性检验,若P≥0.1且I2≤50%,说明各研究间异质性较小,采用固定效应模型进行统计合并。 若P<0.1或I2>50%,说明各研究间异质性较大,采用随机效应模型减少异质性对结果的影响。P<0.05认为差异有统计学意义。最后,采用Stata 12.0软件进行发表偏倚及敏感性分析。统计检验均采用双侧检验。
2 结果
2.1 纳入文献特征
初检共获得相关文献273篇,经逐层筛选,最终纳入7篇,包括乳腺癌组织共933例, AXL阳性表达率26.42%~56.67%。其中1篇为中文研究,6篇为英文研究。文献筛选流程及结果见图1。纳入研究的基本特征及质量评分见表1。

图1 纳入文献提取过程

表1 纳入研究的基本特征及质量评分
2.2 Meta分析结果
2.2.1 AXL表达与乳腺癌OS、RFS、DFS关系
共7篇研究[13-19]报道了AXL表达与乳腺癌患者OS的关系,纳入样本量为933例。2组间异质性差异无统计学意义(I2=16%),故采用固定效应模型合并,结果显示:AXL表达阳性组乳腺癌患者生存期更短,差异有统计学意义(HR=2.36,95%CI1.60~3.46,P<0.0001,图2)。关于AXL表达与乳腺癌患者RFS的研究,共纳入2篇文献,546例样本,2组间存在高异质性(I2=81%),采用随机效应模型合并。AXL表达与DFS的研究,纳入3篇研究,163例样本。2组间异质性差异无统计学意义(I2=46%),故采用固定效应模型合并。结果提示,AXL表达与RFS、DFS无统计学意义的关联(HR= 1.99,95%CI0.70~5.61,P=0.20,见图3;HR=2.39,95%CI0.90~6.35,P=0.08,见图4)。

图2 AXL表达与乳腺癌OS的Meta分析

图3 AXL表达与乳腺癌RFS的Meta分析

图4 AXL表达与乳腺癌DFS的Meta分析
2.2.2 AXL表达与乳腺癌临床病理参数的关系
分别从乳腺癌组织年龄、临床分期、组织分级、有无淋巴结转移及ER、PR、HER-2表达几方面分析与AXL蛋白的表达之间的关系[13-16],结果如下:AXL表达与乳腺癌组织年龄(OR=1.30,95%CI0.94~1.81,P=0.12)、临床分期(OR=0.78,95%CI0.28~2.19,P=0.63)、组织分级(OR=1.04,95%CI0.57~1.87,P=0.90)、有无淋巴结转移(OR=1.08,95%CI0.80~1.46,P=0.61)、ER表达(OR=1.36, 95%CI0.92~2.00,P=0.12)、PR表达(OR=1.54,95%CI0.83~2.88,P=0.17)、HER-2表达(OR=0.94,95%CI0.56~1.58,P=0.82)等方面,无统计学意义的关联(图5—11、表2)。

图5 AXL表达与乳腺癌年龄的Meta分析

图6 AXL表达与乳腺癌临床分期的Meta分析

图7 AXL表达与乳腺癌组织分级的Meta分析

图8 AXL表达与乳腺癌有无淋巴结转移的Meta分析

图9 AXL表达与乳腺癌ER表达的Meta分析

图10 AXL表达与乳腺癌PR表达的Meta分析

图11 AXL表达与乳腺癌HER-2表达的Meta分析

表2 AXL表达与乳腺癌临床病理参数的Meta分析
2.2.3 发表偏倚及敏感性分析
对纳入的7篇文献,进行漏斗图分析,判断OS的研究中是否存在发表偏倚,Begg’s图显示漏斗图比较对称(图12)。进一步的Egger’s test 和Begg’s test检验分析显示,纳入研究没有发表偏倚(Egger’s test,Pr>|z|=0.053;Begg’s test,Pr>|z|=0.133)。逐一剔除单个研究通过森林图进行敏感性分析,评估各项研究对合并结果的影响,显示Meta分析结果稳定可靠(图13)。由于RFS和DFS的研究数量太少,定性和定量检测的敏感度很低,因此没有评估RFS和DFS的发表偏倚及敏感性。

图12 AXL表达对乳腺癌患者总生存期影响的Begg’s漏斗图
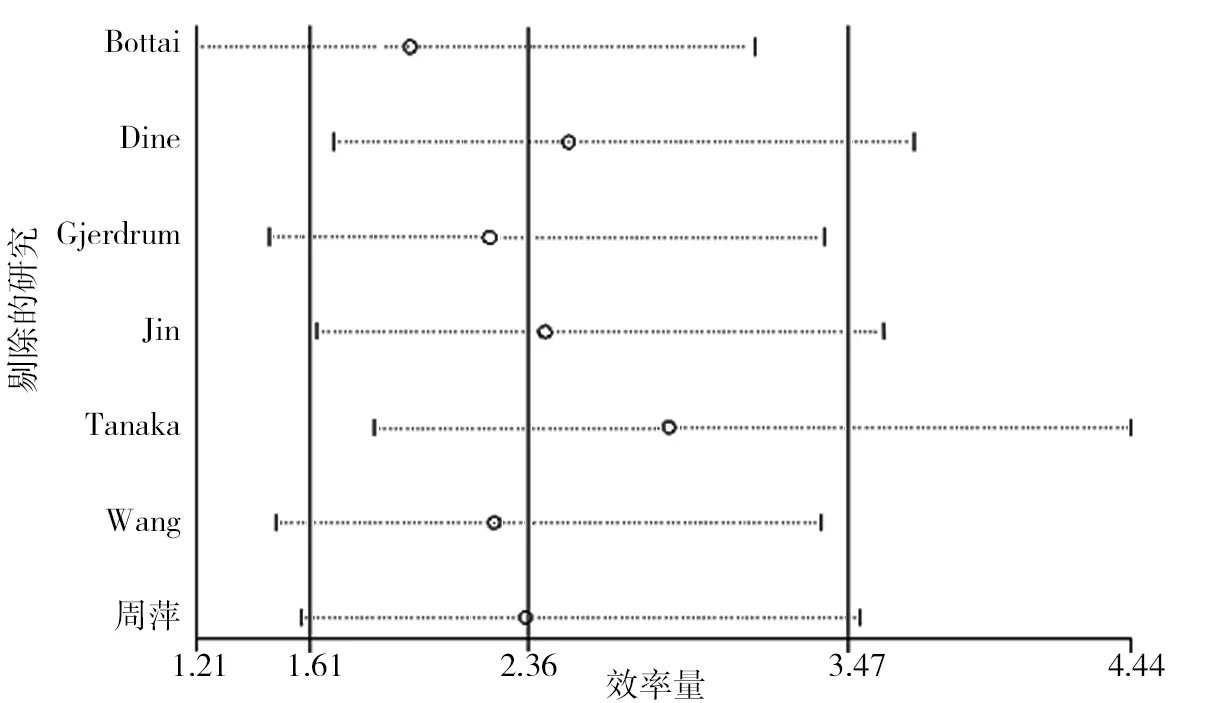
竖线(左)95%CI下限,竖线(中)HR估算值,竖线(右)95%CI上限。图13 AXL对乳腺癌患者总生存期影响的敏感性分析
3 讨论
AXL为大小约 140 ku 的跨膜分子,是受体酪氨酸激酶(receptor tyrosine kinase, RTKs)家族的成员之一。其分子结构由胞外结构区(氮端)、跨膜区和胞内激酶区(碳端)3部分组成[20]。AXL主要通过胞外结构区结合配体生长停滞特异性基因6(growth arrest specific gene 6,Gas6)发生受体二聚化及胞内酪氨酸残基的磷酸化,激活酪氨酸激酶的活性,调节下游信号通路,发挥促癌作用[21-23]。已有研究证实,AXL在许多肿瘤中高表达,不仅可以促进肿瘤细胞的侵袭、转移和化疗耐药,还在调节肿瘤细胞肿瘤微环境和免疫应答中发挥重要作用[24-25]。现有研究表明,肿瘤组织中AXL的表达与乳腺癌的预后及临床病理参数的关系存在争议。
虽然Zhang等[26]在关于AXL与人类实体瘤的Meta分析中表明,AXL的高表达与肝细胞癌、食管癌和非小细胞肺癌的OS下降有关,与乳腺癌的OS和DFS无关。但不是针对乳腺癌的研究,存在乳腺癌相关研究纳入数量较少的情况。Tanaka等[13]的研究中,虽然没有发现单独的AXL表达与乳腺癌患者预后的相关性,但提示了AXL和波形蛋白(vimentin)的共表达是乳腺癌患者总生存期缩短的重要影响因素。同时Gjerdrum等[14]、Bottai等[15]的研究结果均表明,AXL高表达是乳腺癌患者不良预后的独立影响因素。本文Meta结果显示,AXL在乳腺癌中的异常表达与OS下降有关,与RFS和DFS无关。对于本次纳入OS的研究,进行了异质性分析、发表偏倚及敏感性分析,均提示差异无统计学意义,提示本次结果分析稳定可靠。然而,对 RFS和DFS 进行分析时, 纳入研究个数较少,结果提示差异无统计学意义,有待进一步研究证实。
AXL在侵袭性强、恶性度高的肿瘤细胞系中表达更高[27]。近年来也有研究证实,AXL在乳腺癌中可通过激活下游丝氨酸/苏氨酸蛋白激酶即蛋白激酶B(protein kinase B,PKB/Akt)信号通路,诱导肿瘤上皮间质转化(epithelial mesenchymal transition, EMT),促进肿瘤细胞的侵袭转移[19]。并且,AXL在三阴性乳腺癌中,可通过影响高尔基体在肿瘤细胞迁移方向的极化定位,控制细胞的定向迁移[28]。而AXL的表达与乳腺癌患者的临床病理参数的关系存在争议。2001年,Berclaz等[29]研究发现,AXL在乳腺癌中的表达与肿瘤大小、淋巴结转移、PR、HER-2的表达均无相关性,而与肿瘤分期和ER的表达明显相关。Gjerdrum等[14]进一步研究发现,AXL在乳腺癌转移灶中的表达高于原发灶,但其表达与乳腺癌肿瘤直径大小、组织学分级、有无淋巴结转移及受体状态均无关。Bottai等[15]则发现AXL在发生淋巴结转移或远处转移的组织中高表达,但与乳腺癌肿瘤大小和临床分期无相关性。本文的Meta结果显示,AXL在乳腺癌中的异常表达与乳腺癌患者的年龄、临床分期、组织分级、淋巴结转移、激素受体和HER-2受体的表达均无关。但纳入关于临床病理参数的研究较少,此结果有待更多大型的队列研究予以验证。
本研究的局限性:(1)本研究没有排除AXL阳性判断标准不完全一致的研究,增加了研究的异质性。(2)由于本研究主要针对AXL表达对乳腺癌预后影响的文献进行生存及临床病理相关性分析,部分结局指标纳入研究数量过少,此研究需开展更多大样本、高质量的研究加以验证。(3)乳腺癌的不同的病理分型、生物学特征存在一定差异,由于纳入研究未提供AXL表达与各病理亚型的数据,无法进行此部分的合并分析。
综上所述,本次 Meta 分析结果显示,AXL的阳性表达与乳腺癌患者预后不良有关,是乳腺癌个体化治疗的潜在分子标志物。

