安肠组方对急性放射性肠炎模型大鼠肠黏膜的保护作用及机制研究※
孙云川 何新颖 胡秀茹 梁 伟 毕建强 胡婷婷 黄如敬 贾大鹏 赵建勇
(河北省沧州中西医结合医院放化疗科,河北 沧州 061001)
放射性肠炎是下腹、盆腔等恶性肿瘤放疗后的主要并发症,病变可累及直肠、大肠、小肠。研究表明,电离辐射导致肠组织内产生的活性氧(ROS)可调节相关凋亡蛋白表达,包括B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)等,从而诱导肠黏膜细胞凋亡,是放射性肠炎形成的重要机制[1-2]。此外,ROS可诱发促炎因子的表达和释放,其中核转录因子κB(NF-κB)被认为是核心因子,是黏膜炎产生的“开关”[3-4]。目前,西医治疗主要采用手术、营养支持及对症处理,远期疗效尚不满意[5]。前期研究显示,安肠组方可明显改善放射性肠炎患者临床症状[6-7]。本研究通过观察安肠组方高、中、低剂量药液对X线直线加速器诱导的急性放射性肠炎大鼠的一般情况、肠组织ROS水平、NF-κB、大肠黏膜上皮细胞Bcl-2和Bax的影响,探讨安肠组方改善急性放射性肠炎症状的可能机制。
1 材料与方法
1.1 实验动物 健康SPF级SD大鼠48只,6~8周龄,体质量220~240 g,由天津肿瘤医院实验动物中心提供[许可证号:SYXK(津)2017-0005]。饲养环境:室温20~25 ℃,相对湿度40%~70%,大鼠自由活动,自由饮水,喂以普通鼠食。
1.2 药物制备 安肠组方药物组成:生地榆30 g,白头翁15 g,黄连5 g,白术15 g,茯苓15 g,仙鹤草30 g,木香9 g,炒白芍12 g,甘草6 g。中药饮片均由河北省沧州中西医结合医院中药房提供,参照文献[8]制备分别含生药3.285、6.569、13.138 g/mL的安肠组方药液。
1.3 试剂及仪器 试剂:兔单克隆抗体Bcl-2(批号ab59348)、Bax(批号ab77566)、甘油醛-3-磷酸脱氢酶(GAPDH)(批号ab8245),购自英国Abcam公司;ROS、NF-κB酶联免疫分析试剂盒、苏木素-伊红(HE)染色试剂盒、BCA蛋白浓度试剂盒,购自上海碧云天生物技术有限公司。仪器:Precise直线加速器(瑞典医科达公司);721可见光分光光度计(上海精密仪器仪表公司);Nikon-176074光学显微镜(日本Nikon公司);5417D台式高速离心机(德国Eppendorf公司);TP1020自动组织脱水处理机、RM2135石蜡切片机、HI1220烘片机、EG1160组织包埋机(德国Leica公司) 、DYY-7C电泳仪(北京六一生物科技有限公司)。
1.4 实验方法
1.4.1 分组 采用随机数字表法将48只大鼠分为正常对照组8只,模型对照组、安肠组方高剂量组、安肠组方中剂量组、安肠组方低剂量组各10只。
1.4.2 造模 全部大鼠经适应性饲养7 d后,禁食12~14 h,除正常对照组外,其余均予3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,以仰卧位固定至手术板上,以直线加速器给予全腹部X线照射(从剑突至耻骨联合),照射面积8.5 cm×7.5 cm,其余部位用5 cm厚铅板遮挡,源皮距100 cm,总照射剂量为9 Gy,放射剂量率为300 cGy/min,照射时间约3 min。造模成功标准:受照射大鼠出现进食减少,出现大便性状改变(如黏液便、便血)等放射性损伤症状[9]。
1.4.3 给药 照射后第2 d,根据人与动物体表面积换算法[10]确定每只大鼠灌胃的原药剂量。各组灌胃容积均为10 mL/kg,安肠组方低、中、高剂量组分别予32.85、65.69、131.38 g/kg的安肠组方药液灌胃,其中低剂量为临床等效剂量;模型对照组、正常对照组均以等容积0.9%氯化钠注射液灌胃。每日1次,连续灌胃30 d。
1.5 观察指标及方法
1.5.1 大鼠一般情况及体质量变化 灌胃期间,每日观察各组大鼠的精神状态、进食水情况、排便情况;各组大鼠每4 d称取1次体质量。
1.5.2 大鼠结肠病理组织学变化 灌胃结束后禁水食1 d后,采用颈椎脱臼法处死大鼠,剪取全结肠,解剖显微镜下观察结肠大体形态,沿肠系膜纵轴剪开肠腔,冰0.9%氯化钠注射液冲洗干净后平展于过滤纸上,滤纸吸干水分,称其湿质量。将结肠组织分为2部分,第1部分,用0.9%氯化钠注射液迅速冲净后,经10%的中性甲醛溶液[以磷酸缓冲盐溶液(PBS)配制]固定后,常规脱水、浸蜡、透明、包埋,4 μm厚度切片,进行HE染色。光镜下观察其病理学变化。第2部分,将剩余的结肠组织再分为3部分装入锡箔纸后,迅速置于液氮中,然后转入-80 ℃冰箱保存备用。
1.5.3 酶联免疫吸附法检测结肠组织ROS、NF-κB含量 取部分肠组织,经PBS清洗后,剪碎并称取破碎结肠100 mg,加入液氮碾磨成粉末状,置于玻璃匀浆管中,加入1 mL PBS混匀,玻璃匀浆器冰点匀浆。将匀浆液移入2 mL离心管中,-20 ℃过夜后,反复冻融2次使其充分裂解,4 ℃,5 000 r/min离心10 min,取上清液,采用酶联免疫吸附法检测ROS含量及NF-κB蛋白表达水平。
1.5.4 Western Blot法检测大鼠结肠黏膜上皮细胞Bcl-2、Bax表达水平 按照BCA蛋白浓度试剂盒说明提取结肠组织总蛋白质,每孔配制含30 μg总蛋白做SDS-PAGE电泳,转膜后予5% BSA封闭液封闭2 h,依次孵育一抗、二抗,Bax、Bcl-2和GAPDH的一抗稀释比例分别为1∶1 000、1∶500、1∶4 000,二抗稀释比例为1∶3 000,化学发光(ECL)反应曝光、显色后用Quantity-one图像处理系统分析目标蛋白条带的灰度值,对以GADPH作内参照对比得到的相对灰度进行分析。

2 结 果
2.1 各组大鼠造模结果、一般情况及体质量变化 模型对照组造模过程中因麻醉过量死亡1只,安肠组方中剂量组因灌胃不当死亡1只。在X线照射后第2 d,各组大鼠开始出现不同程度腹泻;第4~7 d,各组大鼠大部分表现为黏液便或稀烂便,饮食、活动量减少,精神较差;第8~10 d,各组大鼠的饮食、活动情况、精神状态逐渐恢复。各组大鼠体质量比较见表1。

表1 各组大鼠体质量比较
由表1可见,照射后第8 d模型对照组大鼠体质量低于正常对照组(P<0.05),安肠组方中剂量组大鼠体质量高于模型对照组(P<0.05)。
2.2 各组大鼠结肠病理组织学改变 光镜下进行病理组织学观察,与正常对照组相比,模型对照组可见结肠黏膜下水肿,腺体萎缩或结构消失,并可见黏膜下血管扩张充血及炎症细胞浸润等。与模型对照组相比,安肠组方高、中、低剂量组隐窝、腺体结构基本完整,仅可见黏膜组织轻微水肿或少量炎症细胞浸润。见封3,图1。
2.3 各组大鼠结肠组织ROS含量比较 见表2。
表2 各组大鼠结肠组织ROS含量比较
由表2可见,与正常组对照比较,模型对照组大鼠肠组织ROS含量升高(P<0.05);与模型对照组比较,安肠组方高、中、低剂量组大鼠肠组织ROS含量均降低(P<0.05)。安肠组方高、中、低剂量大鼠肠组织ROS两两比较差异均无统计学意义(P>0.05)。
2.4 各组大鼠结肠黏膜上皮细胞Bax、Bcl-2蛋白表达比较 见图2、表3。
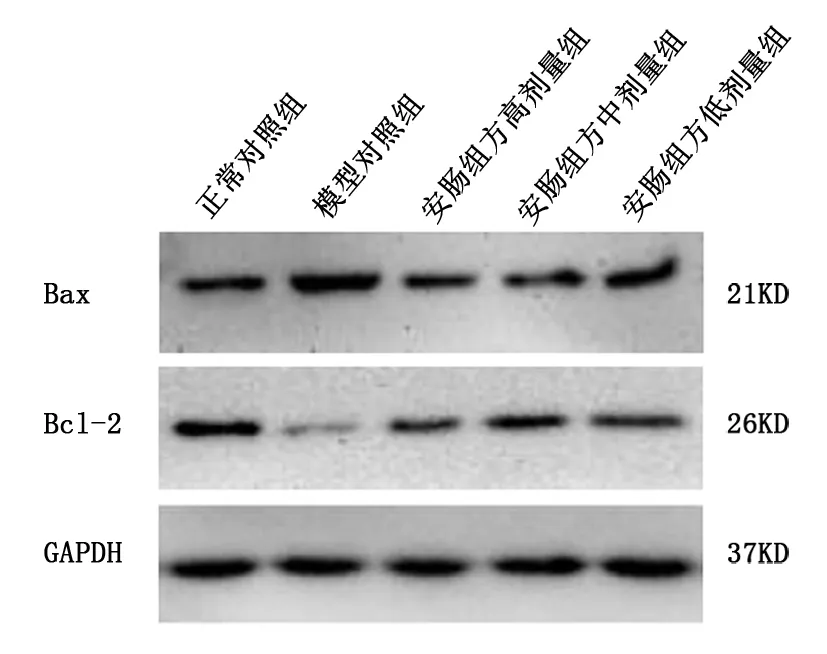
图2 各组大鼠结肠黏膜上皮细胞Bax、Bcl-2蛋白的表达
表3 各组大鼠结肠黏膜上皮细胞Bax、Bcl-2蛋白表达比较
由表3可见,与正常对照组比较,模型对照组结肠黏膜上皮细胞Bax蛋白相对表达水平升高(P<0.05),Bcl-2蛋白相对表达水平降低(P<0.05)。与模型对照组比较,安肠组方高、中、低剂量组结肠黏膜上皮细胞Bax蛋白相对表达水平均降低(P<0.05),Bcl-2蛋白相对表达水平均升高(P<0.05)。安肠组方高、中、低剂量大鼠结肠黏膜上皮细胞Bax、Bcl-2蛋白相对表达水平两两比较差异均无统计学意义(P>0.05)。
2.5 各组大鼠结肠组织NF-κB蛋白表达水平比较 见表4。

表4 各组大鼠结肠组织NF-κB蛋白表达水平比较
由表4可见,与正常对照组比较,模型对照组大鼠肠组织NF-κB蛋白表达水平升高(P<0.05);与模型对照组比较,安肠组方高、中剂量组大鼠肠组织NF-κB蛋白表达水平降低(P<0.05)。安肠组方高、中、低剂量大鼠肠组织NF-κB蛋白表达水平两两比较差异均无统计学意义(P>0.05)。
3 讨 论
放射性肠炎是腹腔局部放疗、盆腔放疗的常见副作用之一,其临床表现为腹泻,里急后重,甚至便血,严重影响患者的生活质量,甚至部分患者会因此中断治疗,极大地影响了放疗的效果。放射性肠炎的主要发生机制是放射线与组织细胞内水分子相互作用产生ROS。而ROS可以破坏DNA的螺旋结构,阻断DNA的转录和复制过程,导致细胞凋亡[11],其中与放射性肠炎密切相关的凋亡基因有Bax、Bcl-2等。除了直接损伤细胞外,ROS还可以激活多种信号通路,其中NF-κB信号通路最为核心[12]。NF-κB作为核转录因子,进一步激活下游炎症信号通路,释放促炎因子、促血管生长因子、生长因子、免疫球蛋白等,进一步放大炎性反应[13]。
中医学认为,放射线属于“火热毒邪”,热毒蕴结、肠道受损是放射性肠炎的主要病机。由于癌瘤内伏,消耗人体之气、血、阴、阳,脏腑功能失司,五脏不能藏精,六腑不能传化,气机阻滞,痰湿内生,痹阻经络,气虚血瘀,加之射线照射,外感热毒,引动内生癌毒,邪热入于血分,虚实夹杂,痰湿瘀毒阻于肠腑络脉,故致本病,日久损及肾阴肾阳而缠绵难愈。病机为本虚标实,虚实夹杂,可兼夹湿热下注、气滞血瘀等,治疗原则为祛湿解毒凉血,兼以健脾益气[14]。本研究中安肠组方中生地榆清热凉血止血,活血生肌,治便血疗效颇佳;白头翁清热解毒,凉血消肿,二者共为君药。白术、茯苓健脾除湿止泻;黄连善除脾胃大肠湿热;木香健脾理气消滞,共为臣药。炒白芍缓急止痛,兼有养血之功;仙鹤草收敛涩血,共为佐药。甘草缓急和中,调和诸药,为使药。诸药合用,共奏清热解毒、健脾除湿、活血化瘀、收敛止血、消肿生肌之功效。
本实验中我们建立放射性肠炎大鼠模型,进一步研究安肠组方防治放射性肠炎的作用机制。本研究结果显示,X线照射后第8 d,安肠组方中剂量组大鼠体质量明显高于模型对照组(P<0.05)。可见,安肠组方可有效改善放射性肠炎模型大鼠相关症状。
有研究认为,氧自由基与肠道组织局部炎性反应密切相关[15]。高能X射线的照射下,机体处于应激状态,ROS产生增多,氧化作用增强,从而引发脂质过氧化反应,肠黏膜的正常结构遭到破坏,形成炎症、穿孔等应激性损伤[1-2]。本研究结果表明,与模型对照组比较,安肠组方高、中、低剂量组肠组织ROS含量明显降低(P<0.05),且随着安肠组方剂量的增加,大鼠肠组织ROS含量降低更明显,但组间比较差异无统计学意义(P>0.05)。说明安肠组方能改善放射性肠炎模型大鼠肠组织氧化损伤。
在正常情况下,NF-κB并不表达,但电离辐射产生的ROS可激活NF-κB信号通路,使其表达增强,促使大量炎性介质释放,引起黏膜炎[3-4]。前期临床研究已证实,安肠组方可有效调节放射性肠炎患者血清中相关炎症因子水平[7]。本研究结果表明,经安肠组方干预后,NF-κB蛋白表达水平下调(P<0.05),与前期研究相一致。因此,推测安肠组方可通过降低大鼠结肠组织NF-κB蛋白表达水平,从而减少血清促炎因子的释放,最终达到减轻炎性反应的目的。
细胞凋亡是细胞受到放射线照射后的主要死亡方式。放射线会导致肠道黏膜上皮细胞凋亡,进而引起肠道屏障的破坏,导致放射性肠炎,其中与放射性肠炎密切相关的凋亡基因主要有Bax、Bcl-2[16]。本研究结果表明,安肠组方可下调促凋亡基因Bax蛋白、上调抑凋亡基因Bcl-2蛋白的表达(P<0.05),且随着安肠组方用药剂量的增加,Bax蛋白表达呈递减趋势,Bcl-2蛋白表达呈递增趋势,呈现了一定的量效关系,但比较差异无统计学意义(P>0.05)。表明安肠组方可抑制结肠黏膜上皮细胞凋亡,维持细胞间紧密完整性,稳定肠黏膜机械屏障。
综上所述,我们推测安肠组方治疗放射性肠炎的机制可能为通过抑制肠黏膜炎前体物质ROS的产生,一方面抑制促凋亡基因Bax蛋白表达,上调抑凋亡基因Bcl-2蛋白表达,进而抑制细胞凋亡,维持细胞间紧密完整性,稳定肠黏膜机械屏障;另一方面抑制核因子NF-κB表达,减轻炎症,从而减轻肠道的辐射毒性。

