腐植酸/纤维素/丙烯酸型吸附材料吸附Cu(Ⅱ)的性能研究
黄良仙, 韩星星, 马 展, 赵志鹏, 蔡 雪, 李国华, 牛育华
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
0 引言
铜离子作为一种重金属离子,广泛存在于采矿、冶金、电镀、制革印染、化工农药、电子产品等行业产生的废水中[1],重金属有毒、不可生物降解性,易在生物体内积累,能引起水体环境严重污染,会对人类健康造成伤害,因此,有效去除废水中的重金属一直是环保领域关注的一个热点问题[2-4].对重金属的处理技术主要有化学沉淀法、吸附法、离子交换法、电沉积法、生物絮凝法等,其中吸附法操作简单、吸附材料种类多、成本较低、处理效果好、污泥产量小等优点,被认为是水体重金属修复最具行业前景的技术之一[2,5].
腐植酸(HA)作为自然界广泛存在的一类高分子有机物,具有来源广、质地疏松、比表面积大、价格低廉的特性,且结构中含有丰富的羧基、羟基、氨基、羰基等活性基团,对金属离子具有良好的吸附、络(螯)合、交换等功能[5].但直接用腐植酸作吸附材料,存在机械强度低、水中分散性差、粘结性低等问题,限制了其在污水处理中的应用[5-13].因此科研人员对HA进行了大量改性研究,用于污水处理,文献调研发现,目前对HA进行改性多采用炭质材料[5,6]、硅类材料[7-9]和金属氧化物[10-13]等,使得腐植酸基吸附材料成本过高.因此,本研究的目的是寻求一种制备途径简单、对重金属离子有良好吸附能力,且价廉的腐植酸基吸附材料,为解决水体重金属污染问题提供新的途径.
纤维素(CEl)是自然界中最丰富的天然高分子物质,不仅来源丰富,而且是可再生资源,具有价廉易得、易被微生物降解、不会造成二次污染等特点.纤维素分子中含有许多羟基,分子内与分子间氢键较强,易形成结晶区,是一种半结晶、纤维状、多毛细管的天然高分子,具有多孔和比表面积大的特点,因此具有吸附性,但天然纤维的吸附(如吸水、吸油、吸重金属等)能力并不强[14,15].
为开发一种低成本、高性能的腐植酸基新型改性吸附材料,作者通过“腐植酸+”理念,利用矿源腐植酸(HA)、纤维素(CEl)中活性官能团及多孔结构和比表面积大的特点,以腐植酸(HA)和纤维素(CEl)为原料,丙烯酸(AA)为单体,N,N′-甲基双丙烯酰胺(MBA)作交联剂,采用水溶液聚合法进行交联接枝共聚反应,制备出具有三维互穿网络结构的HA/CEl/AA型吸附材料,研究溶液pH、温度、Cu2+初始浓度、吸附材料用量等变化对Cu2+吸附性能的影响.并就吸附材料对Cu2+的吸附动力学和吸附等温模型进行了研究.
1 实验部分
1.1 试剂和仪器
1.1.1 主要试剂
腐植酸(HA),分析纯,济宁百川化工有限公司;纤维素(CEl),分析纯,西安泽邦生物科技有限公司;丙烯酸(AA)、N,N′-甲基双丙烯酰胺( MBA)、氢氧化钾、过硫酸钾( KPS)、硝酸铜、盐酸,分析纯,天津市大茂化学试剂厂生产;三水二乙基二硫代氨基甲酸钠(铜试剂,NaDDTC),分析纯,国药集团化学试剂有限公司.
1.1.2 主要仪器
可见分光光度计,UV-752,上海精密科学仪器有限公司;pH计,MT-5000,上海豫康科教设备有限公司;傅里叶红外光谱仪(FT-IR),EQUINX55,德国布鲁克公司;X-射线衍射仪(XRD),Bruker DS,德国布鲁克公司;扫描电子显微镜(SEM),JEOL JSM-6700F,日本电子株式会社.
1.2 HA/CEl/AA型吸附材料的制备
取10 g HA、9 g CEl 放入带有搅拌装置的三口瓶中,加入质量分数2%的KOH溶液100 mL,搅拌30 min后,水浴加热至60 ℃,搅拌下再缓慢加入5 g AA,然后滴加KSP和MBA(质量分数分别为单体总量的 0.6%和1.0%)水溶液,用时约15~20 min,滴毕后升温至80 ℃,使混合物聚合反应约4 h,溶液呈粘稠状,冷却,水洗至少3次,至上清液洗至中性,过滤,60 ℃干燥至恒量,粉碎,得腐植酸/纤维素/丙烯酸(HA/CEl/AA)型吸附材料.
1.3 腐植酸的结构表征
(1)傅里叶红外光谱(FT-IR):将样品研磨成规定粒度的粉末,用KBr压片法用傅立叶红外光谱仪记录其红外光谱,扫描范围500~4 000 cm-1.
(2)扫描电镜(SEM):样品用导电胶固定于金属样品台上,进行喷金,使样品表面完整覆盖,再用扫描电子显微镜对样品表面形貌进行观察,试样镀金厚度约为25 nm,电压为25 KV.
(3)X射线衍射分析(XRD):将样品研磨成粉末干燥并过200目筛子(0.08μm),用X射线衍射仪测试,扫描角度 5 °~80 °,步长0.1 (°)/ 2θ,扫描速度 2 (°)/min.
1.4 Cu2+的静态吸附实验
(1)Cu2+标准曲线的绘制:采用二乙基二硫代氨基甲酸钠分光光度法[16],以Cu2+质量浓度(ρ)对吸光度(A)进行线性回归处理,得Cu2+标准曲线方程:A=0.024 61ρ-0.028 45,R=0.997 94.
(2)吸附量和吸附率的测定:试验采用静态吸附法.取一定Cu2+标准液于锥形瓶中,调节 pH到设定值(用0.1 mol/L HCl和NaOH),加入一定量吸附材料,恒温震荡一定时间后抽滤,滤液适当稀释,在440 nm 波长下,用二乙基二硫代氨基甲酸钠对Cu2+进行显色测定吸光度.然后根据标准曲线计算铜离子的平衡浓度(Ce),并用式(1)和式(2)计算吸附量及吸附率[10,17,18].
(1)
(2)
式(1)、(2)中:q为吸附量,mg/g;η为吸附率,%;C0为Cu2+初始质量浓度,mg/L;Ce为吸附平衡时溶液中Cu2+质量浓度,mg/L;V为溶液体积,L;m为吸附材料质量,g.
1.5 吸附等温模型
吸附材料对溶液中溶质的吸附过程非常复杂,目前常通过已知温度下的吸附等温线来解释吸附过程,文献介绍常用Freundlich和Langmuir模型来解释吸附机理[10,17,18].
Langmuir吸附等温模型式:
(3)
Freundlich吸附等温模型程:
(4)
式(3)、(4)中:Ce为吸附平衡时溶液中Cu2+的质量浓度,mg /L ;qe为平衡吸附量,mg/g;Qm为吸附材料的最大吸附量,mg/g;KL为Langmuir等温吸附平衡常数;KF为Freundlich等温吸附平衡常数;n为与吸附强度相关的特征常数.一般而言,当n在1~10之间时,吸附容易进行,n值越大则表明吸附材料与吸附质之间的相互作用越强.
1.6 吸附动力学
首先测定吸附材料对Cu2+的吸附量和时间之间的关系,然后分别采用吸附拟一级动力学模型、拟二级动力学模型拟合动力学数据[10,17,18].
吸附拟一级动力学模型:
ln(qe-qt)=lnqe-k1t
(5)
吸附拟二级动力学模型:
(6)
式(5)、(6)中:qe是平衡吸附量(mg/g);qt是t(min)时间Cu2+在吸附材料上的吸附量(mg/g);k1是准一级动力学的方程系数(min-1);k2是准二级动力学的方程系数(g/(mg·min) ).
2 结果与讨论
2.1 HA/CEl/AA的红外表征分析
HA/CEl/AA的红外光谱如图1所示.由图1可知,HA在3 000~3 700 cm-1间有宽且强的峰,属-OH、N-H、芳烃C-H的伸缩振动峰,2 937 cm-1、1 384 cm-1是-CH2-、-CH-或-CH3中的C-H振动峰.1 736 cm-1羰基吸收峰,1 659、1 560、907 cm-1苯环骨架振动峰;1 260 cm-1为O-H、C-N弯曲振动峰;1 659 cm-1芳胺N-H弯曲振动峰,与苯环峰重叠;1 050 cm-1为Ar-O-C中C-O-C伸缩振动吸收峰.说明HA中可含有羧基、羟基、氨基、羰基和芳环等基团.所以说腐植酸易发生接枝反应及与其它分子的交联反应,形成一种多孔的网络结构,对很多污染物有一定吸附络合作用.
CEl在3 496 cm-1有宽-OH伸缩振动峰,3 040 cm-1处环氧化物上C-H伸缩振动峰,1 624 cm-1出现分子内氢键-OH…O-的弯曲振动峰,1 434 cm-1为-CH2-OH中-OH弯曲振动峰,1 144、 878 cm-1为环氧物C-O-C 振动峰,1 070 cm-1为链状C-O-C伸缩振动峰.

图1 HA/CEl/AA的FT-IR图
HA/CEl/AA在3 565 cm-1处为O-H、N-H伸缩振动峰,2 937 cm-1是-CH2-、-CH-或-CH3中的C-H伸缩振动峰,1 723 cm-1、1 167 cm-1处为酯键中C=O和C-O吸收峰,证明生成了酯键,此乃为HA或聚丙烯酸上的羧酸基与CEl上的羟基发生酯化产生.1 144 cm-1、937 cm-1、803 cm-1为环状C-O-C 伸缩振动峰.1 723 cm-1处出现酰胺 Ⅰ 带(C=O) 伸缩峰,与酯键中C=O峰重叠.在1 561 cm-1处出现仲酰胺 Ⅱ 带(N-H)弯曲峰,1 249 cm-1处峰为仲酰胺 Ⅲ 带(C-N)弯曲峰.由于受酰胺上NH基团的影响,N原子的p电子与羰基形成p-π共轭,使吸附材料HA/CEl/AA 的羰基吸收峰相对HA羰基峰1 736 cm-1向低波数移动1 723 cm-1,此为HA上氨基与聚丙烯酸上羧基发生酰化反应产生.并在1 640 cm-1处未出现AA中C=C峰.表明HA与CEl、AA通过MBA交联产生了新的物质.
2.2 HA/CEl/AA的XRD图谱分析
HA、CEl、HA/CEl/AA的XRD图如图2所示.从图2可知,纤维素CEl 在2θ=32.5 °附近出现较强衍射峰,表明纤维素是一种结晶度较高的化合物.HA在2θ=26 °附近出现矮小的峰包,说明其属于非结晶性物质.HA无明显的特征峰,符合其是由多种物质组成的无定型复杂混合物的特征.而HA/CEl/AA在2θ=32.5 °处衍射峰近乎消失,在2θ=15 °~ 40 °宽范围出现极弱的峰包,呈现非结晶性,这是因CEl与HA、AA发生接枝交联后,限制了CEl 分子的自由运动,降低了分子链间的氢键和分子间力的影响,CEl的晶格结构发生了变化,晶格缺陷增多,导致结晶性消失.进一步证实了CEl与HA、AA成功发生了接枝交联作用.

图2 HA、CEl、HA/CEl/AA的XRD
2.3 HA/CEl/AA的扫描电镜观察
HA/CEl/AA的SEM图如图3所示.从图3可看出,HA/CEl/AA疏松多孔,内部具有彼此相通且不规则的孔道,呈现了三维网络结构,这是由于当腐殖酸(HA)、纤维素(CEl)、丙烯酸在过硫酸钾(KPS)引发剂及N,N′-甲基双丙烯酰胺(MBA)交联剂存在下,分子链上所含的大量活性基团(如羟基、氨基、羧基),可以失去H原子,形成大分子自由基,与乙烯基单体接触后,可引发乙烯基产生新自由基,单体的不断反应使高分子链不断增长,形成接枝聚合物.含有两个乙烯基的交联剂也同时参与自由基聚合反应,将接枝聚合物链连接起来,同时,大分子链彼此相互缠绕、氢键作用,互相贯穿,形成三维网络结构.正是这种三维网络结构的存在,增加了吸附材料的比表面积,有利于吸附过程的进行.
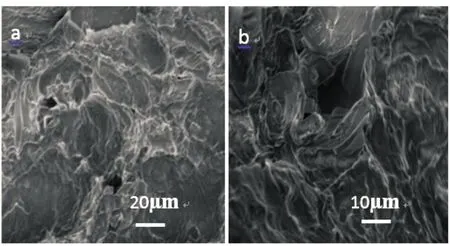
(a)20 μm (b)10 μm图3 HA/CEl/AA的SEM图
2.4 HA/CEl/AA吸附材料对Cu2+的吸附性能
2.4.1 pH对 HA/CEl/AA吸附性能的影响
分别取200 mg/L Cu2+溶液100 mL,用稀硝酸或氢氧化钠调pH值,各加0.05 g HA/CEl/AA,在25 ℃恒温振荡4 h后过滤,滤液适当稀释,按1.4介绍法测定Cu2+的平衡浓度,并计算平衡q和η.pH值对HA/CEl/AA吸附Cu2+的影响如图4所示.
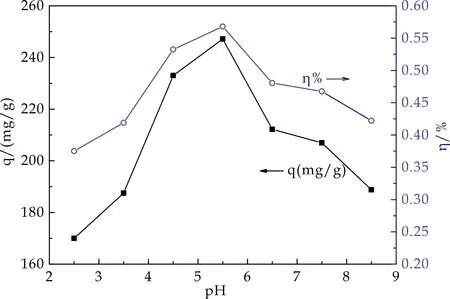
图4 pH对HA/CEl/AA吸附性能的影响
由图4得出,pH值对HA/CEl/AA吸附性能有明显的影响.在一定范围内,随Cu2+溶液初始pH的升高,吸附量和吸附率都呈先升高后降低趋势.当pH=5.5时,吸附性能达最佳.这可能是当pH值较低时,HA/CEl/AA中的部分胺基-NH2质子化形成-NH3+,-NH3+与Cu2+产生静电斥力,从而降低了对Cu2+的吸附能力.随pH升高,一方面,A/CEl/AA中胺基的质子化作用逐步减小,较多的胺基会与Cu2+发生螯合而使吸附性能逐渐增大.另一方面,溶液中H+浓度降低,也促使了HA/CEl/AA上-COOH电离成-COO-,使带负电的-COO-与Cu2+的静电引力增强,或者说Cu2+与HA/CEl/AA上-COOH中H+发生离子交换作用增强,吸附量和吸附率都升高,但pH高于5.5时,Cu2+易发生水解,不利于吸附,使吸附性能下降.
2.4.2 Cu2+初始浓度对HA/CEl/AA吸附性能的影响
分别取0.05 g HA/CEl/AA,各加入不同初始浓度的Cu2+标准液100 mL,调节溶液pH值4.5,25 ℃恒温振荡4 h后过滤,滤液适当稀释,按1.4介绍法计算平衡q和η.图5为Cu2+初始浓度对HA/CEl/AA吸附Cu2+的影响.
由图5看出,298 K下,随着溶液中Cu2+浓度的增大,HA/CEl/AA对Cu2+的吸附量呈先快速升高后渐趋稳定,而吸附率则呈下降趋势.因为体系中HA/CEl/AA的质量是一定的,对于低浓度的Cu2+溶液,相对来说HA/CEl/AA上活性位点数量充足,随Cu2+浓度升高,更多的Cu2+从溶液中迁移到HA/CEl/AA的表面.一是与HA/CEl/AA的接触机会变大,二是活性位点的利用率也大大提高,吸附量会显著提高;随着吸附作用的不断进行,活性位点渐达饱和状态,吸附量也就趋于稳定,然而,相对于活性位点利用率提高来说,浓度增大的较快,导致吸附率呈现下降趋势.所以,Cu2+浓度过高不利于Cu2+的去除.综合考虑,Cu2+吸附的适宜初始浓度选200 mg/L.
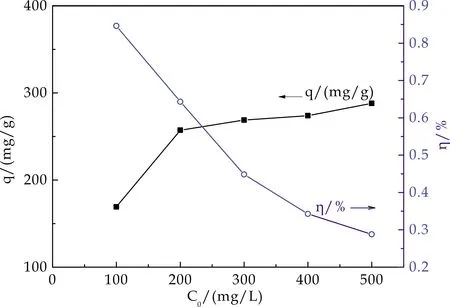
图5 Cu2+浓度对HA/CEl/AA吸附 性能的影响
2.4.3 HA/CEl/AA用量对其吸附性能的影响
准确称取不同质量的HA/CEl/AA,分别放入100 mL初始浓度为200 mg/L、初始pH值为4.5的Cu2+溶液中,25 ℃恒温振荡4 h后过滤,滤液适当稀释,按1.4介绍法测定滤液的吸光度,计算q和η,结果如图6所示.

图6 HA/CEl/AA用量对HA/CEl/AA 吸附性能的影响
从图6得知,HA/CEl/AA对Cu2+的吸附量随着其投加量的递增先增大后逐渐减小,而吸附率则是先快速上升后趋于平稳,其原因主要是吸附活性位点的数量会随HA/CEl/AA投加量的增加而变多,而吸附活性位点的数量直接影响着HA/CEl/AA对Cu2+的吸附性能.随用量增加,吸附量增大.继续增大用量,吸附量逐渐减小,而吸附率逐渐增大至平稳状态.主要是由于投加量的增加会带来更多的吸附活性位点,更有利于其对Cu2+的去除,但Cu2+浓度不变,HA/CEl/AA单位质量吸附的Cu2+将会减少,导致吸附量降低.选HA/CEl/AA投加量为50 mg.
2.4.4 吸附时间和温度对HA/CEl/AA吸附性能的影响
温度也是影响吸附材料吸附过程的一个重要因素,探讨温度对吸附材料吸附效果的影响,以确定吸附材料对Cu2+的吸附是放热还是吸热反应,为实际应用提供理论支持.
准确称取若干份50 mg HA/CEl/AA,分别加入100 mL浓度为200 mg/L、pH值为4.5的Cu2+溶液,在不同温度下恒温振荡不同时间,过滤,滤液适当稀释,按1.4介绍法测定滤液的吸光度,计算q和η.结果如图7所示.

图7 温度和时间对HA/CEl/AA 吸附性能的影响
从图7可知,吸附温度和时间对吸附量和吸附率都有一定的影响.在一定温度下,时间在100 min以内,随时间增长,HA/CEl/AA对Cu2+的吸附量和吸附率增速较快;时间从100 min增至125 min时,吸附量和吸附率增速变缓;时间达到125 min后再增长,吸附量和吸附率基本不变,说明吸附处于平衡阶段.因为在其它条件固定时,随接触时间的延长,HA/CEl/AA表面存在大量的活性吸附位点会使质量浓度较大的Cu2+溶液中Cu2+离子会快速向其表面及孔内扩散,使得吸附量和吸附率迅速增加.随着吸附反应的进行,Cu2+的质量浓度及其表面吸附活性位点大大减少,导致吸附量和吸附率上升就会变缓慢,最终对Cu2+的吸附达饱和.当时间为125 min时,HA/CEl/AA已较充分、完全地吸附Cu2+,故实验的吸附平衡时间选125 min.
从图7还可看出,在一定时间下,当温度由298 K升到318 K时,HA/CEl/AA对Cu2+的吸附量和吸附率都稍有所下降,在温度为298 K时吸附率、吸附量都相对能高些,可能是该吸附过程除了有化学吸附外,可能还存在物理吸附,当温度升高时,已被HA/CEl/AA表面捕捉而吸附的Cu2+会因运动加剧又从表面脱落下来,导致吸附量和吸附率降低.既然低温有利于吸附,高温不利于吸附,可推知,该吸附过程可能是个放热反应,提高反应温度不利于吸附反应的进行.
2.5 吸附动力学
为评价HA/CEl/AA对Cu2+的吸附过程的控速步骤和吸附机理,吸附动力学研究是不可缺的非常重要的手段.吸附速率若慢,会明显延长吸附时间,对吸附处理过程会非常不利.
配制若干份溶液pH为4.5、Cu2+初始浓度为200 mg/L、溶液体积为100 mL、HA/CEl/AA用量为50 mg,在不同温度、不同时间下经过一定处理的稀释后的滤液,按1.4和1.6介绍方法进行测试和动力学分析.吸附拟一级动力学模型、拟二级动力学模型如图8、图9所示,拟合参数如表1所示.
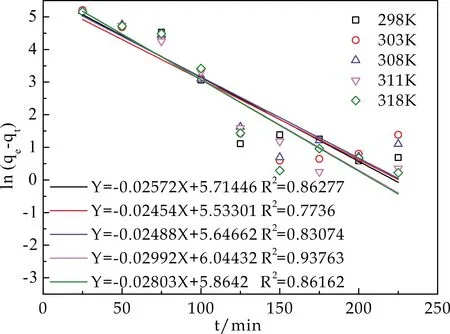
图8 准一级动力学曲线图
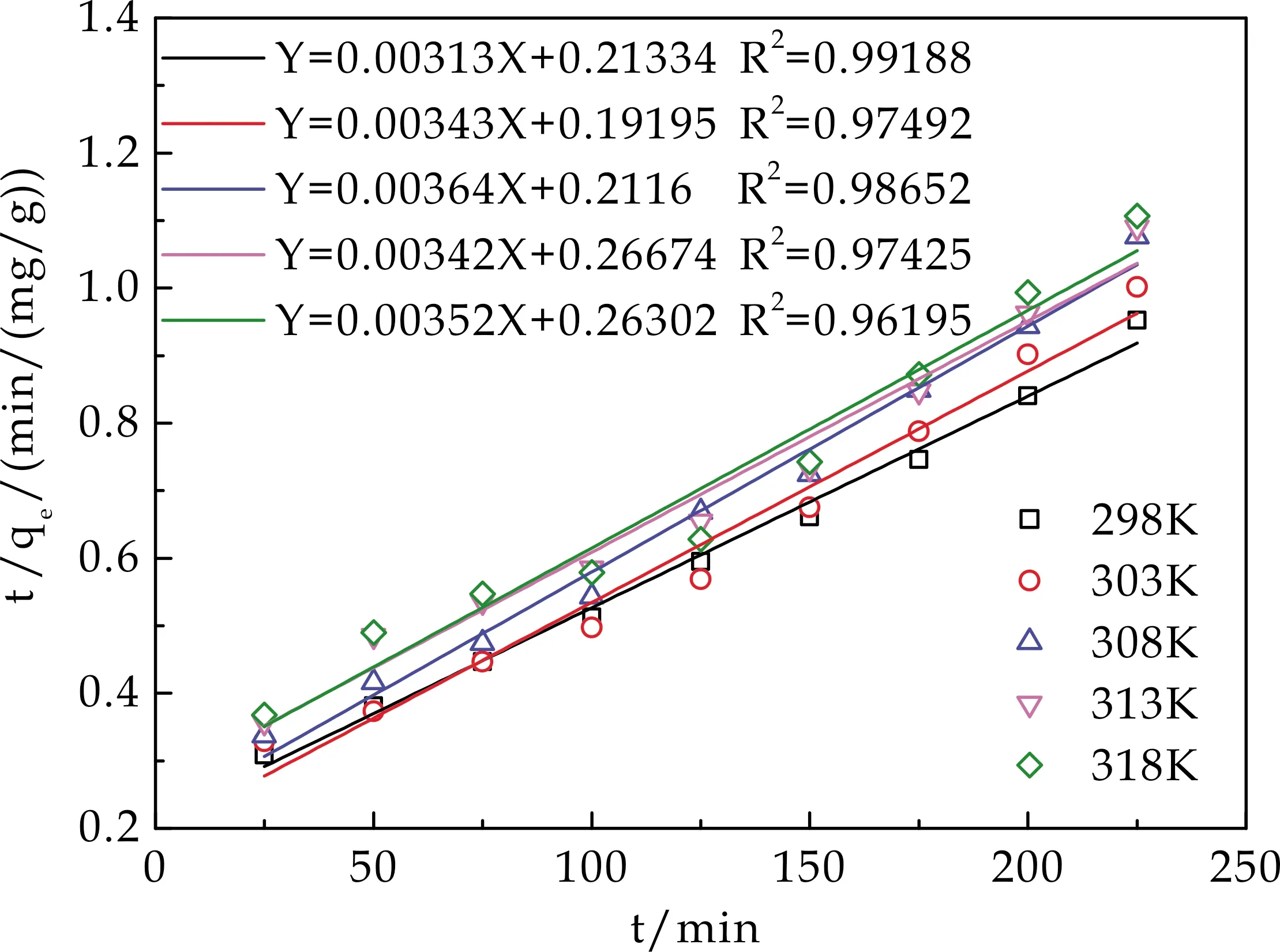
图9 准二级动力学曲线
从图8、图9及表1得知,准二级吸附动力学模型更好地拟合了试验数据,其线性相关系数R2高于准一级吸附动力学模型的线性相关系数R2,也更接近1,具有更好的线性关系.并且298 K时从实验中测得的吸附平衡量230 mg/g,与准二级动力学模型计算得到的平衡吸附量260.48 mg/g更接近,而与准一级动力学模型计算得到的吸附平衡量333.22 mg/g相差较大.这说明HA/CEl/AA对Cu2+的吸附总体过程可以用准二级动力学模型来预测,吸附过程中的反应速率和反应物浓度的二次方呈线性关系,吸附过程中化学吸附机理起重要作用[7,17,19],这种化学吸附可归因于Cu2+与HA/CEl/AA表面的官能团之间发生的离子交换或共用电子对[7,17,19].
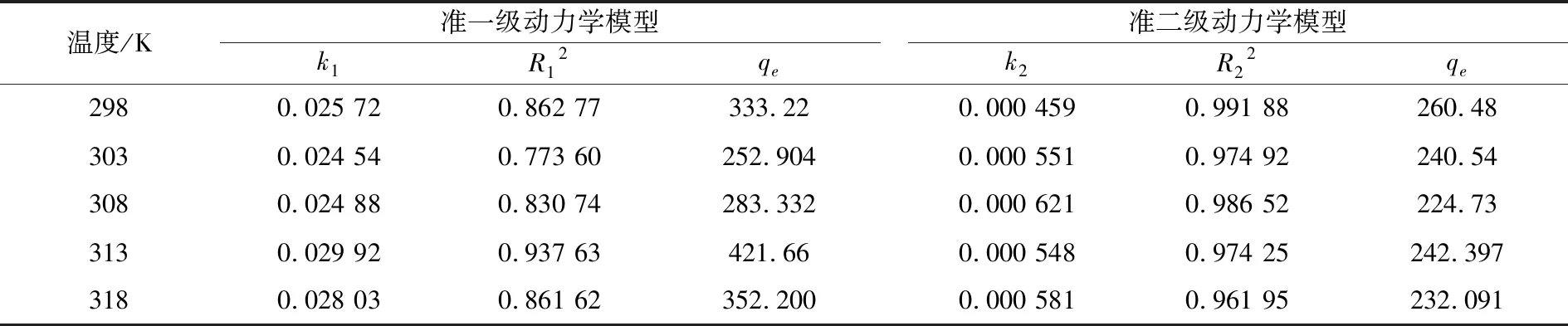
表1 吸附动力学模型参数
2.6 等温吸附模型
吸附材料对溶液中溶质的吸附过程非常复杂,常广泛采用Freundlich和Langmuir吸附模型来解释吸附机理.
控制Cu2+初始浓度分别为100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L,pH 4.5,溶液体积100 mL,HA/CEl/A用量50 mg条件下,同一温度下振荡4 h的吸附实验,充分达到吸附平衡,根据实验数据绘制出吸附等温线如图10所示.
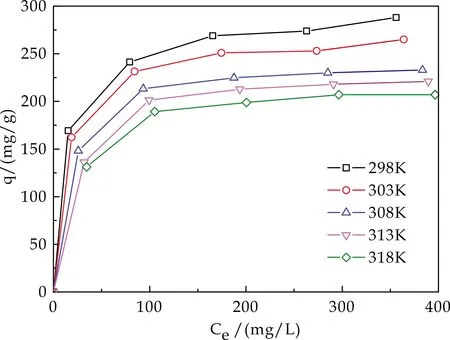
图10 HA/CEl/AA的 吸附等温曲线
分析图10可以得出,随着Cu2+平衡浓度的增大,HA/CEl/AA对Cu2+的吸附量先增大后渐趋平稳, HA/CEl/AA对Cu2+的吸附量随着温度的升高而下降,进一步判断吸附为放热反应.
图11、图12分别为由实验数据拟合出的Langmuir吸附等温线和Freundlich吸附等温曲线,表2列出了两种吸附等温模型的相关参数.
由表2可发现,Langmuir模型的线性相关系数(R2)大于Freundlich模型的线性相关系数(R2),且大于0.95更接近1.表明HA/CEl/AA吸附Cu2+的吸附过程可以用Langmuir吸附等温模型来描述.也就是说,HA/CEl/AA对Cu2+的吸附主要为单分子层化学吸附,可能是通过离子配位、离子交换结合.理论最大吸附量Qm随温度升高而降低,进一步说明吸附过程是个放热过程[17],该吸附过程不宜在高温下进行.在298 K时拟合出Cu2+的最大吸附量(Qm)为296.735 mg/g.此外,在Freundlich模型中,整个温度范围内,n值从5.253 20到6.130 08变化,均在1~10之间,说明HA/CEl/AA吸附Cu2+过程较易进行.n值较大则表明HA/CEl/AA与Cu2+之间的相互作用更强.
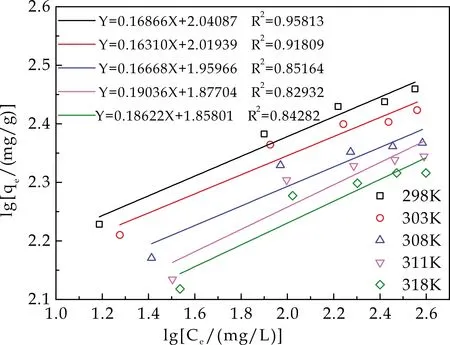
图11 Freundlich等温吸附曲线

图12 Langmuir 等温吸附曲线

表2 等温吸附模型参数
3 结论
(1)以丙烯酸(AA)为单体,腐植酸(HA)、纤维素(CEl)为原料,过硫酸钾(KPS)为引发剂,N,N′-甲基双丙烯酰胺(MBA)为交联剂,采用水溶液聚合法制备出了HA/CEl/AA型吸附材料.通过SEM、XRD、FT-IR等分析手段证实聚合反应发生,目标物HA/CEl/AA为具有三维互穿网络状结构的非结晶性物质.
(2)HA/CEl/AA对水溶液中的Cu2+显示了较好的吸附性能,对Cu2+的吸附量随HA/CEl/AA用量的增加、溶液初始pH的升高都呈先升高后降低趋势,随着溶液中Cu2+初始浓度的增大、接触时间的延长都呈先快速升高后渐趋稳定,随温度升高稍有所下降.当Cu2+起始浓度为200 mg/L,体积为100 mL,HA/CEl/AA用量为50 mg,吸附时间为125 min,pH值为4.5,温度25 ℃时,HA/CEl/AA对Cu2+的吸附量达230 mg/g.
(3)HA/CEl/AA对Cu2+的吸附满足准二级动力学方程和Langmuir型吸附等温模型,吸附属单分子层化学吸附.HA/CEl/AA与Cu2+可能是通过离子配位、离子交换相结合.

