一株耐镉促生菌的筛选、鉴定及对番茄幼苗生长与镉累积的影响
魏 婷, 孙燕妮, 李 鲜
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
镉(Cadmium,Cd)是自然界中存在的一种重金属微量元素,也是公认的致癌、致畸、致突变物质,具有很强的生物毒性.Cd矿的开采、含Cd废弃物的不合理的排放及农业化学品的不合理使用,导致我国农田土壤Cd累积和超标问题日益突出[1,2].土壤中的Cd可通过质外体或共质体途径进入植物体内[3],造成农作物产量和品质下降,同时,Cd可以通过食物链进入人体从而引发严重的健康问题.因此,有效地治理和安全利用Cd污染土壤对于保障农产品品质和人体健康具有重要意义.
传统的物理、化学方法修复重金属污染土壤成本高,且容易造成土壤结构破坏并给环境带来二次污染,不宜大面积推广.近年的研究发现,重金属污染土壤中的根际促生菌(Plant growth-promoting rhizobacteria,PGPR)与植物根系以及土壤形成特殊根际微环境,影响植物重金属吸收、转运过程及对重金属的抗性[4,5].因此,PGPR诱导植物解毒系统来对抗重金属胁迫逐渐成为了研究的热点.PGPR能够通过其自身代谢活动来提高根际土壤中重金属元素的生物有效性,还可通过分泌植物生长激素吲哚-3-乙酸(IAA)、铁载体以及促进植物对矿物元素(磷)吸收来促进种子萌发,提高叶绿素含量,增强光合效率,促进了植物的生长,间接提高植物对重金属的抗性[6].与此同时,PGPR还可以通过影响植物细胞生理活动,激活植物抗氧化酶活性,诱导植物系统抗性,调控植物重金属的吸收、转运相关基因表达,来减轻重金属对植物的毒害作用[7].接种植物促生菌Bradyrhizobiumsp.750能够缓解重金属对于黄羽扇豆的毒害作用,显著增加其生物量,并降低根系重金属(Cd、Pb、Zn和Cu)含量与地上部植物组织重金属(Cd和Pb)含量[8].接种Klebsiellasp.CIK-502 能够增加重金属胁迫下小麦和玉米的生物量,同时显著降低地上部与地下部Cd含量[9].接种耐Cu的根际促生菌可以缓释Cu对扁豆的氧化胁迫,同时降低植物体对Cu的吸收[10].
综上,植物根际促生菌在植物重金属逆境的响应中扮演着重要角色,在促进植物生长和提高重金属抗性的同时,可以调控植物对重金属的吸收、转运以及累积,因此,本研究从受Cd污染的设施菜地番茄根际土壤中分离到了一株Cd抗性的根际促生菌,对其促生性能,以及对番茄幼苗生长和Cd累积的影响进行了研究,以期为采用环境友好的根际植物促生菌调控作物重金属吸收转运,降低作物可食部分重金属累积,实现中低污染农田安全生产提供新的研究思路与理论支持.
1 实验部分
1.1 实验材料
1.1.1 土壤样品的收集
土壤样品来自于西安市郊Cd污染的设施菜地番茄根际土壤,将番茄连根拔起,轻轻抖动去除非根际土,用小刷子刷取植物样品根际土,4 ℃保存备用.
1.1.2 培养基
LB液体培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,用ddH2O溶解并定容至1 L.LB固体培养基:在LB液体培养基中加琼脂粉20 g/L;无机磷培养基:葡萄糖10 g、Ca3(PO4)25 g、MgCl2·6H2O 5 g、MgSO4·7H2O 0.25 g、KCl 0.2 g、(NH4)2SO40.1 g、蒸馏水1 000 mL,pH6.8~7.0;MKB培养基:酪蛋白氨基酸5.0 g、甘油15 mL、K2HPO42.5 g、MgSO4·7H2O 0.2 g、纯水1 000 mL,pH7.2.
1.1.3 供试番茄种子
番茄种子(石红3号)购自于新疆石河子蔬菜研究所.
1.2 实验方法
1.2.1 根际促生菌的分离
取0.1 g根际土加入含有1 mL无菌水的灭菌离心管中,充分混匀并逐级稀释,分别从浓度为10-4、10-5、10-6的稀释液中取0.1 mL的菌悬液涂布在LB平板上,28 ℃培养72 h.从平板上挑取不同形态的单菌落纯化后用接菌环依次挑至Cd浓度为200 mg/L、300 mg/L和400 mg/L的LB平板上,选择耐Cd能力强、生长速度快的菌株转至LB斜面培养基4 ℃条件下保藏备用.
1.2.2 根际耐Cd促生菌的促生性能测定
产吲哚乙酸(IAA)能力的测定:5 mg/mL色氨酸母液经0.22μm过滤除菌后备用.取1 mL悬浮菌液(108CFU/mL)接种于100 mL含色氨酸的LB液体培养基中,对照组加入1 mL LB培养基,于29 ℃、180 r/min的摇床中振荡培养48 h,离心取1 mL上清液与2 mL Salkowski试剂(150 mL浓H2SO4、250 mL蒸馏水、7.5 mL 0.5 mol/L FeCl3·6H2O)充分混合,将混合物在室温下温育20 min,在535 nm处测量吸光度,然后通过标准曲线确定IAA含量[11].
溶磷性能测定:取1 mL悬浮菌液(108CFU/mL)接种于50 mL灭菌的无机磷液体培养基中,29 ℃、180 r/min的摇床中振荡培养5天,8 000 r/min下离心10 min,取上清液采用钼锑比色法测定有效磷含量[12].
产铁载体能力的测定:根据孙磊等[13]的方法测定.取1 mL悬浮菌液(108CFU/mL)接种于50 mL经灭菌的MKB培养基中,29 ℃、180 r/min的摇床中振荡培养5天,离心取上清液加入等体积的CAS检测液,静置1 h后测定OD630(A),未接菌的MKB培养基OD630(Ar),A/Ar值在0~0.6表示产铁载体能力较强,在 0.6~0.8表示产铁载体能力中等,在0.8~1之间表示较弱.根据公式(1)计算菌产铁载体量:
铁载体活性(%)=[(Ar-A)/Ar]*100%
(1)
1.2.3 菌株的分子生物学鉴定及系统发育树的构建
采用细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取供试菌株的总DNA.用细菌通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′ 进行16S rDNA基因的扩增,将 PCR 扩增产物送上海生工进行测序.所得序列与GenBank中相关序列进行同源性比对,利用MEGA7.0中的Neighbor-joining analysis构建系统发育树.
1.2.4 水培实验
番茄种子用10%次氯酸钠消毒并均匀播种于蛭石中,置于自动控制生长室中(16 h 光照/8 h黑暗条件、温度 26 ℃/20 ℃、相对湿度 75%).待其长至两叶一心期转至Hoagland营养液中并定期换营养液,培养三周后选取长势一致的幼苗进行接菌处理.将分离得到的Cd抗性菌株D36在LB液体培养基中进行活化,并于28 ℃培养18 h后离心,将得到的菌体用无菌水重悬至OD600=1.0时即得到待处理菌液.将需要接菌处理番茄幼苗根部浸泡于D36菌悬液中2 h,未接菌的用去离子浸泡作为对照.3天后对番茄幼苗进行2 mg/L的Cd(CdCl2·2.5H2O)处理.本研究共包括四个处理组:CK、Cd、D36、D36+Cd,每个处理24株苗子.在Cd处理7天后收样,整个实验重复三次.
1.2.5 根长株高与鲜重的测定
用直尺测量番茄植株的根长与株高,用去离子水冲去根部残留营养液,并用滤纸吸干水分,用天平称取番茄各器官的鲜重.
1.2.6 叶绿素含量的测定
取0.2 g新鲜番茄叶片,加入10 mL体积分数为95%的乙醇避光研磨成匀浆并过滤,用酶标仪测定在波长665 nm、649 nm和470 nm的吸光度,以80%乙醇为空白调零.再计算出叶绿素a和叶绿素b的含量[14].
1.2.7 H2O2含量及过氧化物酶(POD)活性测定
H2O2含量的测定使用H2O2含量检测试剂盒进行(上海索莱宝生物科技有限公司).POD活性的测定采用愈创木酚法[15].
1.2.8 Cd含量的测定
分开收集番茄幼苗的地上部与地下部,根部在5.0 mmol/L的乙二胺四乙酸二钠(EDTA-Na2)溶液中解析15 min,去除根表面吸附的Cd,然后用去离子水冲洗数次,并将地上部与地下部烘干称重进行消解,最后使用原子吸收光谱仪进行Cd含量的测定[16].
1.2.9 数据分析
本实验采用Excel 2010统计数据,采用SPSS 20.0进行单因素方差分析和多重比较(p<0.05),用Origin Pro 8软件进行绘图,所有数据均为三次实验平均值.
2 结果与讨论
2.1 耐Cd促生菌的分离及分子生物学鉴定
从番茄根际土壤中筛选出38株根际耐Cd促生菌,其中菌株D36对Cd的耐受性最高,可以在Cd浓度为400 mg/L的LB平板上生长,且生长速度相对较快.故选用该菌株进行后续实验.NCBI BLAST分析表明,菌株D36与鞘安醇单孢菌(Sphingomonassp.)的16S rDNA序列相似度达到99%.对菌株D36的16S rDNA序列用MEGA7.0分析软件构建系统发育树,如图1所示.结果表明,番茄根际耐Cd促生菌D36为鞘安醇单孢菌(Sphingomonassp.),该菌株的GenBank登录号为MN540917.
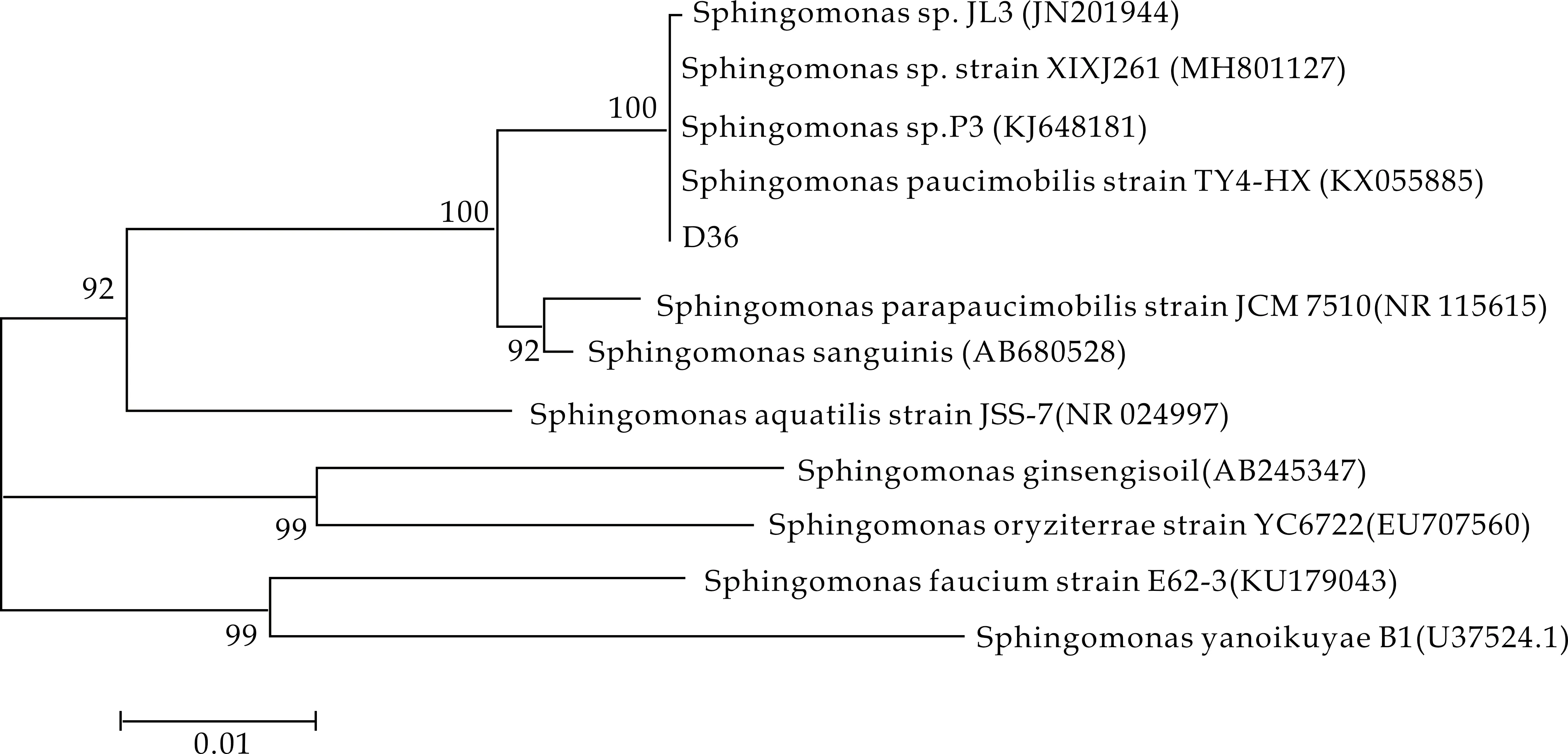
图1 根际耐Cd促生菌D36的系统发育树
2.2 菌株D36溶磷、产IAA和产铁载体能力
吲哚乙酸(IAA)是植物体中普遍存在的生长素类物质,能促进植物细胞的伸长和细胞分裂,低水平的IAA能促进植物初生根的伸长,高浓度则可促进次生根和不定根的伸长.本研究表明,菌株D36能产生4.19±0.29 mg/L的IAA,其产IAA的能力较强,说明D36具有潜在的促生根系生长的能力.促生菌可以通过分泌低分子有机酸,降低pH使难溶磷或不溶磷转换为植物易于吸收的有效态磷,由表1可知,D36溶磷能力为21.72±1.03 mg/L,具有促进植物磷元素吸收的性能.此外,PGPR能分泌一些与铁具有较高亲和力的嗜铁素,从而结合铁元素供植物生长[17].由表1可知,D36的产铁载体活性在0~0.6之间,产铁载体能力较强,故D36能通过较强的产铁载体能力螯合铁元素促进植物生长.综上所述,D36具有潜在的促生能力.

表1 菌株D36溶磷、产IAA和产铁载体能力
2.3 接种D36对Cd胁迫下番茄根长株高的影响
重金属胁迫通常能够抑制植物根尖细胞分裂或根的伸长[18].如图2所示,Cd处理组番茄的根长与株高显著低于CK对照组(p<0.05),分别降低了37.09%和17.55%,表明2 mg/L的Cd胁迫会抑制番茄幼苗的生长.D36处理组的根长与株高显著高于CK,分别增加了112.30%和16.53%.D36+Cd处理组的根长与株高与Cd处理组相比分别增加了210.74%和14.94%,说明接种D36菌株能显著缓解Cd胁迫引起的番茄生长抑制.其原因可能是D36通过产生IAA促进植物根系生长发育,IAA是一种重要的促进植物细胞分裂的物质,会促进植株根的伸长以加强营养元素的吸收,同时促进茎的伸长和形成维管组织.此外,D36通过溶磷和产铁载体增加了根系对水分与养分的吸收从而缓解Cd胁迫对番茄幼苗生长的抑制[19],这一结果与Asghar等[20]的结果一致.有研究表明,PGPR可增加山豆根组培的新根数,诱导根部形成多个根尖,使根系变粗壮,这不仅有利于植物对营养物质的吸收,也利于提高有益微生物对根部的浸染率[21].
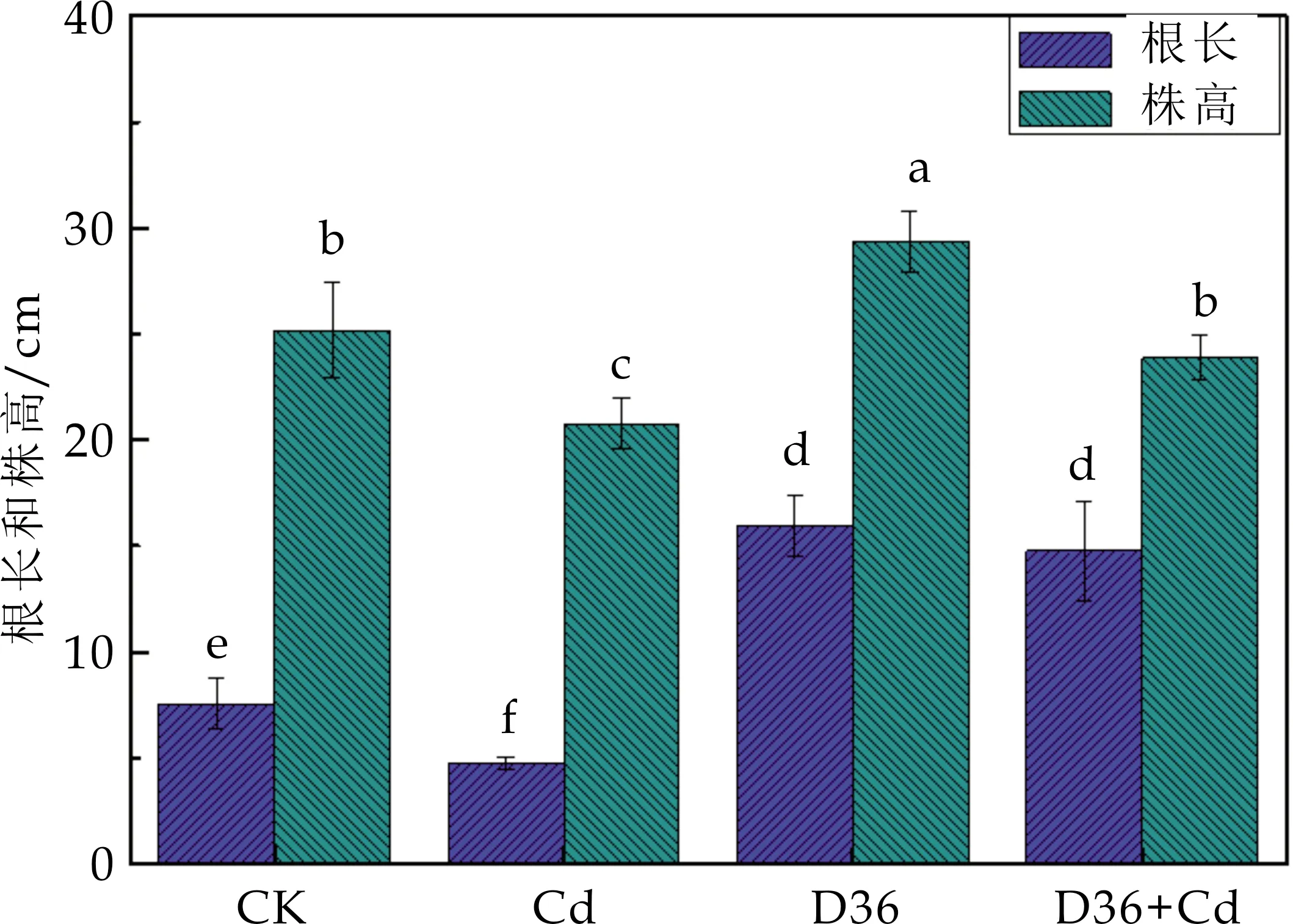
图2 不同处理对番茄根长与株高的影响
2.4 接种D36对Cd胁迫下番茄鲜重的影响
已有研究表明,有益的微生物-植物相互作用可以缓解重金属胁迫导致的植物生长抑制[22].如图3所示,Cd胁迫使得番茄地下部与地上部的鲜重分别降低了23.85%和42.19%,说明Cd处理会抑制番茄的生长发育,从而降低番茄植株的鲜重.D36+Cd处理组番茄地下部与地上部均显著高于Cd处理组,分别增加了15.09%和18.33%,说明D36通过产生生长激素和分泌铁载体以及溶解无机盐的方式促进了养分吸收进而促进了番茄幼苗的生长,使其鲜重增加,从而缓解了Cd胁迫对番茄生长的抑制.
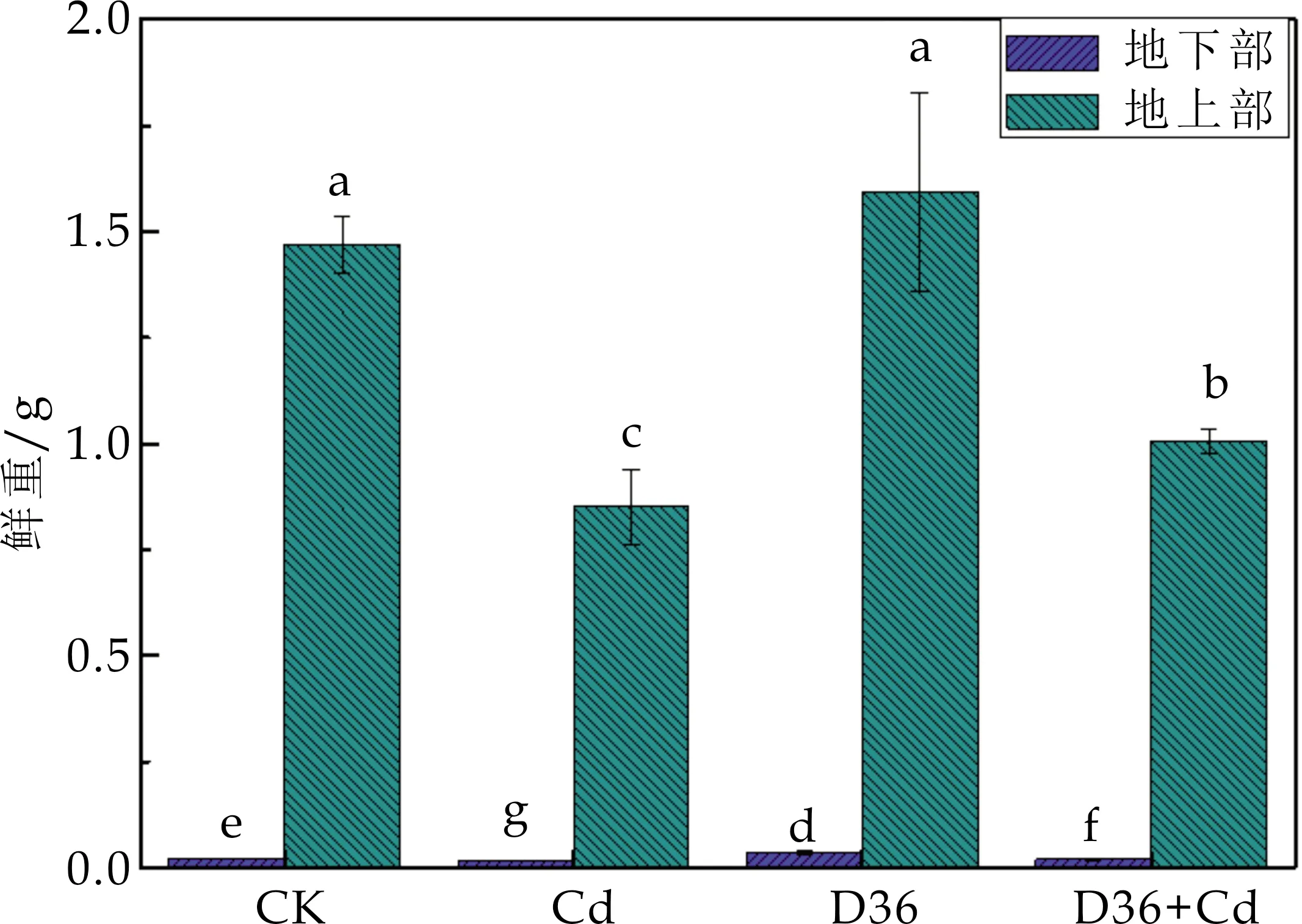
图3 不同处理对番茄鲜重的影响
2.5 接种D36对Cd胁迫下番茄叶绿素含量的影响
重金属能通过破坏光合作用中的电子传递和叶绿素完整性影响植物光合作用,许多植物在重金属胁迫下都出现了叶片失绿的现象,有研究表明,在Cd胁迫下根际促生菌可提高叶绿素含量,减少Cd对植物光合作用的影响[23].
如图4所示,与CK相比,Cd处理组的番茄叶绿素a、叶绿素b和叶绿素a+b含量分别下降了7.76%、9.03%和8.41%,说明Cd抑制了番茄幼苗叶绿素合成过程中一些关键酶的活性,使叶绿体的光合膜蛋白中心离子发生改变,从而导致了叶绿素含量降低[24];与Cd处理组相比,D36+Cd处理组的番茄叶绿素a、叶绿素b和叶绿素a+b含量分别提高了11.19%、13.53%和13.40%,说明在Cd胁迫下,D36菌株能显著提高叶绿素浓度,可能是由于D36作为根际促生菌增加了叶绿素合成必需元素的吸收,从而增加了番茄的叶绿素含量.
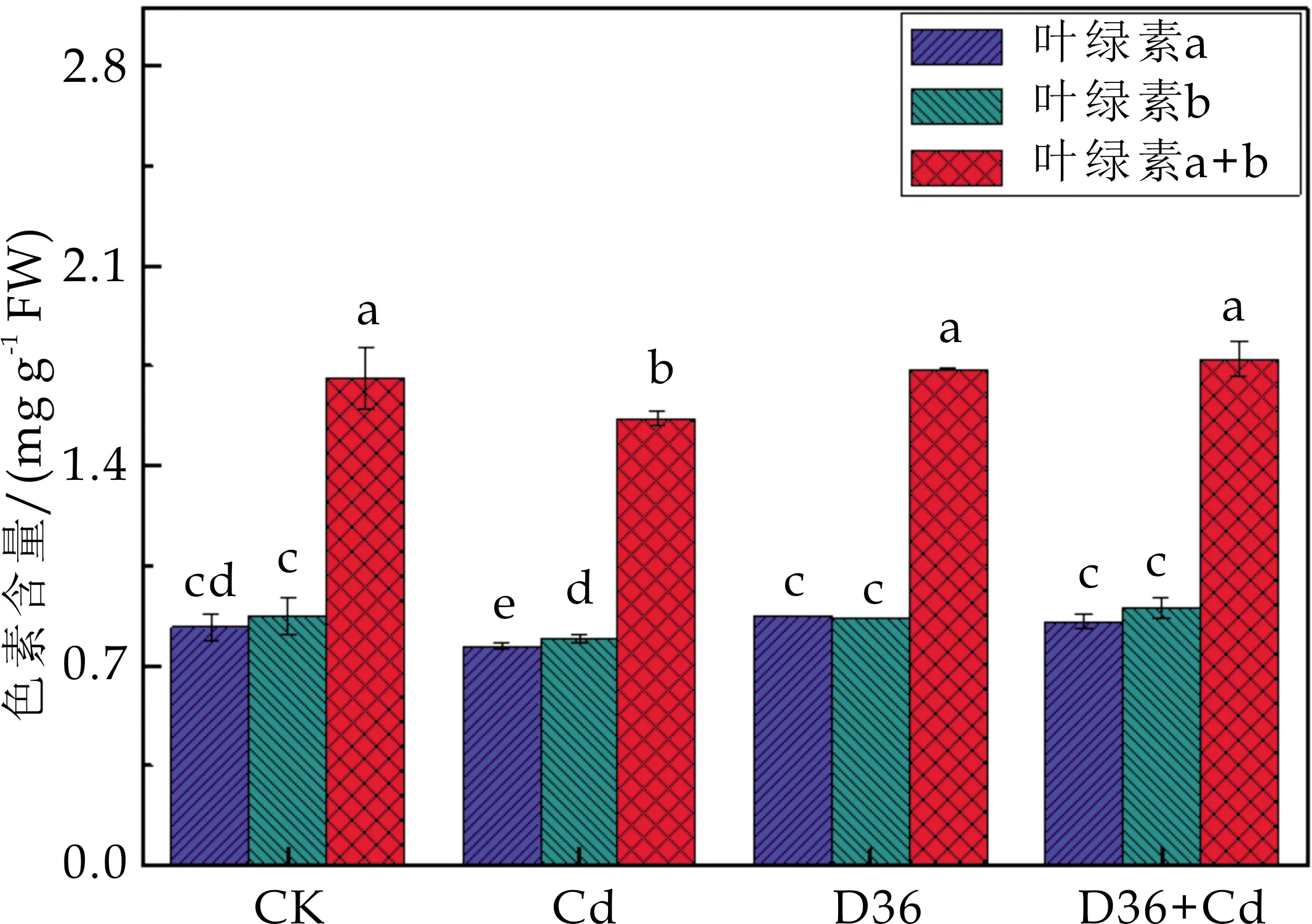
图4 不同处理对番茄叶绿素含量的影响
2.6 接种D36对Cd胁迫下番茄H2O2含量的影响
重金属胁迫时,植物体内会产生大量的活性氧(ROS),引起氧化胁迫和膜脂过氧化,最终导致代谢失衡和对植物造成毒害.H2O2是植物体内广泛存在的活性氧自由基,能与生物大分子反应,从而破坏细胞结构与功能[25].
如图5所示,Cd胁迫显著提高了番茄根部的H2O2含量,而叶部H2O2含量在各处理组之间无显著性差异(p<0.05).其原因在于Cd和D36均通过根部作用于植物,故根部的氧化胁迫水平差异较为显著.与Cd处理组相比,D36+Cd处理使得番茄根部的H2O2含量降低了35.09%,说明接种D36菌株能显著降低Cd胁迫下H2O2的含量,从而减少活性氧自由基对番茄幼苗细胞结构和功能的破坏.
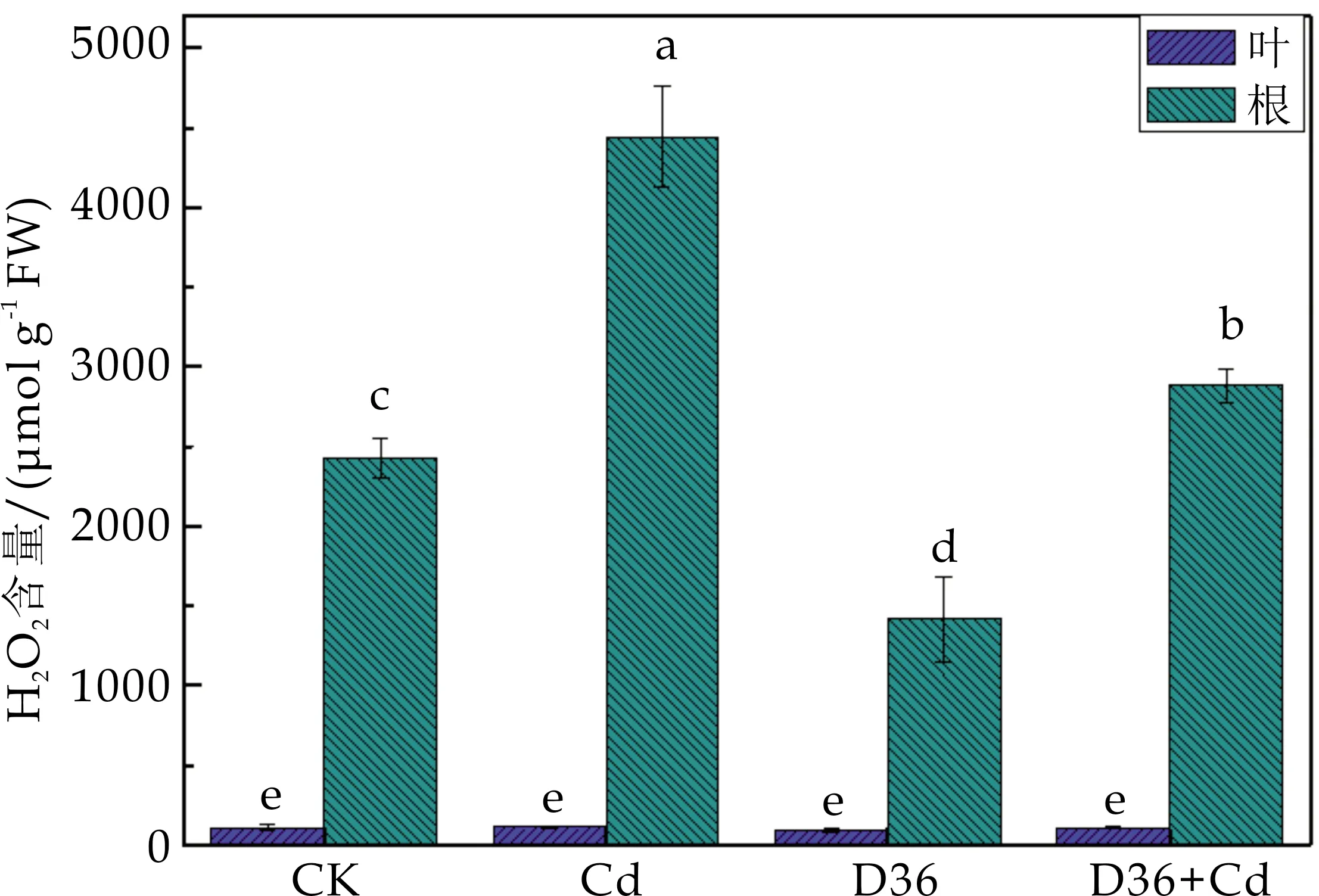
图5 不同处理对番茄H2O2含量的影响
2.7 接种D36对Cd胁迫下番茄过氧化物酶活性(POD)的影响
过氧化物酶(POD)可以将H2O2催化分解成H2O和O2,从而抵御H2O2对植物造成的毒害.如图6所示,Cd胁迫下,番茄根部与叶部的POD活性分别提高了116.01%和164.65%,说明在Cd胁迫下植株启动了防御机制来清除过量的H2O2,以抵御Cd胁迫造成的氧化损伤.与Cd处理组相比,D36+Cd处理组根部与叶部的POD活性分别增加了74.94%和3.81%,说明D36菌株可以通过提高番茄自身的POD活性来清除过量的H2O2,减少Cd对番茄的毒性.
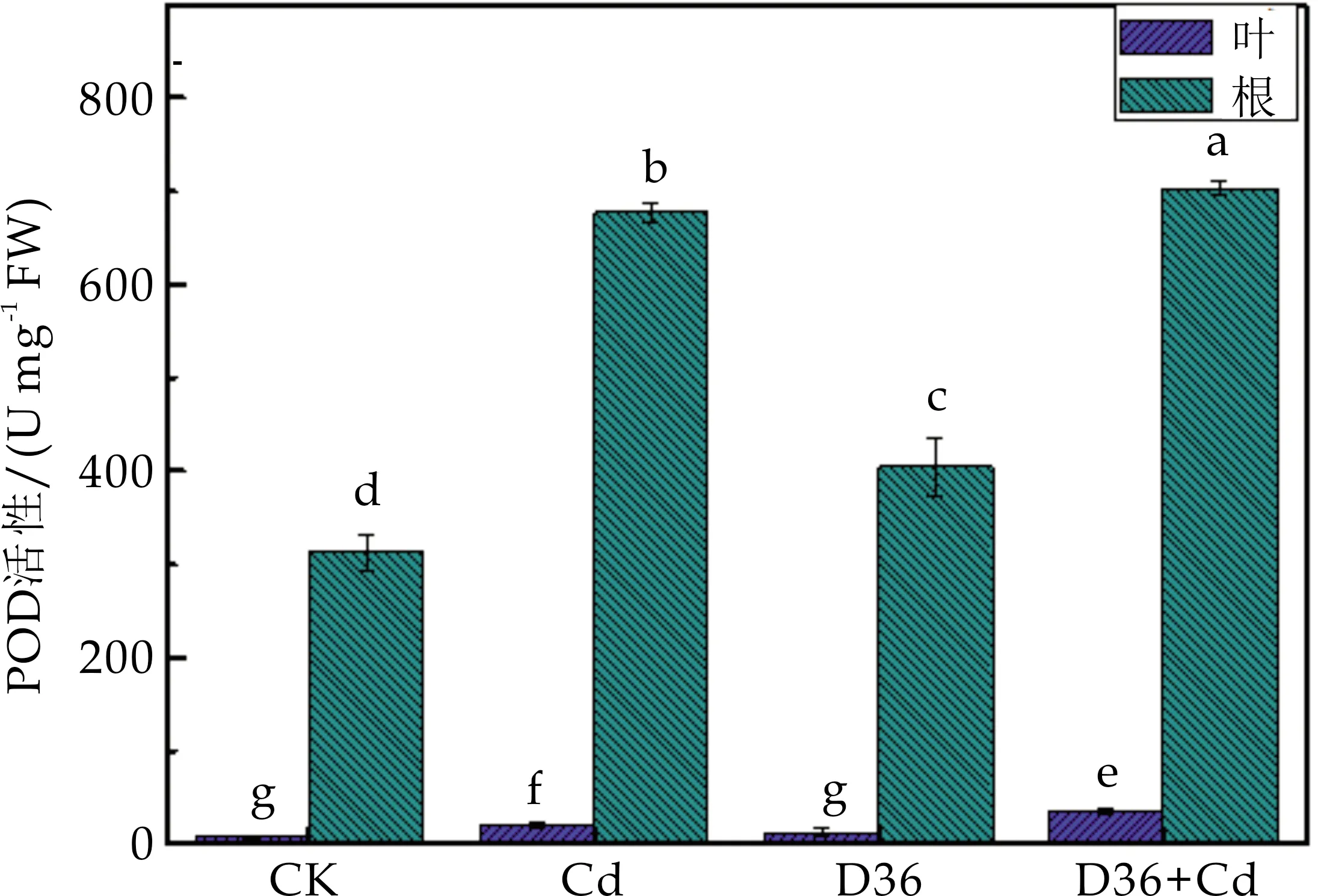
图6 不同处理对番茄幼苗POD活性的影响
2.8 接种D36对Cd胁迫下番茄Cd含量的影响
Cd虽不是植物的必须元素,但是可以通过质外体和共质体途径进入植物体内并在植物体内累积.研究表明,PGPR能调节不同植物的重金属吸收,且重金属毒性与植物体内重金属浓度直接相关[26].
本研究测定了接种D36对番茄Cd含量的影响,结果如图7所示,与Cd处理组相比,D36+Cd处理使得番茄根部的Cd含量降低了27.63%,地上部Cd含量无显著性差异(p<0.05).说明D36菌株能通过显著减少番茄地下部的Cd含量来缓解番茄的Cd毒害,从而减轻了Cd对番茄的氧化胁迫、生长抑制和对叶绿素合成的抑制.其原因可能是PGPR在一定条件下分泌的高分子聚合物,包括胞外多糖、蛋白质和核酸等,富含负电官能团,具有优越的金属键合性,与土壤中的重金属离子发生静电吸附作用,从而限制了金属离子的活动范围[27],同时,PGPR可通过调节细胞生理活动,诱导植物系统抗性,调控植物重金属的吸收、转运相关基因表达,从而调控植物体内的重金属浓度[7].
3 结论
本研究从Cd污染的番茄根际土壤中分离得到了D36菌株,经16S rDNA分子生物学鉴定为鞘安醇单孢菌,该菌具有溶磷、产IAA和产铁载体性能,并具有较高的Cd抗性.
水培实验结果显示,接种该菌显著提高了番茄的根长、株高以及植株鲜重,有效缓解Cd胁迫对番茄生长的抑制.也显著提高了番茄叶片中的叶绿素含量,降低了番茄根部的H2O2含量并提高POD活性,同时,接种D36有效降低番茄根部的Cd含量,从而提高番茄的Cd抗性,减轻Cd对番茄的毒害.该研究可以为采用环境友好型的植物根际促生菌调控作物Cd累积、缓解植物Cd胁迫提供理论依据.

