4-巯基苯硼酸修饰二维二硫化钼纳米复合材料的制备及其用于N-糖肽特异性富集
张汉卿, 秦伟捷, 张养军*
(1. 安徽医科大学研究生院, 安徽 合肥 230032; 2. 军事医学研究院生命组学研究所, 北京蛋白质组研究中心, 蛋白质组学国家重点实验室, 北京 102206)
蛋白质的糖基化作为细胞调节机制的关键途径之一,在多种生物过程中扮演着至关重要的角色,如细胞免疫、信号传导、细胞生长与分化、蛋白质降解以及炎症产生等[1-4]。目前针对N-糖基化蛋白的研究策略主要是先将蛋白酶切成肽段后再进行质谱鉴定,在这一过程中,由于生物样品中存在高丰度非糖肽的抑制,使N-糖基化肽段的质谱分析变得尤为困难。因此,发展从复杂生物样本中选择性富集N-糖肽对糖蛋白质组的研究至关重要。
近年来,已发展出多种不同原理的方法用于N-糖基化肽段的富集分离,包括凝集素亲和层析法、酰肼化学法、亲水作用色谱法和硼酸化学法等。凝集素亲和层析法是目前使用较为广泛的糖基化肽段富集方法,然而凝集素只针对特殊的聚糖发生特异性反应,阻碍了糖基化肽段的整体鉴定分析[5]。酰肼化学法是利用酰肼基团和糖肽之间形成的特异性共价键,以达到对糖肽的准确识别,但该方法程序颇为复杂且耗时,并遗失了聚糖的部分结构信息[6]。亲水作用色谱法优点在于提供完整碳水化合物基团信息,但由于相互作用弱,限制了在复杂生物样本中的选择性和灵敏度[7]。硼酸化学法优点在于可以提供完整碳水化合物基团信息,因其操作简便、适应性广和兼容性好等优点,在糖基化肽段的富集方面受到越来越多的关注[8-10]。但是现有的富集工具常常存在选择性差、空间位阻大等问题,经常导致其在复杂生物样本应用中灵敏度差,负载量低等。因此,开发一种性质稳定、富集效率高的糖基化肽段富集材料具有十分重要的意义。
得益于功能材料的快速发展,越来越多的纳米材料被成功应用于蛋白质组学的领域当中,如二氧化硅、石墨烯和金属有机框架(MOFs)等[11-14]。二硫化钼(MoS2)作为一种重要的类石墨烯的二维层状纳米材料,由于其特有的物理化学性质,在析氢反应、复合材料和疾病治疗诊断等不同领域受到越来越多的关注[15-18]。相比于二氧化硅等材料的三维立体结构,类石墨烯的二硫化钼呈现出纳米尺度的二维层状形态,其末端裸露的活性硫原子提供了大量的可修饰位点。在此基础上,本研究利用快速便捷的两步“金-硫”(Au-S)反应在二硫化钼表面上负载4-巯基苯硼酸(4-MPB)制备出新型功能纳米复合材料MoS2/Au/4-MPB。超薄二维层状纳米结构的二硫化钼具有较小的分子间阻力,能有效减少材料间的非特异性吸附与传质阻力。此外,4-巯基苯硼酸对糖基化肽段的高度选择能力使得复合材料在实际生物样本检测中展现出高效的N-糖基化肽段选择性,为糖基化蛋白质组深度覆盖分析提供了一种新方法。
1 实验部分
1.1 仪器与试剂
Hitachi 4800发射扫描电子显微镜(日立,日本), FEI Tecnai G20透射电子显微镜(FEI,美国), Bruker D8 Advance衍射仪、Ultrafle Xtreme MALDI TOF/TOF基质辅助激光解析飞行时间质谱仪(Bruker,德国), SDTQ600热分析仪(TA,美国), Nano Drop 2000C超微量分光光度计、Easy NLC-1000 LC-MS/MS纳升级液相色谱-串联Q Exactive Plus质谱仪(Thermo Fisher Scientific,美国), Zeta View PMX 110纳米颗粒跟踪分析仪(Particle Metrix,德国), Concentrator plus真空离心浓缩仪(Eppendorf,德国)。
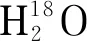
1.2 MoS2/Au/4-MPB复合纳米材料的制备
1.2.1MoS2纳米材料的制备
依据文献方法[19,20],经过对溶剂热法进行适当修改制备超薄二硫化钼纳米材料。将1.21 g Na2MoO4·2H2O、1.52 g (NH2)2CS、和30 mg PEG-20000加入30 mL超纯水中,机械搅拌30 min,超声涡旋获得均一透明的溶液。将所得溶液转移至50 mL不锈钢高压反应釜中密封,于220 ℃下加热反应24 h后,冷却至室温。将反应产物在1 500 g条件下离心15 min,移取沉淀,依次使用30 mL超纯水、30 mL乙醇洗涤沉淀两次,30 mL去离子水洗涤沉淀3次,每次洗涤在1 500 g条件下离心15 min,移取沉淀。最后将所得黑色粉末在60 ℃真空条件下干燥6 h,保存备用。
1.2.2MoS2/Au/4-MPB纳米复合材料的制备
依据文献报道[21,22]的制备方法适当修改,用于新型功能纳米复合材料的制备。将20 mg MoS2黑色粉末、3 mg三水合四氯化金(Ⅲ)、100 μL油胺和150 μL三异丙基硅烷混合于3 mL正己烷中,室温静置4 h,分别使用正己烷和乙醇清洗,向所得沉淀中加入4 mL含20 mg 4-巯基苯硼酸的乙醇溶液,在室温条件下振荡混合12 h。使用离心方法将所得沉淀依次使用5 mL去离子水、乙醇洗涤两次,将沉淀在60 ℃真空条件下干燥4 h,得到黑色粉末,保存备用。
1.3 标准蛋白与尿液外泌体蛋白的制备
1.3.1标准蛋白酶切
称取1 mg IgG和1 mg BSA,分别溶解在1 mL 50 mmol/L碳酸氢铵(pH=8.4)中,使其质量浓度为1 μg/μL,加入100 mmol/L的DTT 111 μL(终浓度为10 mmol/L),于60 ℃下加热还原1 h,随后降至室温;加入500 mmol/L的IAA 111 μL(终浓度为50 mmol/L),于室温、暗处烷基化反应30 min。以胰蛋白酶与蛋白质质量比1∶50的比例加入胰蛋白酶,于37 ℃下恒温孵育过夜。孵育结束后使用C18脱盐柱进行脱盐分装,于45 ℃真空离心浓缩,于-20 ℃冰箱中储存,备用。
1.3.2尿液外泌体蛋白的提取及酶切
尿液采集:采集3名20~25岁健康成年男性志愿者晨起首次排尿尿液50 mL,然后立即处理,无需保存。
尿液外泌体蛋白提取:使用Thery等[23,24]的方法,以300 g离心10 min、2 000 g离心10 min和10 000 g离心30 min分别去除全细胞、死细胞和细胞碎片;将上清液以110 000 g离心70 min,得到的沉淀为外泌体的粗提取物;将获得的外泌体粗提取物使用1×PBS洗涤2次(110 000 g, 70 min),去除污染蛋白质,得到外泌体。提取的尿液外泌体使用8 mol/L尿素复溶,使用超声波细胞破碎仪200 W破碎30 min提取蛋白质,将提取的蛋白质于-80 ℃冰箱中储存,备用。
尿液外泌体蛋白酶切:使用超滤管酶切(FASP)[25],将提取的外泌蛋白溶液加入30 kDa超滤管,使用8 mol/L尿素以14 000 g离心洗涤12 min,重复1次,之后加入终浓度10 mmol/L DTT,于37 ℃还原4 h;继续使用8 mol/L尿素以14 000 g离心12 min洗涤2次,去除DTT;随后向超滤管中加入终浓度为50 mmol/L的IAA,于室温暗处烷基化反应30 min。分别使用8 mol/L尿素、50 mmol/L碳酸氢铵(pH=8.4)以14 000 g、12 min离心清洗3次。使用Nano Drop检测样本浓度,以胰蛋白酶与蛋白质质量比1∶50加入胰蛋白酶,于37 ℃恒温孵育12 h;将恒温孵育后的样本以14 000 g离心12 min获得滤液,之后加入100 μL超纯水再次离心,留超滤液测量肽段浓度,于45 ℃真空离心浓缩后,于-20 ℃冰箱中储存,备用。
1.4 标准样品中糖肽的富集
参考之前的文献[26]方法并进行适当优化。将含有2 μg IgG酶解肽段的100 μL富集缓冲液(50 mmol/L碳酸氢铵,pH=8.4)与50 μg MoS2/Au/4-MPB混合,振荡30 min进行N-糖肽的富集;使用100 μL富集缓冲液离心洗涤3次,去除未吸附样本,再加入50 μL洗脱缓冲液(ACN-H2O-TFA, 30∶69∶1, v/v/v)振荡1 min,洗脱吸附的N-糖肽,通过C8膜将洗脱液与材料分离,洗脱液于45 ℃真空离心浓缩后于-20 ℃储存备用。
1.5 PNGase F酶去糖基化
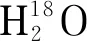
1.6 分析条件
MALDI-TOF MS:脉冲激光波长设置为337 nm,加速电压20 kV采集质谱图。使用ACN-H2O-H3PO4(70∶29∶1, v/v/v)配制DHB溶液(25 mg/mL)作为基质溶液。将样品(0.5 μL)和基质溶液(0.5 μL)混合点在靶板上,于室温下干燥,然后用MALDI-TOF MS分析。
LC-MS/MS:将酶切后的肽段复溶于0.1%(v/v)FA水溶液中,通过LC-MS/MS分析。流动相A为0.1%(v/v)FA水溶液;流动相B为含0.1%(v/v)FA的乙腈溶液。在C18反相分析柱(1.9 μm)上以600 nL/min的流速进行梯度洗脱。洗脱梯度:0~16 min, 5%B~12%B; 16~51 min, 12%B~24%B; 51~66 min, 24%B~32%B; 66~67 min, 32%B~95%B; 75 min, 95%B。质谱数据采集在数据依赖模式下(data-dependent acquisition, DDA)模式下进行,设置一级质谱全扫描范围为300~1 400 Da,扫描分辨率为120 000,选择一级质谱中丰度最高的20个母离子经高能碰撞诱导解离模式(higher-energy collisional dissociation, HCD)后进行二级质谱分析,分辨率为15 000,离子注入时间为35 ms,高能诱导解离能量为35%。
1.7 数据检索
使用MaxQuant软件(版本1.6.4.3)对LC-MS/MS数据进行检索,数据库为UniProt人类蛋白质组数据库(July 2015, 20207)。检索条件:选择胰蛋白酶作为蛋白水解酶,最大允许两个漏切位点;半胱氨酸氨基脲甲基化(carbamidomethyl, C)设置为固定修饰;甲硫氨酸氧化(oxidation, M)、蛋白质N-末端乙酰化(acetyl, proteinN-term)和脱酰胺基(deamidated,18O)设置为可变修饰;母离子和碎片离子的最大质量容差分别设置为1.5×10-5mg/L和0.5 Da,蛋白质的假阳性率(FDR)水平为1%。在搜索结果中,只有包含N#XSer/Thr/Cys(N#表示糖基化位点,X是除脯氨酸之外的任一氨基酸)固定氨基酸序列和脱酰胺基18O(N)的肽段才被确定为N-糖肽。
2 结果与讨论
2.1 MoS2/Au/4-MPB功能纳米复合材料的表征
MoS2/Au/4-MPB功能纳米复合材料的制备过程见图1。首先在MoS2二维层状表面通过“Au-S”反应固定纳米金线,然后再次通过“Au-S”反应使纳米金线与4-MPB进行特异性结合,将4-MPB负载在MoS2表面,得到MoS2/Au/4-MPB功能纳米复合材料。

图 1 MoS2/Au/4-MPB功能纳米复合材料的制备流程图Fig. 1 Functional nanocomposite preparation workflow of molybdenum disulfide/gold/4-mercaptophenylboronic acid (MoS2/Au/4-MPB)

图 2 (a)MoS2扫描电镜图、(b)透射电镜图以及(c)MoS2/Au透射电镜图Fig. 2 (a) Scanning electron microscope (SEM) image of the MoS2, (b) transmission electron microscope (TEM) image of the (b) MoS2 and (c) MoS2/Au
使用扫描电镜(SEM)和透射电子显微镜(TEM)对合成材料的形态结构进行表征。如图2所示,合成的二硫化钼呈现半透明“万花筒”状结构,可以为后续反应提供大量的可修饰位点。如图2a和图2b所示,二硫化钼直径分布约为70~300 nm,符合纳米材料的尺寸特征(1~100 nm)。由图2c可以看出,在固定金纳米颗粒后大量纳米金线(直径约为10 nm)均匀分布于超薄二维二硫化钼纳米材料表面,增加了二维二硫化钼纳米材料的表面活性位点,有利于修饰大量的活性基团4-巯基苯硼酸。

图 3 (a) 4-MPB、MoS2/Au/4-MPB的红外光谱图、(b) MoS2、MoS2/Au/4-MPB的X射线衍射图谱和(c) MoS2/Au、MoS2/Au/4-MPB的热重曲线图Fig. 3 (a) FT-IR spectra of 4-MPB and MoS2/Au/4-MPB, (b) X-ray diffraction patterns of MoS2 and MoS2/Au/4-MPB and (c) thermogravimetric analyzer (TGA) curves of MoS2/Au and MoS2/Au/4-MPB
此外,实验还使用不同表征方法进行表征,以确定MoS2/Au/4-MPB纳米复合材料的组成和性能。首先,对制备的材料进行了红外光谱(IR)分析,如图3a所示,合成后MoS2/Au/4-MPB在500~1 500 cm-1出现与4-MPB相似的指纹峰,表明4-MPB已成功连接到MoS2/Au复合材料上。对制备的材料进行X射线衍分析,结果如图3b所示,可以看出,在14°(002)、33°(101)、40°(222)、59°(110)处的衍射峰,与2H-MoS2的标准图谱所对应的特征峰位匹配(JCPDS 37-1492),说明该方法可以制备均一稳定的二维二硫化钼纳米材料。在负载纳米金线后,在64.5°(221)、77.6° (311)处出现Au的特征峰(JCPDS 79-0418)。这些特征峰表明金纳米颗粒成功固定在二硫化钼纳米材料表面。
进一步通过热重分析(TGA)评价4-MPB的负载量,如图3c所示,在400~800 ℃后,新型功能复合材料的热重损失达到16.8%,这是由于复合材料中4-巯基苯硼酸的热分解而形成,表明大量的4-巯基苯硼酸成功修饰在纳米金线上,并负载在二硫化钼纳米材料表面。

图 4 IgG胰蛋白酶消化物(1 μg)的MALDI-TOF质谱图Fig. 4 Matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF MS) spectra of immunoglobulin G (IgG) tryptic digest (1 μg)a. direct analysis; b. after enrichment by MoS2/Au/4-MPB; c. after enrichment by MoS2/Au/4-MPB and deglycosylation by PNGase F.
2.2 MoS2/Au/4-MPB纳米复合材料用于富集标准蛋白酶切的糖肽
为了考察MoS2/Au/4-MPB纳米复合材料对糖肽的富集性能,实验采用IgG的胰蛋白酶酶解产物(1 μg)作为标准样品,并选择50 mmol/L碳酸氢铵(pH=8.4)作为富集缓冲液[12,26]。如图4a所示,在富集前,IgG酶切产物质谱图中被大量的高丰度非糖肽峰占据,当使用MoS2/Au/4-MPB纳米复合材料富集后,非糖基化肽段在质谱图上几乎消失,同时富集到32条归属于IgG蛋白的N-糖肽(见图4b和附表S1,详见www-chrom-China.com)。
为了进一步验证MoS2/Au/4-MPB富集所得的糖基化肽段的准确性,将富集所获得的产物经PNGase F酶处理,去除N-糖链后再进行MALDI-TOF MS分析,如图4c所示,去糖基化后可以鉴定到2条肽段的质谱峰(m/z=1 158和1 190),与文献[27]相符合,同时原有的糖基化肽段质谱峰消失,进一步说明富集产物质谱图中的各个质谱峰均归属于IgG胰蛋白酶酶切产物中的N-糖基化肽。上述结果表明,4-巯基苯基硼酸中独特的硼酸基团对N-糖肽具有高度的选择性,MoS2/Au/4-MPB功能纳米复合材料对N-糖基化肽段具有优异的富集性能。

图 5 MoS2/Au/4-MPB富集IgG胰蛋白酶消化物的MALDI-TOF质谱图Fig. 5 MALDI-TOF MS spectra of IgG tryptic digest enriched by MoS2/Au/4-MPBa. 1 pmol; b. 100 fmol; c. 5 fmol.
为了考察MoS2/Au/4-MPB功能纳米复合材料对N-糖基化肽段的富集灵敏度,实验制备了系列不同浓度的IgG胰蛋白酶酶切产物,对富集材料的富集灵敏度进行了考察。如图5所示,当IgG的用量为1 pmol(见图5a)和100 fmol(见图5b)时,通过MoS2/Au/4-MPB分别富集到18条和12条N-糖肽;当IgG的用量低至5 fmol(见图5c)时,仍有2个N-糖基化肽段可以被精确检测到,表明了MoS2/Au/4-MPB功能纳米复合材料对低丰度糖肽的具有高的富集能力。与之前报道的有关富集材料TCNBA[9]、GO/Fe3O4/Au/PEG[13]相比,MoS2/Au/4-MPB的检测灵敏度要高2~50倍。表明MoS2/Au/4-MPB在分析微量N-糖肽样本中有巨大优势。

图 6 MoS2/Au/4-MPB富集IgG和BSA胰蛋白酶消化物混合物的MALDI-TOF质谱图Fig. 6 MALDI-TOF-MS spectra of N-glycopeptides enriched from the mixture of tryptic digested IgG and bovine serum albumin (BSA) by MoS2/Au/4-MPBa. before enrichment; b and c. after enrichment (amount of substance ratios of IgG to BSA were 1∶100 and 1∶1000).
为了进一步验证MoS2/Au/4-MPB功能纳米复合材料的选择性以及适用性,实验以物质的量之比1∶100和1∶1 000(IgG∶BSA)的混合酶解液作为样本,对MoS2/Au/4-MPB纳米复合材料进行考察。因为非糖肽的高丰度抑制,在富集前均不能检测到糖肽(见图6a);当使用MoS2/Au/4-MPB功能纳米材料富集后,非糖基化肽段消失,由图6b和6c可以看出,当物质的量之比为1∶100和1∶1 000时,分别鉴定出11个和3个N-糖肽,且无其他非糖肽峰出现。与之前报道的材料TCNBA[9]、AAPBA-硅胶杂化亲和整体柱[27]相比,MoS2/Au/4-MPB在标准蛋白(IgG)胰蛋白酶酶切产物中具有更高的选择性(100倍)。
MoS2/Au/4-MPB对于糖基化肽段的负载能力也是功能化纳米复合材料的重要特性之一。实验分别将不同质量的新型功能化纳米材料与2 μg IgG胰蛋白酶酶切产物混合,富集洗脱后通过质谱分析。在5次的重复试验中,选择富集肽段中6条质谱信号值强的肽段作为检测指标,当新型功能化纳米材料的使用量为20 μg时选择肽段质谱峰信号强度达到最大值(见图7)。此时经过计算MoS2/Au/4-MPB对IgG胰蛋白酶酶切产物最大负载量约为100 μg/mg。负载量实验结果表明新型功能纳米复合材料表面存在着大量的4-巯基苯硼酸活性基团,有利于对生物样品中N-糖基化肽段的选择性富集。

图 8 尿液外泌体的(a)透射电镜图和(b)粒径分布图Fig. 8 (a) TEM image and (b) particle size distribution of urine exosomes

图 7 MoS2/Au/4-MPB的质量对IgG胰蛋白酶 消化物富集效果的影响(n=5)Fig. 7 Effect of quality of MoS2/Au/4-MPB on the enrichment effects of IgG trypsin digest (n=5)
2.3 MoS2/Au/4-MPB纳米复合材料用于富集尿液外泌体蛋白酶切产物中的N-糖肽
外泌体是细胞分泌的具有双层生物膜的囊泡,大小为30~150 nm[29],能运载细胞内的多种生物大分子,如脂类、microRNA、蛋白质等[18,30,31]。越来越多的研究[32-35]证实外泌体可以作为许多疾病的潜在生物标志物。但是目前有关尿液外泌体糖蛋白质组的研究较少,为了进一步考察纳米复合材料在复杂生物样本中对糖基化肽段的富集性能,实验选取了健康人尿液外泌体蛋白作为研究对象。与此同时为了验证使用超速离心所获样本为外泌体,将所获样本进行了纳米颗粒粒径分析以及透射电镜表征(见图8),证明所获样本为尿液外泌体。
将1 mg新型功能纳米材料与50 μg尿液外泌体蛋白质提取物的胰蛋白酶酶切产物进行混合富集,将富集所得的肽段样本使用LC-MS/MS进行质谱鉴定。在3次重复实验中分别从279、270、279个蛋白质中鉴定到536、515、487个N-糖基化肽段,任意两次至少鉴定出85%的N-糖基化肽段,将3次数据进行综合后,一共鉴定到768个N-糖肽归属于377个N-糖蛋白。表明制备的新型功能化材料对生物样本有很好的富集选择性。上述结果表明,基于4-MPB的新型功能纳米材料在糖基化蛋白组研究中有着巨大的应用潜力。
3 结论
利用超薄二维二硫化钼纳米材料作为固相基质结合4-巯基苯硼酸发展了一种用于N-糖基化肽段富集的新型功能纳米复合材料MoS2/Au/4-MPB。新型功能纳米复合材料制备条件温和,操作简单。实验结果表明,新型功能纳米材料对于低丰度N-糖基化肽段的分离与鉴定具有普适性。此外,将这种新型功能化纳米材料应用于尿液外泌体蛋白酶解产物中N-糖基化肽段的选择性富集和质谱分析,鉴定到了768种N-糖基化肽段,归属于377个N-糖蛋白,说明本工作发展的新型功能化纳米材料在复杂生物样品的糖基化蛋白质组研究中具有很大应用潜力。

