柱前衍生-高效液相色谱法同时测定血清中氨基酸类及单胺类神经递质
白 洁, 王 妲, 刘泽平, 张佳琪, 刘丽艳, 韩艳梅*
(1. 河北大学公共卫生学院, 河北 保定 071000; 2. 河北大学医学综合实验中心, 河北 保定 071000)
神经递质(neurotransmitter)是体内负责在神经元与其他细胞类型间传递或调控特定信号的化学分子[1]。神经递质广泛分布于哺乳动物的中枢神经系统、脑组织和体液中,参与了大部分机体内重要的生理机能运转[2],神经递质浓度的变化与许多精神和生理疾病有关,例如阿尔茨海默症[3]、癫痫[4]、精神分裂症[5]、缺血性脑损伤[6]等,因此其痕量测定对神经生理学[7]、运动生理学[8]、病理学[9]、临床医学及疾病诊断[10]等具有重要意义。
在生物样品中,神经递质的含量较低,而且基质复杂,内源性成分干扰较大,因此对神经递质的准确分析检测存在很大困难。目前,测定生物样品中神经递质的方法主要有高效液相色谱法[11-13]、液相色谱-质谱法[14-17]、气相色谱-质谱法[18]、高效毛细管电泳法[19]、电化学分析法[20],拉曼光谱法[21]等。神经递质种类众多,包括氨基酸类、单胺类、胆碱类和肽类等。神经递质在生物体内发挥功能通常是多种神经递质联合作用的结果。氨基酸类神经递质与单胺类神经递质是调节神经生理功能的重要物质,人们探讨精神类疾病[22]、缺血性脑损伤[23]等多种疾病的发病机制,以及衡量药物的治疗效果时,常常需要同时测定这两类神经递质的含量。由于这两类神经递质结构存在差异,理化性质不同,因此现有的方法仍大多为单独测定某一类神经递质,如单独测定氨基酸类神经递质[24]或者单独测定单胺类神经递质[12]。检测氨基酸类神经递质的方法多为高效液相色谱法,由于氨基酸分子结构较小,且大多没有光学性质,因此一般先将其衍生化,再利用色谱进行定性定量分析。常用的衍生试剂包括邻苯二甲醛(OPA)、苯异硫氰酸酯(phenyl isothiocyanate, PITC)、2,4-二硝基氟苯(2,4-dinitrofluorobenzene, DNFB)、芴甲氧羰酰氯(9-fluorenylmethyl chloroformate, FMOC-Cl)、丹酰氯(dansyl chloride, Dansyl-Cl)等[25]。PITC衍生法衍生产物单一、稳定,在一定条件下可保存较长时间,但PITC含有较大毒性与挥发性,具有一定危险性;DNFB衍生法衍生物单一、稳定,但在衍生过程中会产生副产物,干扰检测结果;FMOC-Cl衍生法所得衍生产物稳定,且色谱分离速度较快,分辨率较好,不被样品基质所影响,但试剂自身会水解,且水解产物有荧光性,检测时易受到干扰;Dansyl-Cl衍生法衍生试剂与氨基酸反应活性差,速度慢,重复性差,衍生产物不稳定,需衍生后立即分析;OPA衍生法样品制备简易,灵敏度高,便于实现自动化。目前同时测定氨基酸类和单胺类神经递质的方法较少,主要为液相色谱-串联质谱法[17,26,27],此法灵敏度高,分离度好,定量准确,但是需要昂贵的检测仪器。
因此非常有必要建立一种简单、快速,能同时测定氨基酸类和单胺类神经递质的方法。OPA能与氨基发生衍生化反应,而氨基酸类和单胺类神经递质一般都含有氨基,因此让氨基酸和单胺类神经递质与OPA发生衍生化反应后,再通过液相色谱进行梯度洗脱,在相同色谱条件下同时测定是可行的。基于此,本实验利用OPA柱前衍生-高效液相色谱法,建立了一种同时测定氨基酸类和单胺类共5种神经递质的快速定量方法。本方法操作简单,灵敏度高,方法学指标好,有望用于血清中氨基酸类及单胺类神经递质的同时检测。这可为相关疾病的诊断、致病机制的研究提供参考信息。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪(LC-20 ATVP,配有SPD-20A检测器)、十万分之一电子天平(AUW120D)(岛津公司,日本);酸度计(DELTA-320型,梅特勒-托利多,瑞士);离心机(TGL-16G,上海安亭科学仪器厂,中国);氮气吹干仪(上海旌派仪器有限公司,中国);超纯水系统(Milli-Q, Millipore公司,美国)。
牛磺酸(taurine, Tau)、谷氨酸(glutamic acid, Glu)、甘氨酸(glycine, Gly)、γ-氨基丁酸(γ-aminobutyric acid,γ-GABA)、盐酸多巴胺(dopamine, DA)(纯度>99.0%)和山羊血清(批号:E815FC0252)(生工生物工程(上海)股份有限公司,中国); OPA(纯度>98.0%,艾览(上海)化工科技有限公司,中国);甲醇、乙腈(色谱纯,天津市康科德科技有限公司,中国)。其余试剂均为分析纯;实验用水均为二次去离子水。
1.2 标准溶液的配制
标准储备液:精确称取5种神经递质,分别用水溶解,定容至10 mL容量瓶中,制成浓度为0.05 mol/L的标准储备液,于4 ℃冰箱中保存备用,使用时移取标准储备液,用水逐级稀释至所需浓度。
衍生试剂:取0.013 4 g OPA,加入1 mL无水乙醇、20 μL 2-巯基乙醇、4 mL 0.1 mol/L四硼酸钠(取硼酸0.154 6 g硼酸,置于10 mL容量瓶中,加入0.5 mL 5 mol/L氢氧化钠,用二次去离子水定容),密封后低温避光保存。
1.3 样品前处理
将血清样品与乙醇以1∶2(v/v)的比例混匀,涡旋30 s,冰浴10 min,离心50 min(15 000 r/min, 4 ℃),取其上清液,氮吹至近干。前处理后的样品与衍生试剂OPA进行柱前衍生,经0.45 μm滤膜过滤,得到滤液后上机进样。
1.4 色谱条件
色谱柱:Luna 5u C18色谱柱(250 mm×4.6 mm, 5 μm);柱温:30 ℃;流动相:(A)柠檬酸-乙酸钠缓冲溶液(包括50 mmol/L柠檬酸、50 mmol/L乙酸钠和0.5 mmol/L乙二胺四乙酸二钠,pH 3.73)和(B)乙腈;流速:1 mL/min;进样量:20 μL;检测波长:338 nm。梯度洗脱程序见表1。
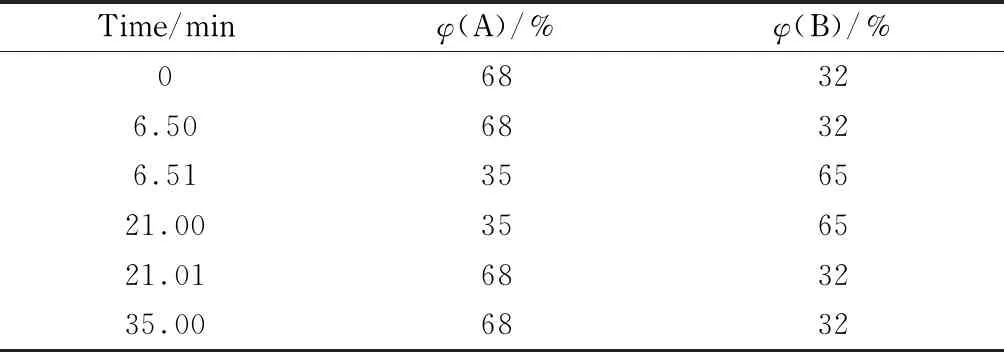
表 1 梯度洗脱程序
2 结果与讨论
2.1 色谱及衍生化条件的优化
2.1.1缓冲体系的种类
实验分别考察了柠檬酸-乙酸钠与磷酸二氢钾-磷酸这两种缓冲体系对分离效果的影响。结果表明,以磷酸二氢钾-磷酸为缓冲体系时,目标物峰形较差且未完全分离,无法满足定性及定量需求;以柠檬酸-乙酸钠为缓冲体系时目标物峰形对称、尖锐,分离效果更好,且5种神经递质均达到基线分离。
2.1.2缓冲体系的pH值
实验考察了缓冲体系pH值(3.00~5.00)对体系分离度及灵敏度的影响。结果表明,当pH值为3.00时,样品分离度较差,灵敏度较低,随着pH的逐渐升高,灵敏度也逐渐增高;当pH值升至3.73时,衍生产物的灵敏度较高且分离度较好;当pH值大于3.73时,样品中目标物未完全分开,分离度较差。因此选择3.73为缓冲体系最适pH值。
2.1.3缓冲溶液的用量
实验考察了缓冲体系中柠檬酸和乙酸钠的浓度(10~70 mmol/L)对混合神经递质标准品和实际样品体系分离效果的影响。当缓冲体系中柠檬酸和乙酸钠的浓度较低,为10 mmol/L时,灵敏度较低;浓度较高时,由于盐浓度增大,会导致柱压升高;浓度为50 mmol/L时,标准品和样品体系灵敏度均最高,且分离度较好。因此缓冲溶液柠檬酸和乙酸钠的最佳浓度为50 mmol/L。
为络合水及动物组织中的微量金属离子,在流动相中加入了少量乙二胺四乙酸二钠(0.5 mmol/L)[12]。
2.1.4梯度洗脱程序的优化
实验首先进行了等度洗脱试验,流动相A同1.4节,流动相B中乙腈的体积分数为40%。结果显示,虽然各组分分离度较好,但保留时间较长,尤其是γ-GABA和DA,且色谱峰展宽严重,灵敏度较低。因此采用梯度洗脱程序优化分离效果。
流动相条件同1.4节描述,优化的梯度洗脱程序由3个子梯度程序组成:
(1)洗脱Tau、Glu和Gly 3种弱保留组分,时间为0~6.50 min。在此时间段,考察了流动相中有机相乙腈的体积分数(20%、25%、30%、32%、35%、40%、45%、55%和60%)对3种弱保留组分分离效果的影响。结果显示,有机相加入比例过小,柱压升高且分离时间过长;有机相加入比例为32%时,3种组分分离效果最佳;有机相比例过大,样品峰未完全分离。因此在0~6.50 min期间,有机相的体积分数设为32%。
(2)γ-GABA和DA的分离时间为6.51~21.00 min。在此时间段,考察了流动相中有机相乙腈的体积分数(40%、45%、55%、60%、65%、70%和75%)对γ-GABA和DA 2种组分分离效果的影响。结果显示,有机相比例过小,柱压升高且分离时间过长;有机相加入比例为65%时,2种组分分离效果最佳;有机相比例过大(70%和75%),与有机相为65%的体系无显著性差异。因此在6.51~20.00 min期间,有机相的体积分数设为65%。
(3)系统平衡程序(21.01~35.00 min)。待目标物完全洗脱后,以初始洗脱条件对系统进行平衡。
混合标准溶液中5种神经递质在优化的梯度洗脱条件下实现了分离,且γ-GABA和DA的保留时间缩短,峰形尖锐。
2.1.5神经递质与衍生试剂比例的优化
分别考察了混合神经递质与衍生试剂OPA的物质的量之比(10∶1、5∶1、2∶1、1∶1、1∶2、1∶5、1∶10、1∶15、1∶20、1∶30)对检测结果的影响。结果如图1所示,当神经递质与OPA的物质的量之比过低时,神经递质峰面积过低,可能是因为衍生试剂不足,与神经递质反应不完全;随着衍生试剂比例的增大,各目标物的峰面积逐渐增大,当两者物质的量之比为1∶10时,神经递质达到基线分离,峰面积较高;继续增大OPA的比例,虽然有些神经递质峰面积稍有增长,但无显著性增加,同时色谱图基线也略有增高,且与单独测定OPA衍生试剂时基本吻合,判断为衍生试剂过量。因此选择神经递质与衍生试剂中OPA的物质的量之比为1∶10。

图 1 神经递质与OPA物质的量之比对神经递质峰面积的影响(n=3)Fig. 1 Effect of the amount of substance ratio of neurotransmitters to o-phthalaldehyde (OPA) on the peak area of neurotransmitters (n=3)Tau: taurine; Glu: glutamic acid; Gly: glycine; γ-GABA: γ-aminobutyric acid; DA: dopamine.
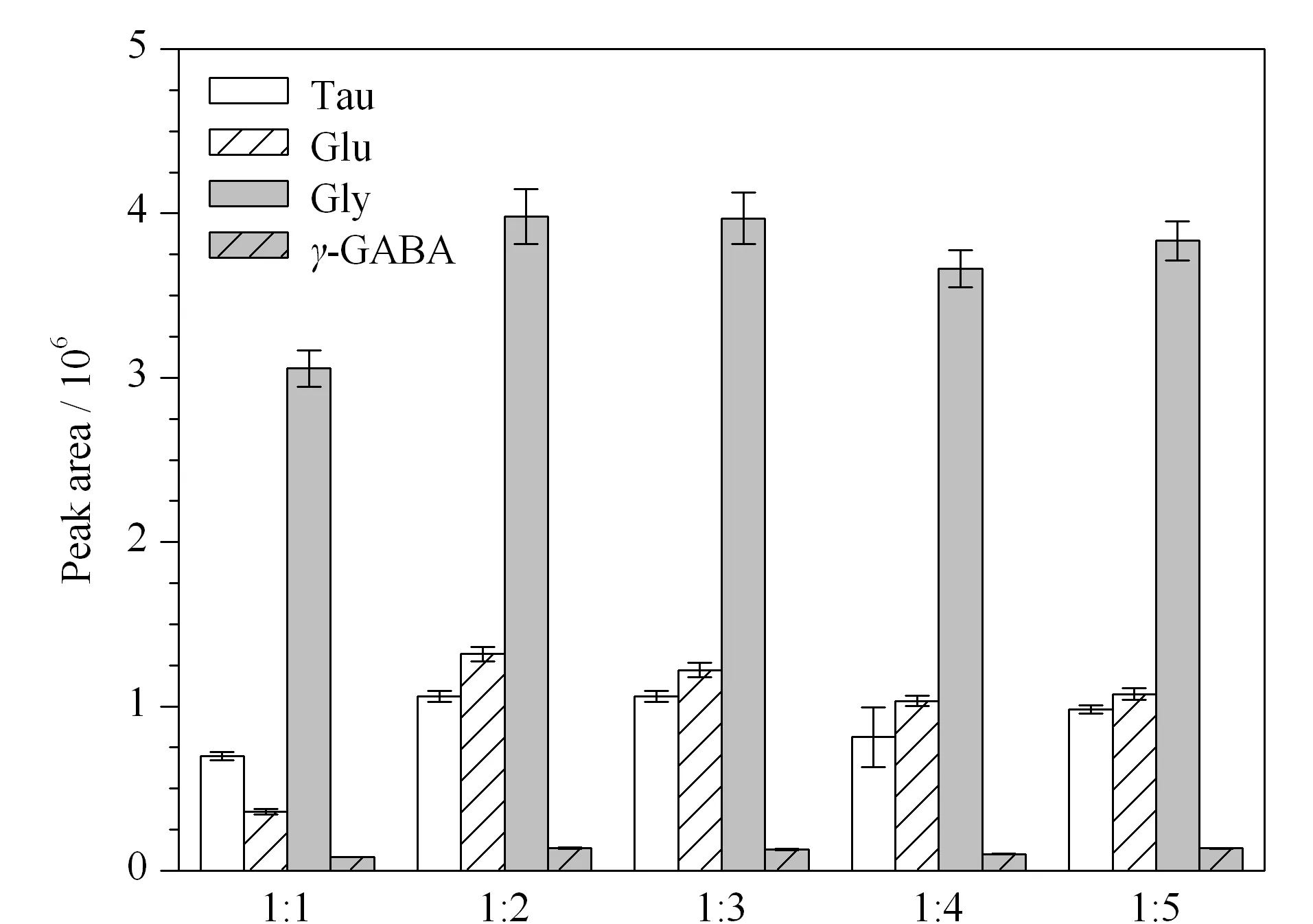
图 3 样品与乙醇的体积比对神经递质峰面积的影响(n=3)Fig. 3 Effect of volume ratio of the sample to ethanol on the peak area of neurotransmitters (n=3)
2.2 样品前处理条件的优化
2.2.1蛋白质沉淀剂的选择
本实验分别考察了乙腈、乙醇、甲醇、丙酮、异丙醇对血清样品中蛋白质沉淀的效果。结果如图2所示,以乙醇为蛋白质沉淀剂时,各神经递质的峰面积最高,而且分离效果较好;甲醇、乙腈、丙酮与乙醇相比各目标物的峰面积稍低;以异丙醇为沉淀剂时,基线未完全分离且峰形杂乱。因此选取乙醇为蛋白质沉淀剂。
2.2.2蛋白质沉淀剂的用量
本实验考察样品与乙醇的体积比(1∶1、1∶2、1∶3、1∶4、1∶5)对样品蛋白质沉淀效果的影响。结果如图3所示,样品与乙醇体积比为1∶1时,各目标物的峰面积均较低;当增大乙醇体积时,样品中各目标物的峰面积变化不大,表明样品与乙醇体积对样品沉淀影响不大,且各比例分离效果没有太大差别。因后续实验步骤涉及氮气吹干,结合考虑经济与时间成本,故选择样品与乙醇体积比为1∶2。

表 2 5种神经递质的线性方程、线性范围、相关系数及检出限
2.3 方法学考察
2.3.1专属性
精密量取一份5种神经递质的混合标准溶液;再分别取2份相同体积的样品,一份作为对照,另一份加入5种神经递质的混合标准溶液。分别按1.3节方法处理后进行分析,色谱图见图4。由图4a可以看出,混合标准溶液中5种目标物分离度良好,与血清样品(见图4b)相比,加标样品(见图4c)中各目标物的色谱响应均加强,并能与其他吸收峰相互分离,说明本实验方法具有较好的专属性。
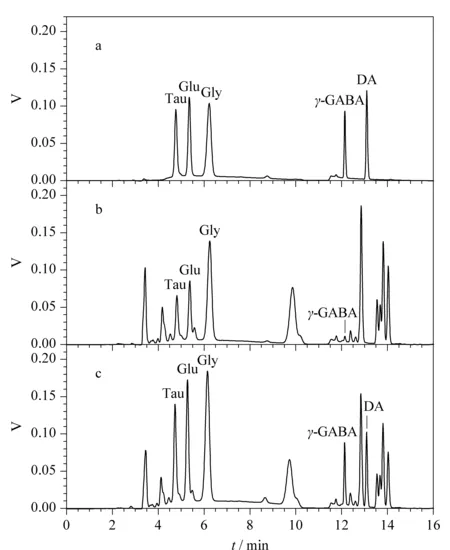
图 4 5种神经递质衍生后的色谱图Fig. 4 Chromatograms of the five neurotransmitters after derivatization a. standard solution; b. real sample; c. spiked sample.
平行取6份样品,按照1.3节的方法处理后进行分析,各色谱峰的保留时间变动均小于0.02 min,峰面积的RSD为1.84%~5.26%。说明本方法的重复性较好。
2.3.2线性关系和检出限
配制系列浓度的标准溶液,按照1.3节方法衍生后再按照1.4节方法进行色谱分析,以进样浓度(X, μmol/L)对峰面积(Y)作图,分别绘制5种神经递质的标准曲线。按3倍信噪比(S/N=3)计算检出限(LOD)。各神经递质的线性方程、线性范围、相关系数(r2)和LOD见表2。5种神经递质在各自的范围内线性关系良好,相关系数为0.986 6~0.996 6,检出限为0.10~0.40 μmol/L。
2.3.3回收率和精密度
分别取9份已知浓度的5种神经递质样品。每3份分别加入高、中、低3种浓度的神经递质混合标准溶液,按照1.3节方法进行衍生,然后进行色谱分 析(见表3)。结果表明,实际样品中5种神经递质的加标回收率为87.57%~115.31%, RSD为0.49%~7.80%。

表 3 (续)
选取一份样品,衍生过滤后,重复进样6针,各色谱峰保留时间的波动均小于0.02 min,峰面积的RSD为1.00%~5.60%。
2.4 实际样品的测定
本实验所用实际样品为市售山羊血清,采用已优化的样品处理方法对血清进行处理,并对其进行分析检测。各神经递质的含量分别为Tau 58.58 μmol/L、Glu 66.32 μmol/L、Gly 228.98 μmol/L、γ-GABA 3.42 μmol/L, DA未检出。
3 结论
本实验基于OPA柱前衍生-高效液相色谱法,建立了同时测定氨基酸类神经递质Tau、Glu、Gly、γ-GABA以及单胺类神经递质DA含量的方法。该方法操作简便,精密度、线性关系和回收率等方法学指标好,可为相关疾病的监测及科学研究提供参考。虽然本方法可以同时检出5种神经递质,但由于DA在血清中含量较低,本实验对于DA的检出限未达到血清中DA检测的要求,因此进一步提高方法的灵敏度将是下一步的研究重点。

