固相萃取-气相色谱-串联质谱法检测水中18种酚类化合物
李 杨, 张书芬, 邢家溧*, 应 璐, 承 海, 郑睿行, 毛玲燕, 李和生
(1. 宁波大学食品与药学学院, 浙江 宁波 315211; 2. 宁波市食品检验检测研究院, 浙江 宁波 315048)
随着焦化、炼油、冶金、煤气等工业的高速发展,各种含酚类化合物的废水的排放量也相应增加。近年来,各种酚类化合物污染引起的食用安全事故也频频发生,例如,湖北省梁子湖“五氯酚钠中毒”事件、江苏省“苯酚污染水源”事件,大众对酚类化合物已不再陌生[1]。此外,酚类化合物以其高毒性、长期蓄积性、持久性、潜在致癌性等特点受到越来越多学者的广泛关注[2-4]。目前,在各种酚类化合物污染事件中,水体中的酚类化合物污染最为严重,不仅危害大,污染范围也极广。基于酚类化合物具有强毒性和持久性的特点,美国环境保护署将其列为优先控制污染物。欧盟也规定饮用水中总酚含量不能超过0.5 μg/L和单个酚含量不能超过0.1 μg/L,同时,我国GB 8979-1996《污水综合排放标准》规定,挥发酚最高允许排放量为1.0 mg/L; GB 5749-2006《生活饮用水卫生标准》规定挥发酚的含量不得超过0.002 mg/L;其中GB 3838-2002《地表水环境质量标准》中指出,五氯酚(PCP)、2,4-二氯苯酚(2,4-DCP)、2,4,6-三氯苯酚(2,4,6-TCP)等酚类化合物标准限值不能超过0.009、0.093和0.2 mg/L。为了保障人类免受酚类污染物对健康的危害,必须对环境中酚类化合物进行监测和控制[5]。目前,我国水中酚类化合物测定采用HJ 744-2015《水质酚类化合物的测定 气相色谱-质谱法》,该标准方法采用五氟苄基溴衍生,测定2-氯苯酚(2-CP)、4-氯苯酚(4-CP)、PCP、2,4-二氯苯酚(2,4-DCP)、2,6-二氯苯酚(2,6-DCP)、2,4,6-三氯苯酚(2,4,6-TCP)、2,4,5-三氯苯酚(2,4,5-TCP)、2,3,4,6-四氯苯酚(2,3,4,6-TeCP)、4-硝基酚(AR)、2-甲酚(2-methylphenol)、3-甲酚(2-methylphenol)、4-甲酚(4-methylphenol)、2,4-二甲酚(2,4-dimethylphenol)等14种酚类化合物,该方法的检出限为0.1~0.2 g/L,定量限为0.4~0.8 g/L。鉴于当前对于水中所含酚类化合物的种类不清、危害不明,多种酚类化合物同时检测的方法还不成熟,对进一步提升检测分析效能提出了更高要求[6],因此建立水中多种酚类化合物同时高效的检测方法,为我国水中酚类化合物残留水平的控制、检测标准的制定和管理措施的采取,都具有重要的理论和现实意义。
目前,水中酚类化合物的研究大多集中于单一种类(如烷基酚类、溴酚类、硝基酚类等)或多种类少量酚类化合物的检测,如景阳等[7]利用高效液相色谱法检测水中4种常见的酚类化合物;李晓晴[8]建立了同时检测水中6种酚类化合物的新方法;Joaquin等[9]利用高效液相色谱法检测废水中5种合成的酚类抗氧化剂,Luo等[10]利用高效液相色谱法结合荧光法检测水中12种酚类化合物,这些方法虽然前处理简单,检出限低,灵敏度高,但只能同时检测少数酚类化合物。穆肃[11]建立了同时测定水质中12种硝基酚类的分析方法,但该方法只能检测水体中的硝基酚类化合物。而且当前酚类化合物的检测方法大都需要衍生[12,13],但衍生操作较复杂,反应条件苛刻,反应的副产物和过量的衍生化试剂可能会干扰目标化合物的分离与检测等。基于此,本研究拟开发一种不需要衍生,且能同时、准确检测多种酚类化合物的分析方法。
1 实验方法
1.1 仪器、试剂与材料
TSQ 8000 Evo气相色谱-三重四极杆质谱联用仪(美国Thermo Fisher Scientific公司); Vortex 3自动漩涡混合器(德国IKA公司);多功能全自动氮吹浓缩仪(瑞典Biotage AB公司); Oasis PRiMEHLB 3cc固相萃取小柱、固相萃取仪(美国Waters公司); pH酸度计(瑞士Mettler Toledo公司);超纯水仪(美国Millipore公司)。
酚类化合物标准品:辛基酚(OP)、双酚A(BPA)、2-溴苯酚(2-BP)、4-溴苯酚(4-BP)、2,4-二溴苯酚(2,4-DBP)、2,6-二溴苯酚(2,4-DBP)、2,4,6-三溴苯酚(2,4,6-TBP)、2-硝基酚(2-nitrophenol)、3-硝基酚(3-nitrophenol)、4-硝基酚、4-甲基-2-硝基酚(4-methyl-2-nitrophenol)、3-甲基-4-硝基酚(3-methyl-4-nitrophenol)、6-硝基间甲酚(5-methyl-2-nitrophenol)、2-硝基-3-甲基苯酚(3-methyl-2-nitrophenol)、2,6-二甲基-4-硝基酚(2,6-dimethyl-4-nitrophenol)购自浙江宁波航景生物科技有限公司;壬基酚(NP)、2,4-二硝基苯酚(DNP)和4,6-二硝基邻甲苯酚(2-methyl-4,6-dinitrophenol)购自上海安谱实验科技股份有限公司,以上标准品纯度均大于99%;甲醇、乙酸乙酯均为色谱纯,购自德国Merck公司;其他试剂均为国产分析纯。
酚类化合物具有不同的化学性质,所以仪器对不同酚类化合物的灵敏度也不同,为了方便后续研究,特将酚类化合物分为第一类酚类物质和第二类酚类物质。第一类酚类物质包括壬基酚、双酚A、2-溴苯酚、4-溴苯酚、2,4-二溴苯酚、2,6-二溴苯酚、2,4,6-三溴苯酚、2-硝基酚、3-硝基酚、4-甲基-2-硝基酚、6-硝基间甲酚、2-硝基-3-甲基苯酚和2,6-二甲基-4-硝基酚;第二类酚类物质包括辛基酚、4-硝基酚、2,4-二硝基苯酚、3-甲基-4-硝基酚和4,6-二硝基邻甲苯酚。
1.2 标准溶液的配制
以甲醇为溶剂,将18种酚类化合物标准品配制成1 g/L的标准储备液,然后用甲醇将1 g/L标准储备液稀释成100 mg/L的标准中间液,于-10 ℃条件下保存,备用。
按1∶10的体积比吸取标准中间液,用甲醇稀释配制成第一类酚类物质、第二类酚类物质的混合标准溶液,质量浓度分别为1.0 mg/L和10 mg/L;用甲醇逐级稀释,得第一类酚类物质质量浓度为0.50、1.00、5.00、10.00、20.00 μg/L,第二类酚类物质质量浓度为5.00、10.00、50.00、100.00、200.00 μg/L的混合标准使用液。
1.3 水样的制备
取100 mL超纯水,在水中加入酚类混合标准溶液,搅拌均匀后加入适量1 mol/L盐酸,使水样的pH值至3左右,搅拌均匀后,待用。
1.4 酚类化合物的富集
先用6 mL甲醇和6 mL超纯水活化固相萃取小柱,然后将1.3节制备的待测水样加入小柱中,调整固相萃取仪,确保水样以1 mL/min的速度流过柱子,在富集过程中要始终保持柱床上至少有1 cm水样,上样结束后继续负压抽滤15 min左右,最后加入10 mL乙酸乙酯,浸泡2 min后,依靠重力洗脱,收集洗脱液至试管中,氮吹至0.8 mL左右,用乙酸乙酯定容至1 mL,过有机膜,待测。
1.5 分析条件
色谱柱:TG-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm,美国Thermo Fisher Scientific公司);不分流进样,进样口温度:260 ℃;载气:高纯氦(纯度≥99%);流速1.2 mL/min。程序升温条件:初始柱温70 ℃,维持1 min,然后以8 ℃/min升至160 ℃,再以3 ℃/min升至200 ℃,最后以40 ℃/min升至300 ℃,保持3 min,进样量1 μL。
离子源:电子轰击(EI)离子源;离子源温度:240 ℃;传输线温度:250 ℃;电子能量:70 eV;溶剂延迟:10 min;选择离子监测(SIM)模式。18种酚类化合物的监测离子详见表1。
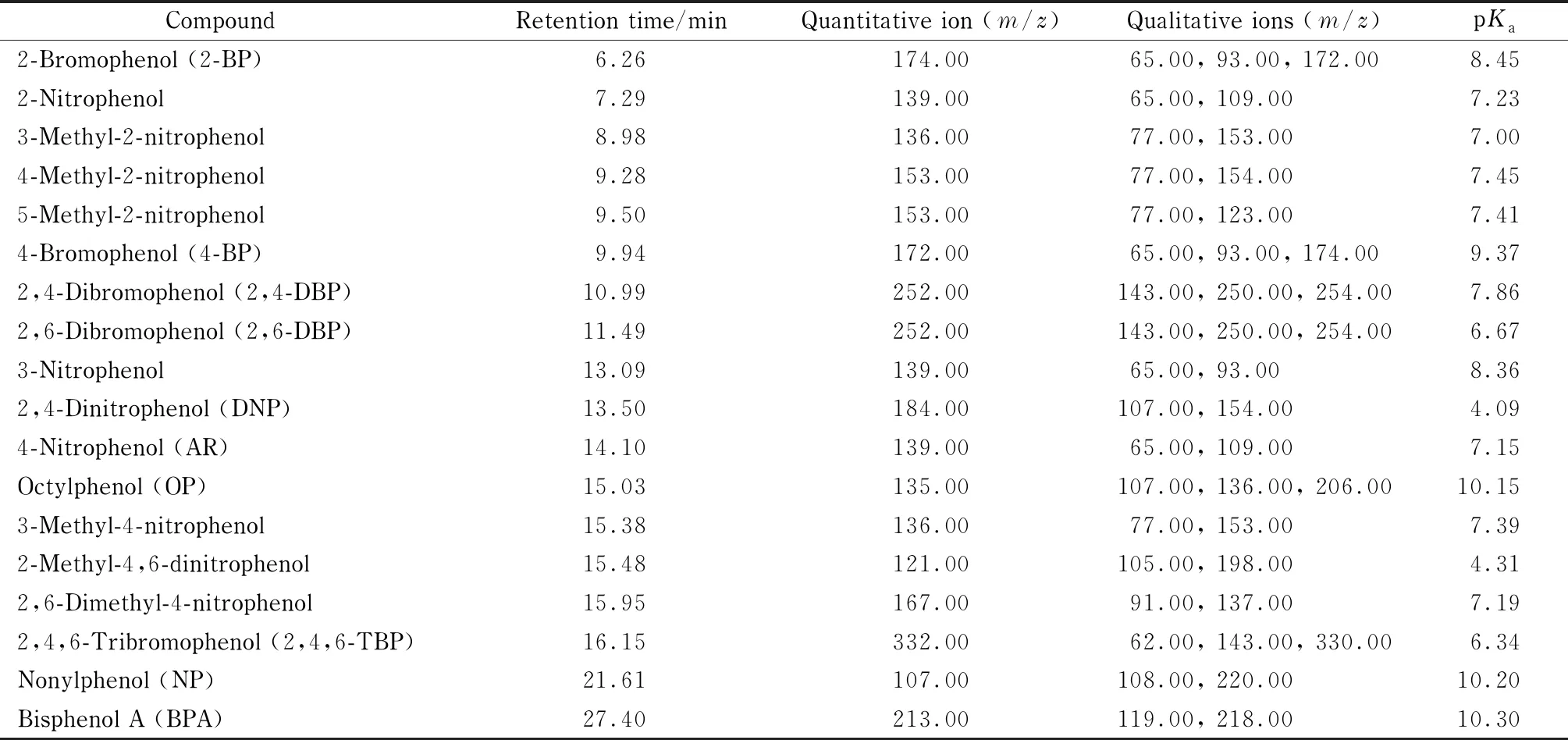
表 1 18种酚类化合物的保留时间、定量离子、定性离子及其pKa值
2 结果与讨论
2.1 分析条件的优化
2.1.1色谱条件的优化
酚类化合物是芳烃含羟基衍生物,是指芳香烃中苯环上的氢原子被羟基取代所生成的化合物,其会在水里发生一定程度的电离,致使溶液呈弱酸性,与此同时,酚类化合物的水溶液在水中易形成氢键,且其极性相对较弱[14]。因此,实验选择了分析中性或弱酸性化合物的TG-5MS弱极性毛细管柱。除此之外,为减少酚类化合物与柱子上活性点位的接触,提高仪器灵敏度,实验使用超高惰性衬管。结果显示,各种酚类化合物分离效果明显,峰形较好(见图1)。

图 1 18种酚类化合物的总离子流色谱图Fig. 1 Total ion current chromatogram of the 18 phenolic compounds 1. 2-BP; 2. 2-nitrophenol; 3. 3-methyl-2-nitrophenol; 4. 4-methyl-2-nitrophenol; 5. 5-methyl-2-nitrophenol; 6. 4-BP; 7. 2,4-DBP; 8. 2,6-DBP; 9. 3-nitrophenol; 10. DNP; 11. AR; 12. OP; 13. 3-methyl-4-nitrophenol; 14. 2-methyl-4,6-dinitrophenol; 15. 2,6-dimethyl-4-nitrophenol; 16. 2,4,6-TBP; 17. NP; 18. BPA.

图 2 不同洗脱液对18种酚类化合物回收率的影响(n=3)Fig. 2 Effects of different eluents on the recoveries of the 18 phenolic compounds (n=3)
2.1.2质谱条件的优化
实验对18种酚类化合物进行全扫描,通过谱库对比,大致确定酚类化合物的保留时间,并通过扫描各个酚类化合物的标准溶液,确定其精确的保留时间,随后找出响应最高的离子,确定其为定量离子,响应较大的2~3个为定性离子,最后建立SIM模式检测方法。
2.2 固相萃取条件的优化
2.2.1水样初始pH值的选择
水溶液的pH值会决定酚类化合物的存在状态,当pH
2.2.2洗脱液种类的选择
当前,已报道的酚类化合物洗脱溶剂有二氯甲烷[11,17,18]、正己烷[19,20]、甲醇[21,22]、乙酸乙酯[23,24]等,由于此实验涉及酚类化合物种类较多,为保证化合物完全被洗脱下来,分别选取10 mL二氯甲烷、正己烷、甲醇和乙酸乙酯作为洗脱液,对载样后的柱子进行洗脱,控制洗脱速率1 mL/min,以考察不同洗脱液对酚类化合物回收率的影响,(见图2)。结果表明,正己烷对酚类化合物洗脱效果最差,这可能是因为正己烷的介电常数最小[25],从而导致洗脱效果最差,回收率最低至26.9%;甲醇、二氯甲烷洗脱效果较好,回收率明显提高,其中甲醇洗脱效果优于二氯甲烷,这是因为酚类化合物具有强极性基团,故极性较大的甲醇溶剂对酚类化合物具有较强的溶解性[26]。乙酸乙酯相较于其他3种洗脱液洗脱效果最好,回收率最高可达116.3%,这与余颖[27]的研究结果一致。
2.2.3洗脱液体积的选择
在乙酸乙酯为洗脱液、洗脱速率1 mL/min、初始pH值为3的条件下,实验分别考察了不同体积(7、8、9、10、11、12 mL)的洗脱液对酚类化合物萃取效果的影响。结果显示,随着洗脱体积的增加,酚类化合物的回收率逐渐升高。当体积大于10 mL时酚类化合物的回收率无明显变化。由此可见,10 mL的洗脱液足以将固相萃取柱上的酚类化合物洗脱下来。洗脱液体积大于10 mL,不仅会造成试剂的浪费,同时也会增加氮吹的时间,从而影响萃取效果。因此,洗脱试剂的体积最终确定为10 mL。
2.3 方法学评价
2.3.1线性范围与方法检出限
以甲醇为溶剂,配制18种酚类化合物系列混合标准溶液,直接进样分析。以酚类化合物的浓度为横坐标(x, μg/L)、峰面积为纵坐标(y),绘制校准曲线。结果表明,第一类酚类物质的线性范围为0.5~20 μg/L;第二类酚类物质的线性范围为5.0~200 μg/L。选取100 mL超纯水为空白试样进行加标,使得第一类和第二类酚类物质的质量浓度分别为0.5 μg/L和5.0 μg/L,对水样进行重复测定,以3倍信噪比结合浓度外推法确定方法检出限,具体结果见表2。
2.3.2回收率和精密度
选用100 mL超纯水为空白样品,加入酚类标准品,使得水样中第一类酚类物质的质量浓度为1、5、10和20 μg/L;第二类酚类物质的质量浓度为10、50、100和200 μg/L,然后按样品操作方法进行测定,考察其回收率,每个水平平行测定6次。结果显示,18种酚类化合物的回收率为51.7%~117.3%,相对标准偏差(RSD)为3.1%~7.4%,具体结果见表3。
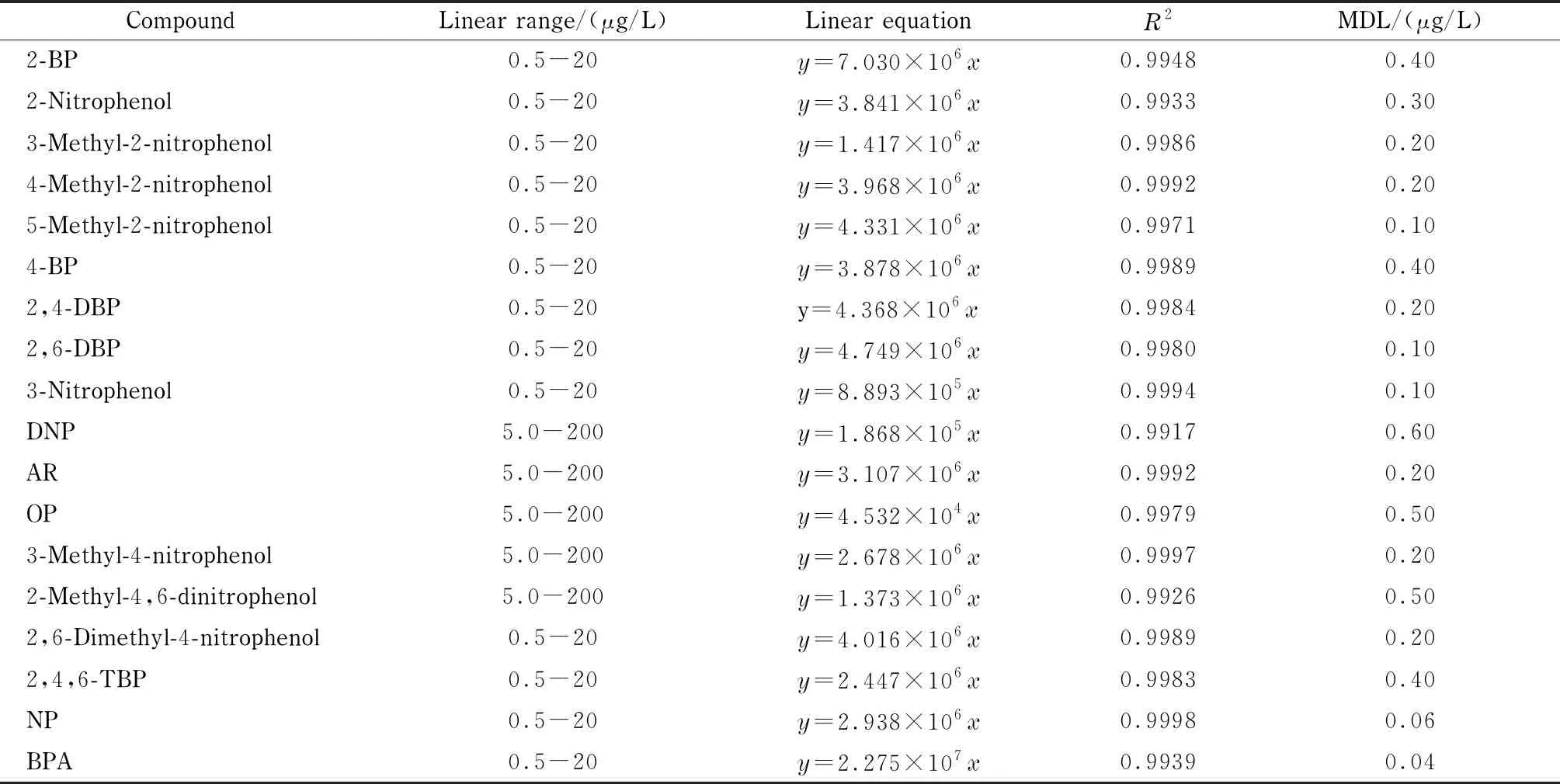
表 2 18种酚类化合物的线性范围、线性方程、相关系数(R2)和方法检出限

表 3 18种酚类化合物的加标回收率和相对标准偏差(n=6)
2.3.3实际水样的测定
应用上述所建立的分析方法,分别检测了本市河流湖泊水、生活用水(某市居民日常生活所需用水,包括饮用、洗涤、冲厕、洗澡等)、生产用水(某市果品公司和食品加工厂生产车间用水)3大类6种不同的水质。
检测结果显示,除4-硝基酚、3-甲基-4-硝基酚、4,6-二硝基邻甲苯酚外,其他酚类化合物均有不同程度的检出,其中双酚A、2,4,6-三溴苯酚、2-硝基-3-甲基苯酚含量均较高,含量最高可达49.4 μg/L(见表4)。河流湖泊水中酚类化合物所含种类最多,含量最高,生活用水酚类化合物含量低,符合国家标准GB 8537-2008《饮用天然矿泉水》中挥发酚的限量小于0.002 mg/L的要求。
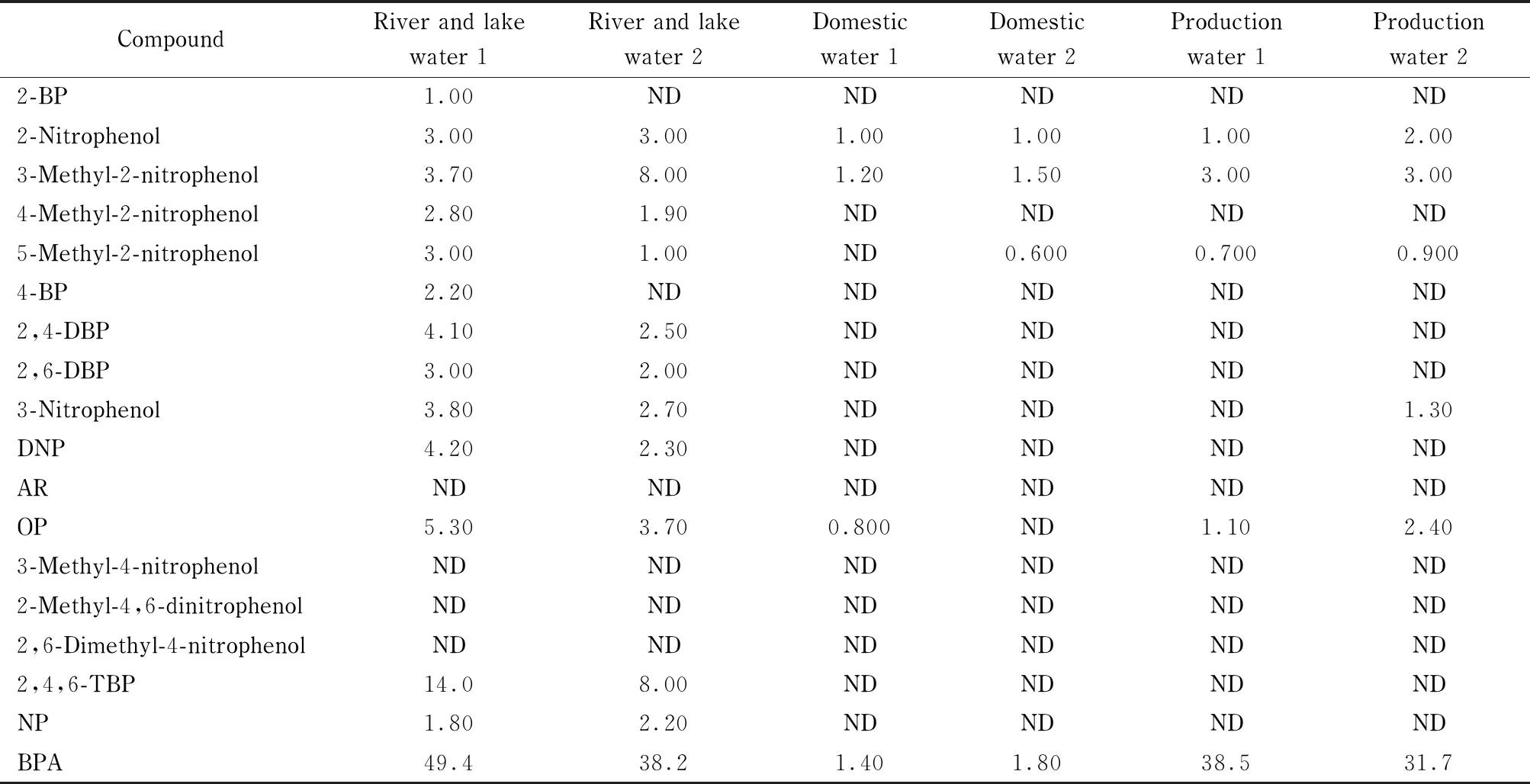
表 4 实际水样中18种酚类化合物的含量(n=3)
3 结论
本文采用了固相萃取技术富集水中多种酚类化合物,并结合气相色谱-串联质谱法,建立了一种高效且能同时检测水中18种酚类化合物的检测方法。实验优化了前处理方法,样品不需要衍生等繁琐的步骤,简单、灵敏,除此之外,该方法的检出限、线性关系、回收率和精密度等方法学指标均能满足水中酚类化合物的测定,还满足同时检测多种类、多组分的酚类化合物。

