长链非编码RNA PCGEM1靶向miR-433-3p调控结直肠癌细胞增殖、迁移及侵袭的分子机制
杨艳 张晓洁 马艳青 韩雨 魏海波 张梅
(1赤峰市医院肿瘤内三科,内蒙古 赤峰市 024000;2赤峰学院第二附属医院肿瘤科)
近年来,结直肠癌发病率和致死率呈上升趋势〔1〕。外科根治性切除手术是结直肠癌临床治疗的主要方法,手术后癌细胞的复发转移是手术失败的主要原因〔2〕,研究癌细胞增殖、转移的机制对控制结直肠癌具有重要意义。长链非编码RNA(lncRNA)被证实在癌症组织中影响癌细胞的凋亡、增殖、分化等多个生物过程,是分子靶向治疗癌症的一个新目标〔3~5〕。lncRNA PCGEM1是前列腺特异性基因,在前列腺癌组织中异常高表达,可诱导前列腺癌细胞的增殖和迁移〔6〕。众多研究表明,PCGEM1在上皮性卵巢癌〔7〕、前列腺癌〔8~10〕、胰腺癌〔11〕、骨关节滑膜炎〔9〕(OA)组织中都存在异常表达,参与肿瘤的发生和发展。miRNA发现于1993年〔12〕,是长19~22个核苷酸的非编码RNA,参与多种病理生理过程的调控,人体内miRNA的异常表达与多种疾病的发生密切相关,特别是在恶性肿瘤的发生、肿瘤的生长和转移中起重要作用〔13〕。miR-433在人类肿瘤发生和发展中发挥多种作用。miR-433在膀胱癌〔14〕、肝癌〔15〕细胞的侵袭和迁移中起重要作用;miR-433-3p能够抑制食管鳞状细胞癌ESCC〔16〕和人胶质瘤细胞〔17〕的增殖、迁移和侵袭。然而PCGEM1和miR-433-3p在结直肠癌中的表达和作用尚未可知。本研究以结直肠癌HT-29细胞为研究对象,探讨PCGEM1影响HT-29细胞增殖、侵袭和迁移的分子机制,为结直肠癌的术后分子靶向治疗提供新靶标。
1 材料与方法
1.1材料 人结直肠癌细胞株HT-29和人正常结肠黏膜上皮细胞株NCM460购自ATCC;胎牛血清(FBS)和RPMI1640培养基购自Gibco公司,牛血清白蛋白(BSA)、四甲基偶氮唑蓝(MTT)、二甲基亚矾(DMSO)和胰蛋白酶Trypsin购自Sigma-Aldrich公司;Transwell板购自美国Corning公司;双荧光素酶报告系统购自美国Promega公司;Lipofectamine 2000转染试剂、总RNA提取试剂盒、 real-time PCR 试剂盒、反转录试剂盒(RT-PCR)购自美国Invitrogen公司;光学显微镜、全自动酶标仪及real-time PCR仪购自美国Bio-Rad公司。
1.2细胞培养 配制细胞培养液:10% FBS+RPMI1640培养基+1×105U/L 青霉素+100 mg/L 链霉素,置于37℃、5%CO2培养箱中培养。待细胞生长至对数生长期时,洗涤消化传代。
1.3细胞转染 培养HT-29细胞至对数生长期,用细胞培养液稀释细胞浓度至1×106个/ml,200 μl/孔接种于6孔板中,细胞培养至基本融合为一层时按照Lipofectamine 2000说明书进行转染。先用无血清OptiMEM培养液稀释Lipofectamine 2000、si-NC、si-PCGEM1、miR-NC、miR-433-3p、pcDNA、pcDNA-PCGEM、si-PCGEM1+anti-miR-NC、si-PCGEM1+anti-miR-433-3p、WT-PCGEM1+miR-NC、WT-PCGEM1+miR-433-3p、MUT-PCGEM1+miR-NC和MUT-PCGEM1+miR-433-3p的载体,之后取等体积Lipofectamine 2000和各组载体混合,轻柔混匀后室温孵育20 min,将混合液滴入到培养好的细胞孔板中,边滴加边轻轻晃动培养板,混合均匀后置培养箱中培养,培养6 h后换成完全培养基,转染48 h后收集细胞进行后续实验。
1.4real-time PCR检测mRNA表达 收集转染后培养48 h的各组HT-29细胞,用试剂盒提取总RNA,测定浓度和纯度,保存于-80℃。然后按照RT-PCR试剂盒说明书合成cDNA,反应程序为16℃ 30 min、42℃ 45 min、72℃ 5 min;4℃放置10 min,合成的cDNA测定浓度和纯度后置于-80℃保存。取cDNA按照 real-time PCR的说明书进行反应,反应程序为:95℃ 6 min;95℃ 45 s、58℃ 40 s、72℃ 45 s,35个循环;72℃ 5 min。运用IQ5TM real-time PCR Detection System(Bio-Rad)进行数据分析。
1.5MTT实验测定细胞活性 将转染后的各组HT-29细胞进行收集,Trypsin消化后,调整细胞浓度至3×103个/孔接种于96孔板中,置于37℃、5%CO2培养箱中培养,分别在24、48、72 h 3个时间点时进行 MTT 实验,每孔加入 20 μl(5 mg/ml)MTT,置培养箱继续培养4 h,弃去上清培养液,每孔加入150 μl DMSO溶解结晶,室温振荡5 min,酶标仪测定OD 490 nm 处的吸光度(A)值。
1.6Transwell实验测定细胞迁移和侵袭 迁移实验:转染后各组HT-29细胞培养至对数生长期,收集细胞加入含1%FBS的RPMI1640培养基,培养12~24 h,用胰蛋白酶消化细胞,离心收集细胞,磷酸盐缓冲液(PBS)洗涤2次,加入含10 g/L BSA的无血清RPMI1640培养基,调整细胞密度为1×105个/ml。Transwell下层培养孔加入500 μl 10%FBS培养基作为迁移趋化物,取100 μl细胞加入Transwell上层小室,再将上层小室放入下层培养孔中,置CO2培养箱培养48 h,取出用棉签拭去基质胶和上层小室的细胞,甲醛固定后结晶紫染色,显微镜观察计数下层细胞,每个样本计数10个视野,取平均值。
侵袭实验:将Matrigel从-20℃取出置于4℃冰箱融化,以4℃无血清培养基1∶3比例稀释Matrigel,加入上层Transwell小室,37℃ 3 h烘干,以下步骤同迁移实验,上层小室加入100 μl细胞,下层加入500 μl 10%FBS培养基,培养48 h,甲醛固定细胞,结晶紫染色,计数。
1.7双荧光素酶报告系统验证PCGEM1转录活性 将HT-29细胞转染后进行胰蛋白酶消化,计数,以2×104个细胞/孔接种于24孔板中,置于37℃ 5%CO2培养箱中培养24 h,观察若细胞融为一层,则按照Lipofectamine 2000说明书进行转染,分别构建PCGEM1野生型(WT-PCGEM1)和突变型(MUT-PCGEM1)双荧光素酶报告载体,分别共转染miR-NC或miR-433-3p,转染后培养48 h,收集细胞,加入配制好的裂解缓冲液,室温静置裂解20 min,离心收集上清,-20℃保存或直接检测。检测荧光素酶活性,加入荧光素酶底物,发光仪检测上清中荧光素酶活性。以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。
1.8统计学处理 采用SPSS17.0统计软件进行t检验、单因素方差分析。
2 结 果
2.1PCGEM1和miR-433-3p在HT-29细胞和NCM460细胞中的表达 qRT-PCR结果表明,与正常对照NCM460细胞相比,结直肠癌细胞HT-29中PCGEM1表达量显著升高(P<0.05),miR-433-3p表达显著下降(P<0.05),见表1。
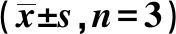
表1 PCGEM1和miR-433-3p在HT-29细胞和NCM460细胞中的表达
2.2抑制PCGEM1表达可抑制结直肠癌HT-29细胞增殖 qRT-PCR结果表明,与si-NC组相比,si-PCGEM1组PCGEM1表达显著下降(P<0.05)。MTT实验结果表明,与si-NC组相比,si-PCGEM1组细胞活性(OD 490 nm)在48、72 h显著下降(P<0.05),见表2。
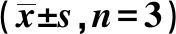
表2 抑制PCGEM1表达对结直肠癌HT-29细胞增殖的影响
2.3抑制PCGEM1表达可抑制结直肠癌HT-29细胞迁移、侵袭的影响 Transwell实验结果显示,与si-NC组相比,si-PCGEM1组迁移细胞数和侵袭细胞数显著下降(P<0.05),见图1,表3。
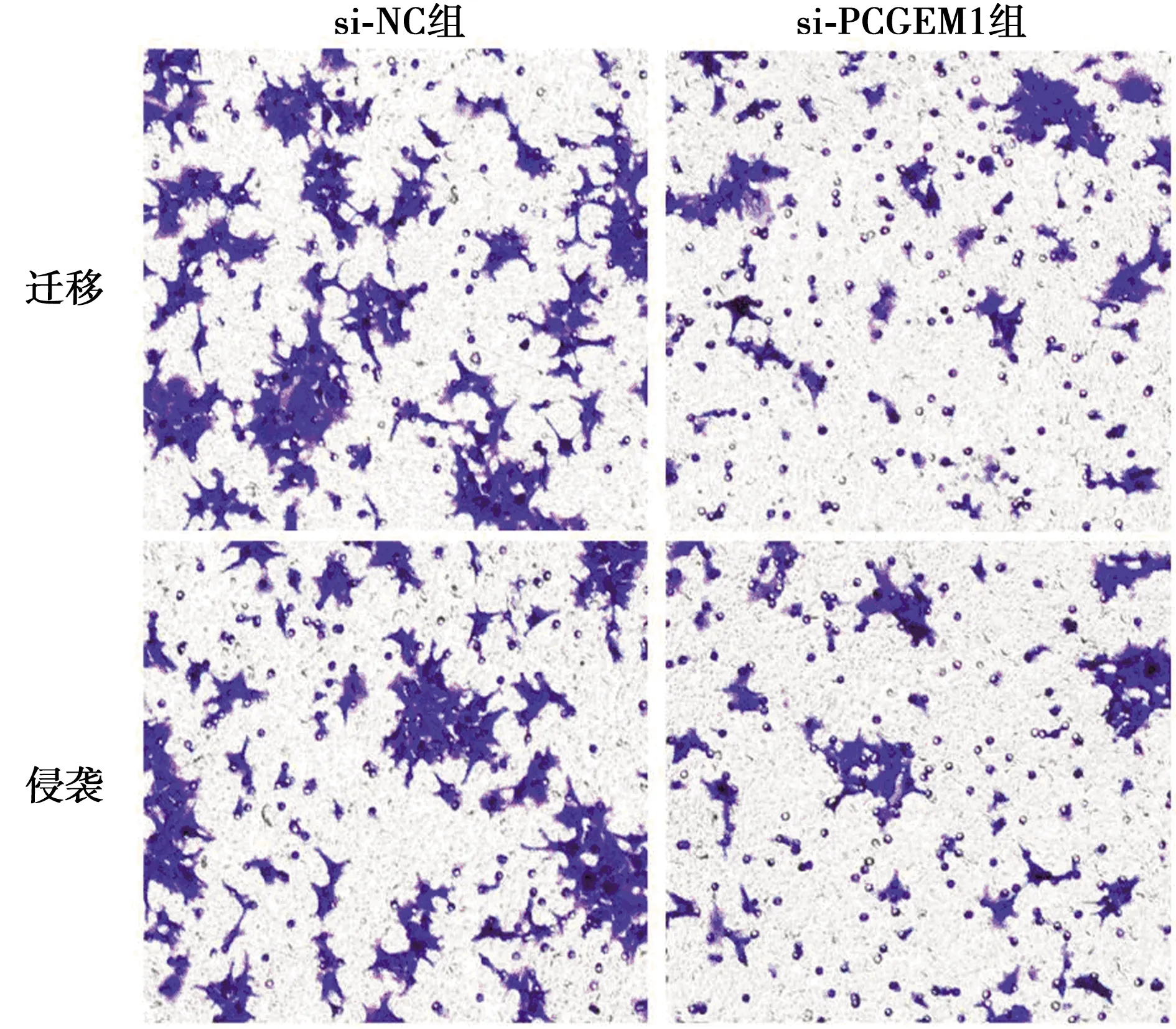
图1 抑制PCGEM1表达对结直肠癌HT-29细胞迁移、侵袭的影响(结晶紫染色,×200)
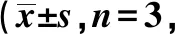
表3 抑制PCGEM1表达对结直肠癌HT-29细胞迁移、袭的影响个)
2.4过表达miR-433-3p可抑制结直肠癌HT-29细胞增殖、迁移、侵袭 qRT-PCR结果表明,与miR-NC组相比,miR-433-3p组miR-433-3p表达量显著上升(P<0.05)。MTT实验和Transwell实验结果显示,与miR-NC组相比,miR-433-3p组HT-29细胞活性在48、72 h时显著降低(P<0.05),迁移细胞数和侵袭细胞数显著下降(P<0.05),见表4。
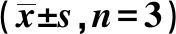
表4 过表达miR-433-3p对结直肠癌HT-29细胞增殖、迁移、侵袭的影响
2.5PCGEM1负向调控miR-433-3p的表达 Targetscan软件预测结果显示,PCGEM1的序列中含有与miR-433-3p互补的核苷酸序列,见图2。双荧光素酶报告系统结果显示,与miR-NC组相比,miR-433-3p组WT-PCGEM1的萤火虫荧光素酶相对活性显著下降(P<0.05);而MUT-PCGEM1没有明显变化(P>0.05),见表5。qRT-PCR结果发现,与si-NC组(0.58±0.06)相比,si-PCGEM1组miR-433-3p表达量(1.17±0.12)显著上升(P<0.05);与pcDNA组(0.63±0.06)相比,pcDNA-PCGEM1组miR-433-3p表达量(0.32±0.03)显著下降(P<0.05)。
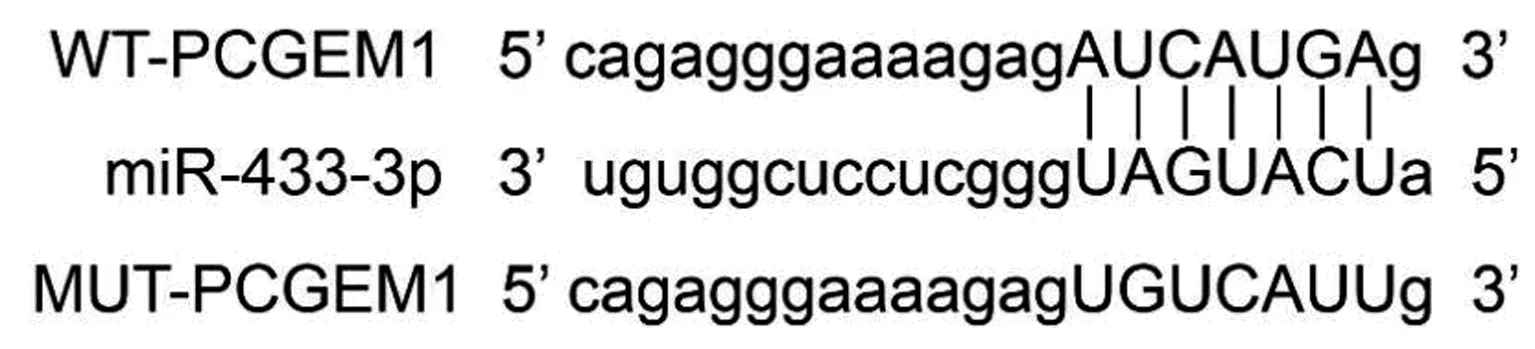
图2 PCGEM1序列中含有与miR-433-3p互补的核苷酸序列
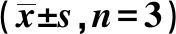
表5 双荧光素酶报告实验
2.6抑制miR-433-3p表达逆转了下调PCGEM1表达对HT-29细胞增殖、迁移、侵袭的作用 MTT结果显示,在48 h和72 h时,与si-NC组相比,si-PCGEM1组细胞活性显著下降(P<0.05);与si-PCGEM1+anti-miR-NC相比,si-PCGEM1+anti-miR-433-3p组细胞活性显著上升(P<0.05)。Transwell实验结果显示,与si-NC组相比,si-PCGEM1组迁移和侵袭细胞数显著下降(P<0.05);与si-PCGEM1+anti-miR-NC组相比,si-PCGEM1+anti-miR-433-3p组迁移和侵袭细胞数显著上升(P<0.05)。见表6。
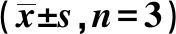
表6 抑制miR-433-3p表达逆转了下调PCGEM1表达对HT-29细胞增殖、迁移、侵袭的作用
3 讨 论
随着经济条件的提升,人们的饮食结构发生变化,导致结直肠癌发病率不断上升〔18〕,而结直肠癌患者术后肿瘤复发转移是导致预后不良和死亡率上升的主要原因。大量研究表明,lncRNA和miRNA在结直肠癌的发生和转移起重要作用〔19,20〕。
lncRNA PCGEM1在多种癌组织中出现异常表达,与癌细胞的侵袭和迁移有关。研究发现,lncRNA PCGEM1在前列腺癌组织中过量表达,与前列腺癌细胞的增殖和迁移密切相关〔6,8,10〕。Shuo等〔7〕研究表明,PCGEM1可能通过上调RHoA的表达诱导上皮性卵巢癌肿瘤发生和发展。徐岷等〔11〕研究发现,PCGEM1在胰腺癌组织中表达水平高于癌旁组织,抑制PCGEM1表达可降低癌细胞的侵袭和迁移能力。但尚未有研究阐述PCGEM1是否影响结直肠癌细胞的增殖和迁移。本研究结果提示,抑制PCGEM1表达可以抑制HT-29细胞增殖、侵袭和迁移的能力。且验证了PCGEM1在多种癌细胞和组织中表达量被显著上调,促进癌细胞的增殖、侵袭和迁移的结论。
miR433与多种癌症的增殖、迁移和侵袭有关。Xu等〔14〕研究表明miR-433在膀胱癌中被下调,过表达miR-433则会通过调控下游靶基因c-Met 和CREB1抑制EMT通路,从而抑制癌细胞的侵袭和迁移。Yang等〔15〕发现,miR-433通过抑制CREB13'-UTR 活性和蛋白表达抑制肝癌细胞的迁移。Shi等〔16〕研究发现,miR-433-3p通过抑制GRB2基因表达抑制食管鳞状细胞癌ESCC的增殖、迁移和侵袭。Sun等〔17〕发现,miR-433-3p通过靶向调控CREB抑制人胶质瘤细胞的增殖、侵袭和迁移,诱导细胞凋亡,同时提高人胶质瘤对替莫唑胺的化学敏感性。但miR-433-3p在结直肠癌中尚未被研究,本研究首次阐述了miR-433-3p对结直肠癌的作用,过表达miR-433-3p可抑制结直肠癌HT-29细胞增殖、迁移、侵袭,抑制miR-433-3p表达逆转了下调PCGEM1表达对HT-29细胞增殖、迁移、侵袭的作用,同样说明miR-433-3p在多种癌细胞的侵袭迁移中起重要调节作用。
综上,PCGEM1在HT-29细胞中参与负向调控miR-433-3p的表达,PCGEM1通过下调miR-433-3p表达促进结直肠癌HT-29细胞增殖、迁移和侵袭。PCGEM1可作为结直肠癌分子靶向治疗新的研究方向。

