消化道肿瘤患者MTHFR基因多态性与5-氟尿嘧啶化疗不良反应的相关性研究
周 琰, 王蓓丽,2,张春燕,2,潘柏申,2,郭 玮,2
(1. 复旦大学附属中山医院检验科,上海 200032;2. 复旦大学附属中山医院厦门医院检验科,福建厦门 361015)
二十世纪中期,DUSCHINSKY 等首次报道合成5-氟尿嘧啶(Fluorouracil,5-FU,它作为氟嘧啶类抗肿瘤药物的关键中间体,通过进一步代谢和转化为活性代谢产物,抑制RNA 和DNA 合成,发挥抗肿瘤作用[1-2]。5-FU 常与奥沙利铂、靶向药物等抗肿瘤药物联合使用, 是治疗消化道实体肿瘤如结肠直肠癌、胃癌等最常用的化疗方案[3-4]。
在肿瘤晚期患者中,使用含氟尿嘧啶作为基础治疗方案的化疗敏感性只有22%,使用相同剂量的患者对药物的敏感性差异很大,影响了治疗效果。随着对人类基因组计划的深入了解,学者们开始尝试从药物基因组学、药物遗传学的角度研究5-FU 相关药物基因对化疗效果和不良反应的影响[5]。本文旨在研究亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase, MTHFR)基因和毒性预测的相关性,为个体化治疗提供依据[6]。
1 材料与方法
1.1 研究对象 2016年2~6月,复旦大学附属中山医院就诊的123 例消化道恶性肿瘤患者,其中,男性67 例,女性56 例;年龄32~83 岁,中位年龄61 岁。从外周血样品中提取基因组DNA 用于检测MTHFR 1298A>C 和MTHFR677C>T 基因多态性。统计98 例治疗方案中含5-FU 的患者,比较基因型不同的患者之间发生不良反应类别和程度的差异。98 例患者接受5-FU 联合奥沙利铂的化疗方案,根据体表面积计算药物剂量。随访期间未发生黄疸和消化道梗阻、造血功能障碍和不伴急性感染。
1.2 仪器和试剂Applided Biosystems 7500 Fast Realtime PCR System[赛默飞世尔科技(中国)有限公司];AB 3130 型测序仪(美国 ABI 公司)。Lab-Aid 820 核酸抽提Midi 试剂(厦门致善生物科技股份有限公司);Permix Taq@Hot Start Version[宝生物工程(大连)有限公司];测序试剂[赛默飞世尔科技(中国)有限公司]。
1.3 方法
1.3.1 标本采集及DNA 提取:收集患者治疗期间的EDTA-K2抗凝血2ml。使用Lab-Aid 820 核 酸抽提Midi 试剂,严格按照说明书要求抽提基因组DNA,并保存于-20℃直至检测。
1.3.2 引物设计及合成:MTHFR 1298A>C 和MTHFR 677C>T基因型测定,采用Oligo7 软件设计PCR引物:MTHFR (1298A>C) F:AGCTGAAGGACTACTACCTCT;MTHFR (1298A>C) R:CCCACTCCAGCATCACTCAC;MTHFR (677C>T) F:CCTATTGGCAGGTTACCCCA;MTHFR (677C>T) R: CATGCCTTCACAAAGCGGAA。
1.3.3 PCR 扩增:将Premix Taq@Hot Start Version 反应液、正向/反向引物和去离子水,按表1 依次加入0.2 ml PCR 反应管中,PCR 反应总体积为20 μl,震荡混匀后瞬时离心备用。

表1 PCR 扩增体系配置表
反应条件:94℃,5min;45 次循环(94℃30s;61℃30s;72℃,30s);72℃5min;4℃,保温。PCR 扩增产物纯化后在ABI3730 测序仪上双相测序,使用Chromas 软件分析测序结果。
1.4 统计学分析
1.4.1 数据收集 :每4 周为一个化疗周期,接受2 ~6 次化疗。通过整理病史,结合影像学和实验室结果评估不良反应和严重程度。
1.4.2 药物毒性评价标准:依据美国国立癌症研究所(National Cancer Institute, NCI)提出的常见不良反应事件评价标准(CTCAE Version 4.0)对胃肠道不良反应和血液系统不良反应进行评价和分级,主要包括白细胞减少、腹泻、呕吐和脱发等。
1.4.3 研究终点事件和数据分析:主要终点事件为5-FU 相关的不良事件。使用SPSS19.0 进行统计分析,采用χ2检验或 Fisher's 精确概率法,以P< 0.05 为差异有统计学意义。
2 结果
2.1 MTHFR A1298C 和 C677T 基因多态性分布情况123 例消化道肿瘤患者的MTHFR A1298C 和 C677T 基因多态性分布见表2。其中,接受5-FU联合铂类化疗的98 例患者各基因型分布情况与入组的总体情况相似,见表3(P>0.05)。

表2 123 例消化道肿瘤患者MTHFR A1298C 和 C677T 基因多态性分布情况
2.2 123 例消化道恶性肿瘤患者MTHFR 基因的等位基因频率和Hardy-Weinberg 平衡检验在入组患者中分析了MTHFR A1298C 和C677T 等位基因频率的遗传平衡。结果显示,MTHFR A1298C 基因型中,A 和C 等位基因频率分别为78.05%和21.95%(P=0.87);MTHFR C677T 基因型中,C 和T 等位基因频率分别为65.45%和34.55%(P=0.29)。抽样样本符合Hardy-Weinberg 平衡定律,具有群体代表性。
对MTHFR A1298C 多态性进行测序,结果见图1。对MTHFR C677T 多态性进行测序,结果见图2。
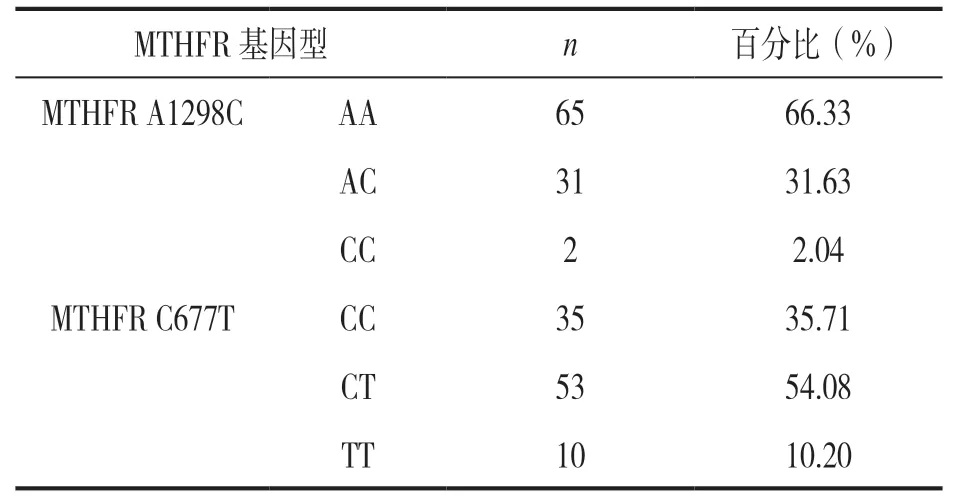
表3 98 例接受5-FU 治疗患者MTHFR A1298C 和 C677T 基因多态性分布情况
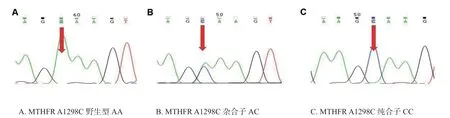
图1 MTHFR A1298C 三种基因型AA,AC,CC 的 Sanger 测序结果图

图2 MTHFR C677T 三种基因型CC,CT,TT 的 Sanger 测序结果图
2.3 消化道肿瘤患者年龄、性别、化疗方案和MTHFR 基因型与不良反应的关系见表4。根据单因素χ2检验模型分析结果,5-FU 相关不良反应的发生率与年龄、性别、化疗方案、MTHFR A1298C 多态性之间无显著相关(P>0.05),但与MTHFR C677T 多态性存在相关性(P<0.001)。
2.4 消化道肿瘤患者中MTHFR 基因型和药物不良反应情况及程度见表5。98 例消化道肿瘤患者中,35 例MTHFR C666T 野生型(CC)患者中发生3~4 级消化道不良反应0 例;3~4 级中性粒细胞减少1 例。在63 例MTHFR C666T 突变型(CT+TT)患者,发现11 例3~4 级消化道不良反应;3 例3~4 级中性粒细胞减少症。65 例MTHFR A1298C 野生型(AA)患者,发现2 例3~4 级消化道不良反应;3~4 级中性粒细胞减少症0 例。33 例MTHFR A1298C 突变型(AC+CC)患者,发现4例3~4 级消化道不良反应;3~4 级中性粒细胞减少症1 例。MTHFR C677T 突变基因型(CT+TT)可以增加3 级以上不良反应和消化道不良反应的发生风险,不增加中性粒细胞减少症的风险。MTHFR A1298C 基因型不增加患者3 级以上不良反应的发生风险。
3 讨论
5-FU 通过抑制胸腺嘧啶核苷酸合成酶抑制DNA 合成,是一类具有广谱抗肿瘤作用的抗嘧啶类药物。它被单独或联合应用于各种实体肿瘤治疗方案。5-FU 的标准计量通常是根据患者体表面积计算而得,但在实际临床应用中,使用相同校准剂量的患者药物疗效和不良反应发生程度存在显著差异,甚至发生药物不敏感和严重致死性不良反应[7-8]。据报道,多个基因多态性在抗嘧啶类药物代谢过程中起着重要作用,例如二氢嘧啶脱氢酶(dihydropymidine dehydrogenase ,DPD)、 胸 腺嘧啶核苷酸合成酶(thymidylate synthase, TS)、胸腺嘧啶磷酸化酶(thymidine phosphorylase, TP)和MTHFR 等基因的多态性。在本文中,我们研究通过叶酸代谢途径,由MTHFR 基因C677T 和A1298C 多态性引起的药物毒副作用,协助临床选择合适的化疗药物,推进个体化精准医疗[9-12]。
本研究中MTHFR C677T 和A1298C 等位基因频率遗传平衡P>0.05,说明抽样样本代表了一个处于随机婚配平衡状态的大规模群体,符合吻合度检验要求。
我们的研究中,汉族人群MTHFR C677T 突变基因型(CT+TT)的频率(59.3%) 高于MTHFR A1298C 突变基因型(AC+CC)的频率(38.2%),更为常见。其中,MTHFR C677T 基因型检测结果,野生型 CC 50 例(40.65%),杂合子CT 61 例(49.59%)和纯合子TT 12 例(9.76%),与文献报道(野生型48.6%,杂合突变型45.8%,纯合突变型5.6%)相一致;A1298C 基因多态性频率和Pubmed 索引的结果基本一致(野生型59.0%,杂合突变型34.9%,纯合突变型6.1%)[10,13-14]。
5-FU 相关不良反应呈剂量限制性[15-17],同时体内代谢过程为非线性方式,进一步加剧了个体间的疗效差异。98 例采用5-FU 联合铂类化疗方案的患者均使用小剂量44h 连续静脉滴注的给药方式,排除剂量差异对毒副作用分析的影响。
根据χ2检验结果,5-FU 相关不良反应的发生与年龄、性别、化疗方案、MTHFR A1298C 多态性无显著相关性(P>0.05)。然而,它与MTHFR C677T 基因多态性存在相关(P<0.05),这与文献报道一致[10]。
5-FU 作为广谱的实体肿瘤化疗药物,使用过程中常见的不良反应一直受到临床普遍关注,主要包括胃肠道反应,尤其是致死性出血性腹泻。在严重的情况下,骨髓抑制可诱发三系下降,全血细胞减少,以及脱发、共济失调等[18]。多年来,持续有研究报道了5-FU 相关不良反应。2000年后,学者们开始从药物基因组学角度来研究上述不良反应发生的原因。MTHFR 是叶酸代谢过程中的关键酶,可将还原型叶酸转变为5-甲基四氢叶酸(5-MTHF),使一磷酸脱氧核糖氟尿嘧啶核苷(fluorodeoxyuridylate,FdUMP)、TS 和还原型叶酸组成的复合物减少,从而减弱5-FU 的肿瘤抑制作用[19]。
最常见的MTHFR 基因多态性是第677 位密码子发生T 到C 的突变。SOHN 等[20]在结肠癌细胞研究中发现,携带变异型的癌细胞MTHFR 活性降低,细胞增殖速度加快,相对5-FU 的敏感性也增高。MTHFR基因型对细胞内叶酸浓度和分布也有影响,进而改变肿瘤细胞生长速度和药物敏感性。
本研究中,MTHFR C677T基因突变型(CT+TT)患者中,共发生不良反应21 例,其中3~4 级严重胃肠道不良反应11 例,3~4 级中性粒细胞减少3例。MTHFR C677T 突变型显著增加了3 ~4 级不良反应的发生率和3~4 级胃肠道不良反应发生的风险(P<0.05),这和国内外研究数据是一致的[10,19]。MTHFR 基因多态性对酶活性有明显影响,携带MTHFR 677C>T 等位基因的患者在化疗过程中发生消化系统和血液系统不良反应的概率及疗效有统计学意义。有报道携带MTHFR 677C>T 基因突变型(CT+TT)的患者,在使用 MTX 后发生腹泻的风险高于野生型患者,差异有统计学意义。
有文献报道MTHFR C677T 多态性会增加血液系统不良反应发生风险,例如白细胞减少、血小板减低[21]。然而,我们的研究中MTHFR C677T 多态性不增加中性粒细胞减少的发生风险。这可能是由于:①采血时间和相关文献报道有差异。为了避免化疗后发生感染等危险并发症,本研究在化疗结束后14 天复查血细胞检测,错过血液学变化最显著的化疗后第7 天。②入组样本例数有限。后续,我们将进一步扩大样本量再行分析。
综上所述,我们的研究结果表明MTHFR C677T 多态性可增加5-FU 相关不良反应的发生率,尤其是3 ~4 级胃肠道反应的风险;MTHFR A1298C 多态性、年龄、性别和化疗方案与5-FU 相关的不良事件无显著相关性。检测MTHFR 基因多态性可以帮助临床制定个性化化疗方案,预测和减少不良反应的发生。

