无偿献血者ALT水平异常与HBI,OBI,HCI和OCI的相关性研究
郭 燕,贺 晨,段 勇,现红斌,张 欢,李 锦
(陕西省血液中心,西安 710061)
丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平异常是肝脏损伤的敏感标志,曾被当作筛选肝炎病毒,尤其是丙型肝炎病毒(hepatitis C virus,HCV)感染的替代指标,一定程度上保障了输血安全。随着酶免筛查试剂灵敏度的不断提高及核酸检测技术(nucleic acid testing,NAT)的广泛开展,美英等发达国家以及我国港澳台地区,在常规开展血液NAT后即取消了ALT检测[1]。ALT虽然目前仍是我国《无偿献血健康体检要求》(GB18647-2011)规定的必检项目,但大量学者研究结果显示献血人群中ALT水平异常与HBV,HCV感染并无相关性[2-4],认为取消ALT检测或提高ALT检测域可以有效降低献血者淘汰率和血液报废率。
然而,也有研究提示ALT对HCV检出有辅助作用,如CASTILLO等[5]在100例抗-HCV阴性,血清HCV RNA阴性,肝功能持续异常的患者中检到HCV RNA,命名为“隐匿性丙型肝炎病毒感染(occult hepatitis C virus infection,OCI)”;LIN等[6]在113例ALT水平异常献血者中检出9例(7.96%)OCI,对照组并未检出。ALT水平异常与献血人群HBV,HCV感染是否相关?ALT对OCI献血者是否有筛查作用?本文针对上述问题开展研究,现报告如下:
1 材料与方法
1.1 研究对象 98 697份血液标本来自陕西省血液中心2019年1~6月初筛合格的无偿献血者,男性61 814人,女性36 883人,年龄18~60周岁。此外,随机选择2019年7~9月初筛合格的无偿献血者112例,ALT初筛>50U/L的无偿献血者125例,男性176例,女性61例,年龄18~60周岁。每个献血者同时留取3管标本(EDTA-K2抗凝真空管),2管用于血型、酶联免疫检测和外周血淋巴细胞(peripheral blood mononuclear cells,PBMCs)提取,1管用于核酸检测。本研究经陕西省血液中心医学伦理委员会批准,所有参与研究的献血者均自愿签署知情同意书。
1.2 试剂和仪器 HBsAg,抗-HIV-1和抗-HIV-2,抗-HCV,抗-TP检测试剂盒分别购自北京万泰,美国伯乐,珠海丽珠,上海科华和意大利索灵公司;PBMCs提取和HCV RNA检测试剂包括天津灏洋人PBMCs分离液(LTS1077-1);先锋生物RNAfast1000总RNA提取试剂盒(RN03);PromegaGoScriptTM逆转录试剂盒(A5001)。实验仪器包括olympus AU640全自动生化分析仪;Hamilton Fame全自动酶免分析仪;COBAS S 201核酸检测系统;ABI 2720 PCR仪;BIO RAD GelDoc EZ凝胶成像系统。
1.3 实验方法
1.3.1 血液检测:陕西省血液中心对无偿献血者血液样本采用献血前初筛和实验室检测两个步骤。初筛项目包括Hb,HBV,HIV,ALT(≤50U/L为合格),合格者继续完成献血,不合格者延缓/停止献血。实验室则采用两个不同厂家酶联免疫检测试剂对HBsAg,抗-HIV-1和抗-HIV-2,抗-HCV,抗-TP进行两轮检测,ALT采用速率法进行1次检测(ALT复检),任一项目阳性者视为不合格,无需进行NAT检测。合格样本采用COBAS S 201核酸检测系统(6样本混样模式,6×167µl)继续进行HCV,HIV,HBV核酸检测,有反应性的混样池进行拆分试验,鉴定出阳性标本。
1.3.2 PBMCs分离提取:从3ml外周血中分离PBMCs,严格参照说明书操作,血液自采集至PBMCs收集不超过6h。分离的PBMCs经500μl 1×PBS洗涤两遍后加入500μl细胞冻存液,立即冻存于- 80℃冰箱,每管细胞数为1×106~1×107。
1.3.3 HCV RNA提取和检测:PBMCs 37℃迅速融化,500μl 1×PBS洗 涤 两次,细 胞总RNA提取及cDNA合成严格按照试剂盒说明书进行。Nested PCR检测HCV RNA5’非编码区[6],两轮PCR引物分别是F1:5’-CTGTGAGGAACTACTGTCT-3’(nt45~63),R1:5’-GTGCACGGTCTACGAGACCT-3’(nt321~302);F2∶5’GAAAGCGTCTAGCCATGGCGT-3’(nt71~91),R2∶5’CCCTATCAGGCAGTACCACAA-3’(nt301~281)。4μl cDNA为模板,反应条件为95℃ 3min;95℃ 30s,58℃ 30s,72℃30s;72℃ 8min,40个循环,第二轮PCR吸取4μl第一轮PCR产物为模板,扩增条件相同。
慢性丙型肝炎患者PBMCs HCV RNA阳性标本;抗-HCV阴性且血浆及PBMCs HCV RNA阴性标本;ddH2O分别作为阳性、阴性和空白对照以排除污染。目的产物230bp,切胶回收后送金唯智生物技术有限公司测序。
1.4 统计学分析 应用SPSS19.0统计学软件对实验数据进行分析,计数资料运用χ2检验,均数组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 无偿献血者ALT,HBV,HCV检测结果 98 697份血液标本中ALT水平异常者654份(0.66%),其中ALT单项水平异常641份(98.01%);ALT异常并发HBsAg阳性5份,占ALT不合格总数的0.76%(5/654);ALT异常并发抗-HCV阳性3份,占ALT不合格总数的0.46%(3/654);ALT并发肝炎病毒标志物阳性者,仅占ALT不合格标本的1.22%(8/654)。HBsAg单项阳性388份(0.39%),抗-HCV单项阳性448份(0.45%)。
2.2 肝炎病毒标志物阳性组与阴性组ALT异常率比较 见表1。HBsAg阳性组和阴性组,抗-HCV阳性组和阴性组的ALT异常率差异均无统计学意义(χ2=2.23,0.00,均P>0.05)。HBsAg阴性组、抗-HCV阴性组ALT均值高于对应阳性组,差异无统计学意义(t=0.662,0.282,均P>0.05)。
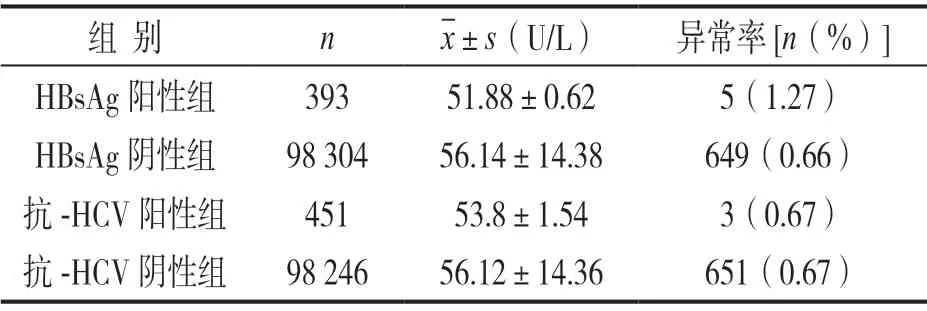
表1 肝炎病毒标志物阳性组与阴性组 ALT均值及异常率比较
2.3 ALT初筛不合格献血者HBV,HCV感染率及ALT水平比较 见表2。125例初筛ALT不合格的无偿献血者HBsAg阳性组ALT水平小于HBsAg阴性抗-HCV阴性组,抗-HCV阳性组ALT大于HBsAg阴性抗-HCV阴性组,组间比较差异均无统计学意义(t=0.527,1.396,均P>0.05)。ALT初筛不合格者HBV,HCV感染率(4.8%,6/125)大于ALT初筛合格者(0.86%,844/98 697)和复检ALT不合格者(1.22%,8/654),差异有统计学意义(χ2=22.78,7.61,均P<0.05)。
表2 ALT初筛不合格献血者HBV,HCV感染率[n(%)] 及ALT水平(±s,U/L)比较
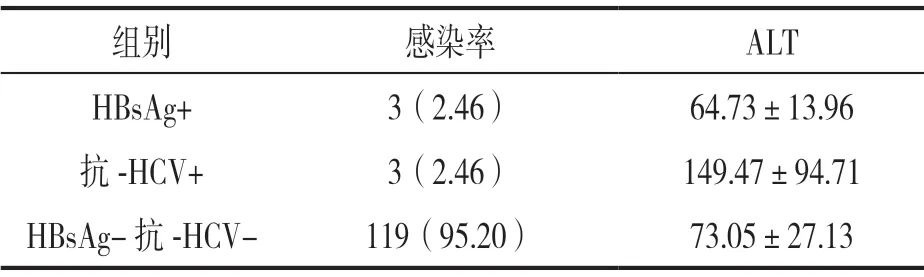
表2 ALT初筛不合格献血者HBV,HCV感染率[n(%)] 及ALT水平(±s,U/L)比较
组别 感染率 ALT HBsAg+3(2.46)64.73±13.96抗-HCV+3(2.46)149.47±94.71 HBsAg-抗-HCV- 119(95.20)73.05±27.13
2.4 NAT检测结果 酶免及ALT检测均合格样品中,NAT检出HBV DNA阳性46份(0.05%,46/96 585);ALT单项异常的样品NAT检出HBV DNA阳性1份(0.16%,1/641),两组HBV DNA检出率差异无统计学意义(χ2=0.98,P>0.05)。收集的125例ALT初筛单项不合格样品,酶免检测筛除HBV,HCV阳性后,剩余119例样品和112份ALT初筛合格样品NAT检测结果均为阴性。
2.5 无偿献血者中OCI筛查结果 119例ALT单项异常者PBMCs中检出1例HCV RNA阳性,112例合格献血者PBMCs中未检出HCV RNA。
3 讨论
ALT是病毒性肝炎的一项非特异性检测指标,除病毒性肝炎、肝硬化、肝癌、药物性肝炎等病理因素外,与年龄、体重、饮酒、剧烈运动、疲劳、药物服用等非病理因素也有一定相关性[7]。我们的检测结果显示,ALT初筛合格的无偿献血人群中ALT水平异常与HBV,HCV感染并无关联性。然而,由于初筛往往会排除ALT较高的献血者,只利用ALT初筛合格样品作为研究对象存在一定局限性。本研究中,初筛ALT不合格样品的HBsAg/抗-HCV阳性率(4.8%)高于ALT初筛合格献血者(0.86%)及ALT复检不合格者(1.22%),一定程度上体现了ALT初筛对于防止血液资源浪费的必要性。此外,对不同组别ALT均值分析说明,HBV/HCV检出与一定范围内的ALT水平并无严格的关联性,如何设定更合理的献血人群ALT检测限来体现ALT与HBV/HCV相关性,需要多中心,大样本检测数据的不断积累和探索。
NAT具有较高的敏感度和特异度,可缩短病毒检测的“窗口期”,能有效检出隐匿性乙肝病毒感染(occulthepatitis B virus infection,OBI)。OBI是一种特殊的HBV感染形式,基本特征为血清HBsAg阴性而肝细胞/血清HBV DNA 阳性,通常血清中HBV DNA 滴度≤200 IU/ml[8]。ALT单项异常标本可检出HBV DNA,说明HBV感染者ALT水平异常出现的时间可能早于HBsAg阳转时间;而酶免和ALT检测均合格的血液标本可检出HBV DNA,说明HBV DNA的出现早于ALT水平异常时间。可见NAT已能发现HBV前期感染或者OBI,绝大多数ALT水平异常者被误排除。
OCI是一种特殊的HCV感染形式,仅能在患者肝组织和/或外周血淋巴细胞中检测到HCV RNA,而血浆/血清中HCV RNA阴性[9]。OHCV具有HCV相似的传染性[10],可能与肝脏坏死性炎性活动及纤维化相关[5]。采供血机构现行的ELISA和NAT技术并不能检出OCI,是输血安全面临的潜在风险。由于OCI可表现为抗-HCV阴性、血清 HCV RNA 阴性、仅肝功能异常的临床状态[11],ALT水平异常对OCI检出可能有一定的辅助作用。本研究在ALT单项不合格献血者PBMCs中检出OCI,合格献血者未检出OCI,一定程度上证明了ALT对OCI的筛查作用。
综上所述,在酶免和NAT双重检测制度普及下,ALT筛查OBI,HBV,HCV及其窗口期的意义并不大。然而,由于ALT初筛不合格献血者HBV/HCV感染率远高于初筛合格者,ALT对OCI具有一定的筛查作用,对其他已知或未知肝炎病毒乃至肝脏疾病可能具有一定的辅助诊断作用,目前简单取消献血者ALT这一经济实惠的筛查方法并不合适。如何在减少血液浪费和保障血液安全之间取得理想平衡是值得每一个采供血机构认真思考并不断探讨的命题。

