床旁彩色多普勒超声在经皮肾镜碎石取石术后肾假性动脉瘤出血中的诊断价值
彭佩丹,陈明坤,张辉见,庄永江,彭红梅,何书华,赵善超
1南方医科大学南方医院泌尿外科,广东 广州 510515;2南方医科大学第三附属医院泌尿外科,广东 广州510500
经皮肾镜取石术(PCNL)具有创口小、碎石效果显著、术后恢复快等优点,尽管近年来更多研究转向一种无创的腔内治疗方法(输尿管软镜碎石)[1],但PCNL仍然是巨大肾结石治疗不可或缺的一部分,已成为复杂肾结石的首选治疗方法[2-3]。PCNL术后出血是临床常见且十分危急的并发症之一,大多数术后出血的患者可以通过放置肾盂引流管并夹闭及输血输液进行保守治疗,但少数动脉出血、动静脉瘘、假性动脉瘤出血的患者,需要进行快速的血管造影下的动脉栓塞治疗。肾动脉假性动脉瘤(RAP)破裂大出血,属PCNL术后迟发性出血的重要原因之一,多发生于术后5~7 d,临床可能因认识不足导致延误诊治,不仅增加患者治疗费用,还会导致患者肾功能受损甚至危及生命[4]。有研究论述彩超诊断肾穿刺术后、肾部分切除术后以及肾移植术后肾假性动脉瘤出血的价值[5-8],但彩超在经皮肾碎石取石术后发生肾假性动脉瘤出血中的诊断价值尚未明确。数字减影血管造影(DSA)是目前诊断肾假性动脉瘤的金标准,但也具有费时、有创、有辐射等缺陷性,而床旁超声具有准确、快速便捷、无辐射、无创伤、可重复性高等优点,可对PCNL术后并发肾假性动脉瘤进行快速诊断及动态随访。为进一步探究床旁超声在诊断PCNL术后肾假性动脉中的临床诊断价值,本研究选取2017年11月~2019年11月于我院接受检查的9例PCNL术后并发肾出血患者进行分析,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年11月~2019年11月于我院接受检查的9例PCNL术后并发肾出血患者。纳入标准:经皮肾碎石取石术后出血,且经内科保守治疗后仍出血、紧急出血或者短暂止血后复发出血;接受DSA检查前已行床旁超声检查;接受DSA检查。排除标准:术后无明显出血,或者经过保守治疗可自行止血;无接受DSA检查;患者DSA检查前未接受床旁超声检查;其他原因造成的出血,如凝血功能障碍等。9例患者中男4例,女5例,年龄45~68岁(49.7±3.8岁)。临床表现为肾造瘘管引流出鲜红色血液或合并明显肉眼血尿,血常规检查提示血红蛋白浓度呈进行性下降,经过夹闭肾造瘘管、药物止血等对症处理效果不佳。其中8例为迟发性出血,出血时间 2~15 d(10.4±2.5 d),包括持续出血1例,反复出血4例,拔出肾造瘘管出血1例,活动后突发出血2例。其中1例为术后急性大出血,出血时间为术后6 h,出现了失血性休克的临床表现。首先予以床边彩色超声初步判定为继发性大出血,然后行DSA检查及选择性肾动脉栓塞治疗。本研究已获得南方医科大学伦理委员会批准。
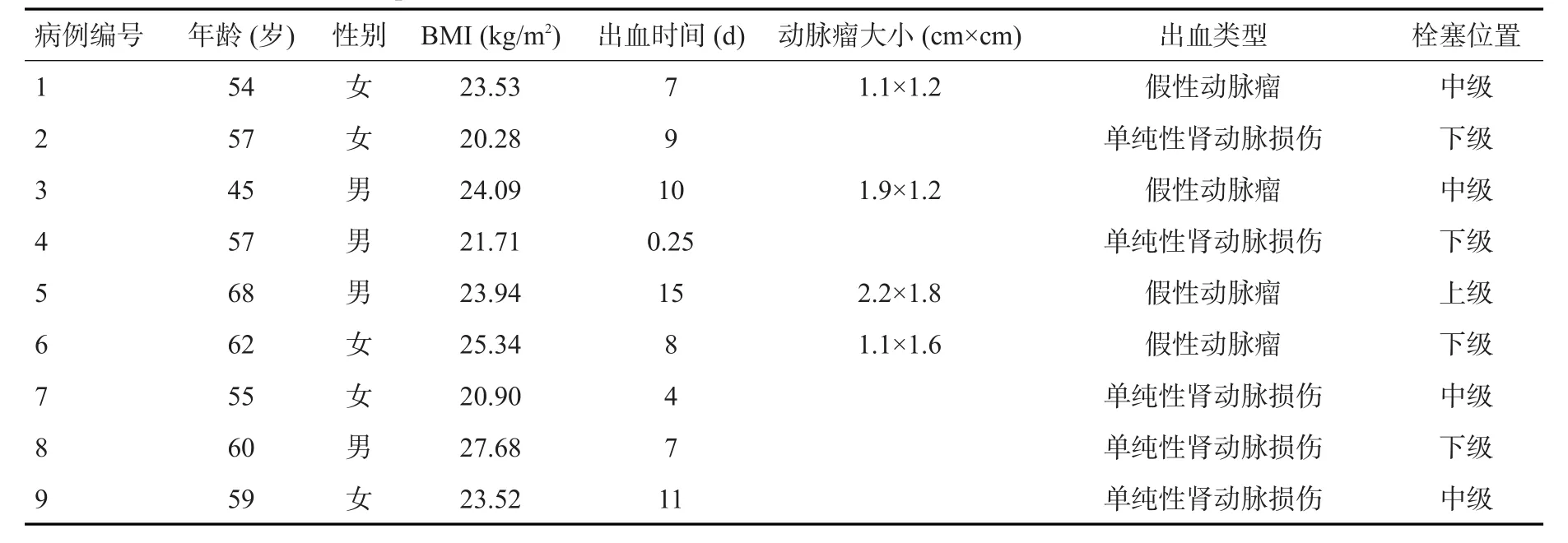
表1 患者一般资料Tab.1 General information of patients
1.2 仪器与方法
所有病例检查均使用阿洛卡6代超声诊断仪,腹部探头频率3~5 MHz。让患者侧卧位,充分显露腰背部,将探头放置于肾脏区域,详细扫查肾脏和肾周的情况,先用常规二维超声观察瘤体的形态、大小、内部回声、瘤体相邻血管等情况。进而相应移动探头,寻找破口并测量其大小。采用彩色多普勒血流显像技术来观察破口处血流情况,同时运用脉冲多普勒测量破口处血流频谱参数,同时观测有无异常交通以及累及动脉的情况,准确标记瘤体部位。
2 结果
2.1 二维超声的特点
床旁超声可发现:肾动脉旁可见一无回声或者混合回声的搏动性包块(图1A),包块形态不一,大小1.1 cm×1.2 cm~2.2 cm×1.8 cm,且均无明显包膜回声,亦无典型的血管壁结构,中央内部为液性暗区;其中1例包块周围可见不均匀性低回声的附壁血栓或血凝块;包块旁可见动脉绕行,血管与肿物间可见动脉破口或通道相通,破口直径0.3~0.4 cm,瘤腔内多呈“云雾状”光点旋动。
2.2 彩色多普勒超声特点
彩色多普勒超声显示瘤体的中央无回声区内呈红蓝相间的血流信号(图1B),瘤体内部可测及动脉湍流样血流频谱,取样容积置于破口处可探及双期双向血流频谱,收缩期血流自动脉流向瘤体,舒张期自瘤体流向动脉方向(图2A、B)。
2.3 诊断结果
9例患者中,经床旁彩色多普勒诊断为肾假性动脉瘤的有4例,其中1例患者(图3A)选择保守治疗,于7 d后再次发生大出血,紧急行DSA确诊为肾假性动脉瘤(图3B),后经肾动脉栓塞治疗治愈(图3C)。这4例均经DSA确诊,其余5例为单纯性肾动脉出血。所有病例均栓塞成功。
3 讨论
关于PCNL术后出血的分型目前尚无统一标准与指导[9],有研究认为保守治疗后的血流动力学不稳定是PCNL迟发性出血后肾动脉造影的指征[10]。王海岩等[11]将其分为3型:Ⅰ型(急性持续性出血)、Ⅱ型(间歇性活动性出血)及Ⅲ型(缓慢持续性出血)。本研究也采用以上分型方法进行归纳总结。Ⅱ型出血临床上最常见,本组共6例(66.7%);Ⅰ型次之,共3例(33.3%);Ⅲ型最少见,0例。PCNL术后肾出血的原因主要与穿刺点位置不佳、进针路径偏移、术中多次穿刺和扩张、术者动作粗暴、拔鞘后压迫不当、过早拔除造瘘管及围术期抗凝及抗血小板药物的使用或者患者术前存在易诱发出血的基础疾病等有关,使得医源性肾假性动脉瘤的发生率明显升高[12-13]。肾脏的血供相当丰富,几乎所有患者术后均有不同程度的肉眼血尿,一般在12~24 h内逐渐转清;少数患者超过24 h仍无止血倾向,呈持续性血尿,或突然血尿颜色加深,需考虑到术中较明显血管损伤的问题,需要密切观察血色素的变化[14]。然而,一旦形成假性动脉瘤,缺损将很难闭合。既往研究统计,PCNL术后的输血率为1%~11%,栓塞率为0.6%~2.6%[15-16]。大多数出血并发症是由静脉损伤引起的,通过输液等保守治疗可以改善静脉损伤,通常不会导致血流动力学不稳定。然而,当出血的原因是动脉损伤时,可能会发生持续性和严重的出血,仅靠输血是不能改善的,导致血流动力学不稳定[17]。相关文献对于肾动脉栓塞治疗时机的选择,主要根据出血的分型进行治疗:Ⅰ型出血均紧急行选择性肾动脉栓塞治疗;Ⅱ型出血保守治疗48 h内若出现2次以上活动性出血,即刻行选择性肾动脉栓塞治疗;Ⅲ型出血保守治疗3~4 d,若出血控制不理想,也即刻行肾动脉栓塞治疗[18]。以上肾动脉栓塞治疗时机的选择主要根据出血的紧急程度,本研究则进一步参考了床旁彩色多普勒超声的诊断。肾假性动脉瘤破裂是PCNL术后大出血的原因之一,故对PCNL术后假性动脉瘤的早期诊断和预判具有极其重要的临床意义。
肾动脉假性动脉瘤是指肾动脉管壁破裂后血液从该破口流出而被肾周软组织包裹形成的搏动性血肿,肾动脉损伤裂口和周围组织间隙再通需较大的血流压力[19]。RAP瘤壁并不是真的血管壁,而是血肿周围组织机化而形成的囊壁[20],随着出血的进行性发展,量越来越多,对囊壁的牵扯力逐渐增大,使得囊壁突发破裂,引起大出血,甚至危及患者生命,是一种临床急危重症。其形成的病因目前未确切,有文献认为是因术中灌水压力、降温等原因导致局部血流减少、血凝块形成,同时周围组织的压迫掩盖了损伤血管的病变,因而短期内无明显出血现象。随着术后血流的恢复和血凝块溶解,血液由裂口流入血管外间隙而逐渐扩大形成RAP[19],与集合系统连接可能导致血尿,与周围组织连接可能导致肾周血肿。因此临床上根据术史以及生命体征等对该病患者进行诊断,再结合彩色多普勒超声进行有效的诊断,一旦发现肾假性动脉瘤,则需要及时开展肾动脉栓塞治疗,最大程度上提高患者的治疗效果。而单纯性的肾动脉出血,则需根据临床其他指标进行评估是否需要开展超选择性肾动脉栓塞治疗。本研究中4例术前床旁彩色多普勒超声诊断肾假性动脉瘤与肾动脉造影诊断结果一致,其中2例肾中极支形成假性动脉瘤,肾上极和肾下极支形成假性动脉瘤各1例。有1例初次床旁超声检查发现肾假性动脉瘤,在保守治疗7 d后突发出血加剧行急诊肾动脉栓塞术。
本研究中,PCNL术后出现出血等症状后给予床旁彩超。其中33.3%(3/9)的患者出现出血性休克,当中有2例为肾假性动脉瘤,其他常见临床表现为腰痛、引流液增多变红和少尿等。当患者出现这些症状时,应怀疑假性动脉瘤的可能,常规给予床旁彩超检查,第一时间排查,以免错过最佳治疗时机。考虑到PCNL术后肾假性动脉瘤出血的发生率很低,因此本研究存在一定的局限性。我们采用床旁彩超第一时间给予明确诊断,经DSA确诊后行肾假性动脉瘤栓塞术。B超可在床旁进行,可作为PCNL术后出血怀疑肾假性动脉瘤形成的患者的首选检查,但须运用频谱多普勒超声,以提高诊断率。9例患者均行肾动脉造影和肾动脉栓塞治疗。另外,是否决定进一步介入血管造影和栓塞是根据血红蛋白水平和持续性出血的临床症状等做出的。如果患者出现持续性严重肉眼血尿、血流动力学不稳定或输血后红细胞压积反应不当,应进行紧急栓塞,最大限度地减少输血量,缩短住院时间。
彩超诊断肾假性动脉瘤有极大的临床价值,并与DSA有良好的一致性,但其不足是受患者个体差异影响较大,如肥胖、胃肠道气体干扰等、以及有些患者体位受限等,会导致检查效果欠理想[21];另外,对于微小病灶可能难以观察,如临床高度怀疑肾假性动脉瘤,除了床旁超声外,还应进一步完善DSA检查。每一例PCNL术后出血的病例并不都与肾假性动脉瘤形成相关,但凡经彩色多普勒诊断为肾假性动脉瘤,应尽早行介入干预治疗[22]。本研究中4例经彩色多普勒超声诊断为肾假性动脉瘤的病例,进一步检查均行DSA确诊,彩超诊断一致率100%,与既往文献报道结果相仿[23-24]。因此,床旁超声在诊断肾假性动脉瘤上具有较高的准确率,可为进一步行肾动脉栓塞治疗术提供诊断依据,并可作为栓塞治疗术后疗效评价及长期随访的检查工具。

