老年患者肠系膜上动脉钙化性病变CT影像学特征及临床分析
涂 波,刘 嘉,潘志华
成都医学院第二附属医院//核工业四一六医院放射科,四川 成都 610051
缺血性肠病(IBD)病变多以结肠脾曲为中心呈节段性发生,临床分析发现肠系膜静、动脉是导致结肠出血的重要因素,尤其是肠系膜上动脉(SMA)在血管形成或粥样硬化后导致的血管狭窄、闭塞极易导致结肠出血,诱发IBD[1-3]。结肠主要由SMA及肠系膜下动脉供血,有效保证肠系膜的正常工作,但动脉血管一旦出现钙化斑块则极易引起内脏器官缺血,当SMA出现钙化斑块、狭窄时,则供血的右半结肠可能出现不同程度的缺血、坏死,诱发IBD,患者表现为腹泻、腹胀剧烈的腹痛、恶性等症状,还可能进一步发展为血压降低、心率加快、发热症状,严重影响患者的生活质量及身体健康,且病情严重者可能危及生命,因此临床对SMA钙化的早发现、早治疗是减少IBD发生的关键[4-6]。以往研究对SMA的动脉狭窄及缺血性病变进行分析,对SMA钙化后IBD研究较少。本研究通过回顾性分析186例行SMA CT检查患者的一般临床资料,对比IBD患者与非IBD患者的SMA钙化性病变CT影像学特征,并进一步分析SMA钙化性病变与IBD的关系,以期为临床提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年6月~2020年4月在我院进行SMACT检查的186例患者为研究对象,回顾性分析患者的一般临床资料。纳入标准:均无影像学禁忌症者。排除标准:一般资料不完整者;既往存在恶性肿瘤、严重脑梗死病史者。根据患者是否存在IBD分为IBD组(n=26)与非IBD组(n=160),分析比较两组患者SMA钙化的检出率以及钙化斑块的部位、形态、数目及狭窄程度,探讨SMA钙化的CT影像学特征及与IBD的相关性。
1.2 方法
CT检查采用Siemens 64排螺旋CT机,对患者进行CT平扫及CT血管造影检查,扫描参数设置为层厚5 mm,120 kV,管电流250 mA,扫描范围膈肌水平至耻骨联合水平,在患者右上肢静脉注射对比剂碘佛醇[批准文号:H20150334,100 mL:35 g(I)](Liebel-Flarsheim Company LLC),速率4 mL/s,3 mL/kg。
1.3 图像分析
将所得影像学数据上传至工作站,并采用容积重建技术对影像进行处理,由2名副主任医师采用盲法阅片,并协商得出最终结果。
1.3.1 血管评估范围 自腹主动脉(CA)中段及SMA始段。
1.3.2 评估指标 SMA钙化斑块的数量、形态特征、SMA与腹主动脉长轴的夹角及SMA的开口直径。
(1)SMA钙化斑块:在CT平扫图像中,血管壁的CT值在130 Hu以上,且体积在1 mm3以上。(2)SMA钙化斑块形态:环状:轴位CT中钙化斑块呈现C型,且钙化部分在1个层面以上;条状:钙化斑块的宽度>3 mm或长度>5 mm;点状:钙化斑块的宽度<3 mm且长度<5 mm。(3)SMA钙化斑块部位:SMA近段,距离SMA腹主动脉开口处距离在1 cm以下;SMA中段,中结肠动脉开口至距离SMA腹主动脉开口1 cm处;SMA远段,右结肠动脉开口处至中结肠动脉开口处;SMA末段,回结肠动脉开口处至右结肠动脉开口处。(4)SMA狭窄(%)=(1-狭窄管腔直径/正常血管直径)×100%。SMA开口狭窄程度:<25%记1级,25%~49%记2级,50%~70%记3级,≥70%记4级。(5)SMA病变程度分为4个等级:无点状斑块或斑块数在2个以下为1级,点状斑块数在2个以上为2级,以条状斑块为主记3级,以环状斑块为主记4级。
1.4 观察指标
一般临床资料,包括性别、年龄及各项基础疾病;CA钙化斑块及SMA钙化斑块形态及总数;SMA钙化斑块的狭窄情况及斑块部位;比较两组SMA开口处狭窄程度;分析IBD组患者SMA斑块钙化程度与其开口狭窄程度相关性。
1.5 统计学方法
采用SPSS20.0软件对数据进行处理,无序分类资料采用卡方检验,计量资料以均数±标准差表示,行t检验,两独立样本的等级资料比较采用Wilcoxon秩和检验,相关性采用Pearson分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较
两组在年龄、性别及各项基础疾病的差异无统计学意义(P>0.05,表1)。
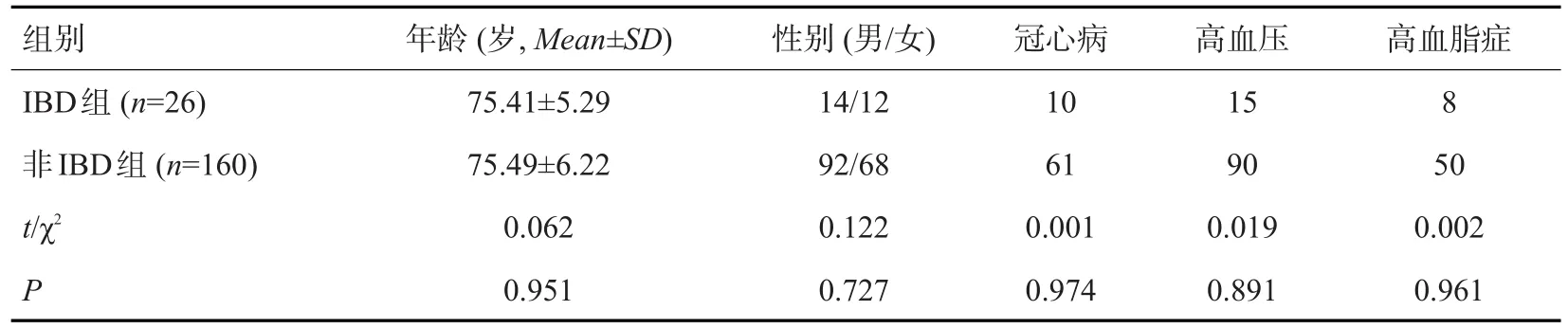
表1 两组一般资料比较Tab.1 Comparison of general information of two groups(n)
2.2 两组CA钙化斑块及SMA钙化斑块形态
两组在CA钙化斑块各形态总数方面比较差异无统计学意义(P>0.05,表2),但IBD组SMA钙化斑块总数高于非IBD组(P<0.05)。
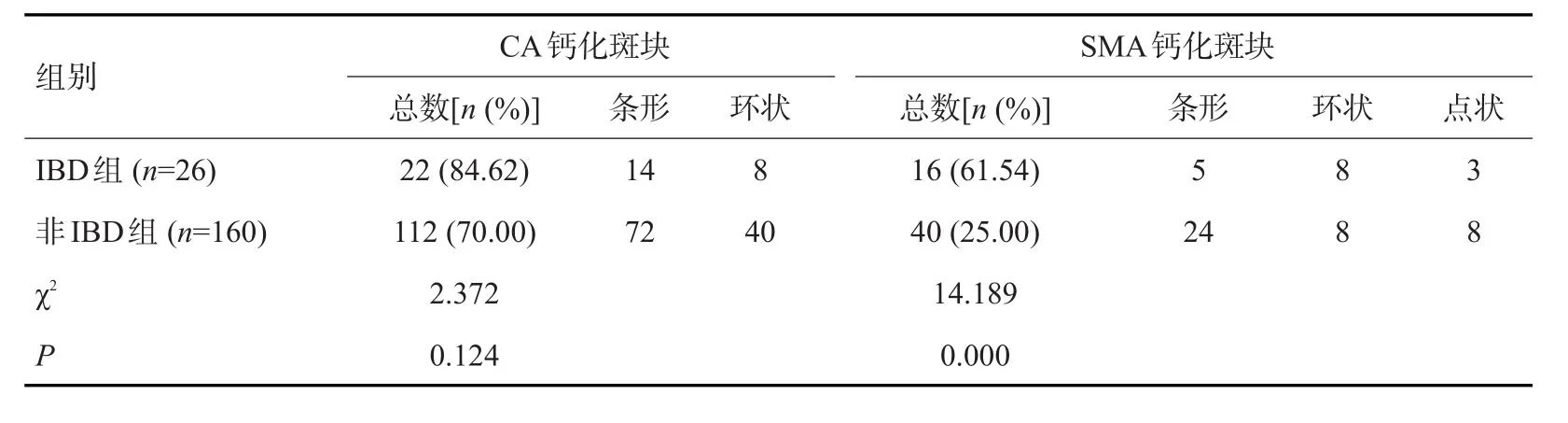
表2 两组CA钙化斑块及SMA钙化斑块形态比较Tab.2 Comparison of shape between CAcalcified plaque and SMAcalcified plaque of two groups(n)
2.3 SMA钙化斑块的狭窄情况及斑块部位比较
IBD组SMA钙化斑块主要以SMA远段为主,其次是SMA近段,而非IBD组钙化斑块主要以SMA近段、SMA中段,位置分布情况差异有统计学意义(P<0.05,表3),IBD组SMA斑块的血管夹角低于非IBD组(P<0.05)。

表3 SMA钙化斑块的狭窄情况及斑块部位比较Tab.3 Comparison of the stenosis and position of the SMAcalcified plaque[n(%)]
2.4 两组SMA开口处狭窄程度比较
两组开口处狭窄程度比较差异有统计学意义(P<0.05,表4)。
2.5 相关性分析
IBD组患者SMA斑块钙化程度与其开口狭窄程度呈正相关(r=0.412,P<0.05,表5)。

表4 两组SMA开口处狭窄程度比较Tab.4 Comparison of stenosis degree of SMAopening of two groups(n)
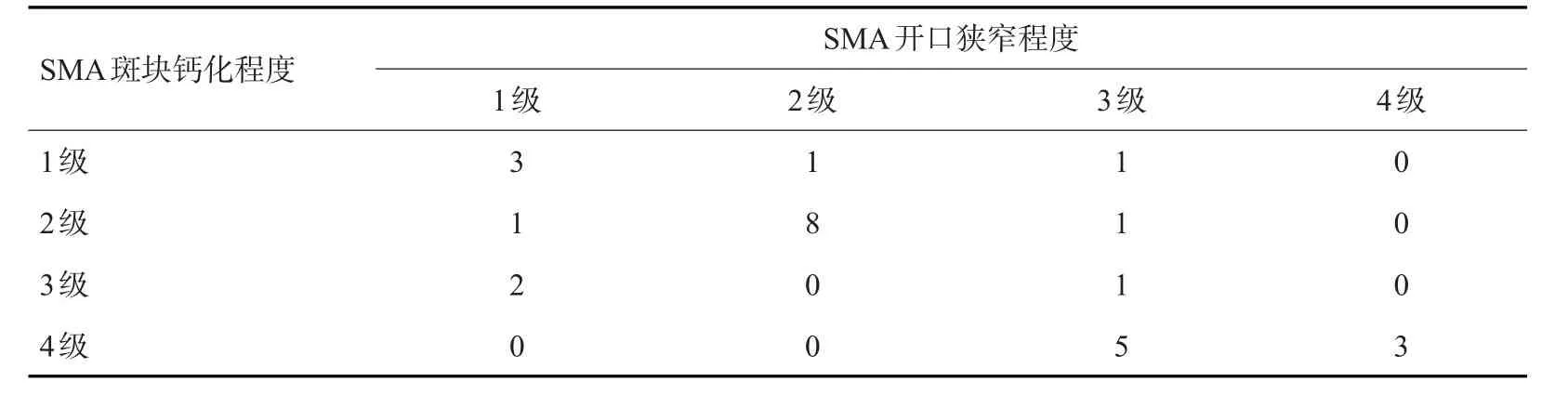
表5 SMA斑块钙化程度与其开口狭窄程度的相关性分析Tab.5 Correlation analysis between calcification degree and stenosis of opening of the SMAplaque
2.6 典型病例
SMA钙化斑块形态呈点状、条状及环状钙化斑块(图1)。
3 讨论
IBD临床表现常与缺血程度、缺血范围、病因及侧支循环状况相关,包含慢性肠系膜缺血、急性肠系膜缺血及缺血性结肠炎3种,其中急性肠系膜缺血病发率低,但有较高的死亡率,临床需引起重视[7-10]。IBD患者早期症状不明显,在检出时患者往往可能错过最佳治疗时机,因此提高对IBD的早期诊断十分关键[11-13]。
SMA相关病变包含SMA夹层动脉瘤、肠系膜缺血性病变、肠系膜上动脉压迫性病变,其中SMA夹层动脉瘤可诱发肠系膜末梢缺血,为危重急症;肠系膜上动脉压迫性病变包括胡桃夹综合征及十二指肠瘀滞症,严重影响患者生活及身体健康;肠系膜缺血性病变包含慢性及急性病变,急性病变可能引发肠坏死,慢性SMA缺血多由动脉粥样硬化引起,随着疾病发展,可造成慢性肠缺血,出现钙化斑块,引起管腔狭窄及闭塞。IBD的发生取决于患者受累血管、部位、缺血时间及循环状态,早期多以腹痛入院就诊,随着疾病的发展,可能出现肠穿孔、肠坏死、肠梗阻。本研究的目的在于充分认识IBD患者的SMA钙化CT表现,对SMA是否出现IBD进行早期诊断,尽早接受治疗,改善预后。
腹部CT血管造影或CT检查在IBD诊断中具有重要意义。IBD患者在CT检查中表现为结肠壁节段性、均匀性的增厚,还可见拇纹征、晕征,在CT检查中能有效排除其他可能导致急性腹痛的原因,确定结肠出血程度及部位[14-16]。有研究发现冠脉钙化积分法证实在SMA上动脉钙化引起了血管狭窄[17],提示对CA及SMA的粥样斑块钙化情况进行评估可为临床对IBD的早期诊断提供依据。SMA为横结肠及升结肠右半阶段供血,而肠系膜下动脉则为降结肠、横结肠左半段及乙状结肠供血,钙化斑块是临床诊断动脉硬化进展的重要标志[18-19]。有研究指出,动脉壁出现钙化性斑块是导致患者内脏器官缺血的重要因素,且冠状动脉钙化斑块的严重程度及范围也可在一定程度上反应冠心病发作风险,而肠系膜粥样硬化是IBD患者远期死亡的独立预测因子;另外SMA动脉粥样硬化还可能引发管腔血流减少、管腔变狭窄等,影响患者预后,因此加强对SMA斑块钙化的早期监测可为IBD患者的早期诊断提供有效依据[20-22]。分析IBD的早期诊断效率较低可能是因为:在出现环状斑块前,肠壁可能出现部分代偿性扩张;在动脉超声研究中提示,管腔狭窄程度在20%~30%时,管腔血流速度显著加快,影响CT检查;硬化性斑块可能向管壁外生长,导致管腔受压不明显,影像学检查受限;部分动脉硬化存在非钙化病变,在CT影像检查中难以辨别[23-25]。本研究发现IBD患者与非IBD患者在CA钙化斑块各形态总数方面比较无显著差异,但IBD组SMA钙化斑块总数显著高于非IBD组,提示在存在SMA钙化斑块数量较多时,可能引发IBD,需引起临床重视。另外,IBD组SMA钙化斑块主要以SMA远段为主,其次是SMA近段,而非IBD组钙化斑块主要以SMA近段、SMA中段,位置分布情况有显著差异,IBD组SMA斑块的血管夹角显著低于非IBD组,两组开口处狭窄程度比较有统计学差异,提示在出现大量SMA远段钙化斑块且开口处较狭窄时,可能会引发IBD;SMA从开口处到远段逐渐变窄,而在远段端极易出现阻塞性管腔,降低肠道血供,而肠壁供血动脉压<40 mmHg时,则会诱发IBD[26-27]。本研究还发现IBD组患者SMA斑块钙化程度与其开口狭窄程度呈正相关,提示开口越狭窄,SMA斑块钙化程度越严重,则越可能诱发IBD。
综上所述,老年患者SMA钙化性病变多以远段为主,开口处狭窄程度还与IBD发生有显著相关性,提示CT对辅助临床对IBD的早期诊断有重要价值。

