基于金属标记ICP-MS免疫分析的放大策略研究进展
李祎璠 赵珍阳 杜 康 孙传强 龚子珊 张 勇 王世功 汪 曣*
(1.天津大学 精密仪器与光电子工程学院,天津 300072;2.山东东仪光电仪器有限公司,烟台 264000)
1 引言
蛋白质定量在生物学研究中具有重要意义,蛋白质表达水平的变化控制着生物细胞或生物体中的许多特殊功能[1]。目前,基于抗体的免疫分析是特异性蛋白定量的主要手段。1959年,放射免疫分析法(RIA)由Yallow等[2]建立,通过放射性同位素标记抗体,但该方法存在放射性健康危害、废物处理等问题。之后提出的一些非放射性免疫分析方法,在过去几十年中已成功地应用在分子检测上,包括酶联免疫分析法(ELISA)[3]、时间分辨荧光免疫分析(TRFIA)[4]、化学发光免疫分析(CLIA)[5]、和电化学发光免疫分析(ECLIA)[6]等,但这些方法在动态范围、灵敏度、分辨率等问题上仍受到明显的限制[7]。
电感耦合等离子体质谱(ICP-MS)作为测定多种金属和几种非金属最主要也最灵敏的商业化仪器[8],其优点包括检测限低、基质效应低、动态范围宽等[9]。因此,基于ICP-MS的免疫分析法[10]自2001年首次提出以来,已成为免疫检测领域一个快速发展的研究方向。该方法的优点包括:(1)易于通过信号放大手段进一步提高检测灵敏度;(2)ICP-MS是对标签上的原子直接进行检测,因此检测与标记物的光学、电学、磁性等性质无关;(3)ICP-MS在元素的检测上的良好分辨率使其拥有了实现多组分同时检测的可能。
目前已经实现了小分子、蛋白质、核酸以及单细胞等生物样品的检测[11]。本文综述了ICP-MS免疫分析的主要发展和应用,以各项技术的发展顺序为线索,着重介绍其中的信号放大策略,并讨论不同技术的优点和局限性。
2 ICP-MS免疫分析方法的信号放大策略
2.1 基于ICP-MS的免疫分析方法简介
1980年,Houk等[12]首次采用将电感耦合等离子体作为离子源与质谱技术结合,三年后诞生了第一台商用电感耦合等离子体质谱(ICP-MS)。如图1所示,ICP-MS通常由进样系统、ICP源和质量检测器组成。样品(通常为液体)被泵入进样系统,形成气溶胶,之后通过ICP炬管,在等离子体的不同加热区被干燥、蒸发、雾化和电离。在此过程中高效的离子产生、提取和传输赋予了ICP-MS特有的超快检测能力。典型的ICP-MS(配备四极杆质量分析器)可以以高灵敏度同时检测100多种同位素,分辨率在0.7~1.0个原子单位。

图1 典型的ICP-MS系统示意图[13]
为了获得免疫分析的特异性,标记试剂通常需要费力的设计与合成,极大限制了其可用性,不仅价格高昂,而且难以维持稳定性。并且,只有对大量的生物标志物的综合调查才能提供准确的临床诊断,因此迫切需要高灵敏度和同时多组分免疫分析的研究。
2.2 元素标记结合ICP-MS免疫分析
抗体能被ICP-MS有效检测的前提是在其上进行元素标记[14]。2001年,Zhang等开创性地报道了基于ICP-MS和元素标记免疫分析联用的方法,定量检测抗促甲状腺激素(TSH)[15]和总甲状腺素(T4)[16](如图2)。使用常用于TRFIA中的元素标签,通过ICP-MS检测,得到了与RIA和CLIA方法具有良好一致性的定量结果,证明了该方法在竞争和夹心免疫体系中的有效性。

图2 非均相免疫分析的两种形式
与固相载体(如微孔板)相比,将磁纳米颗粒作为反应载体能够进一步的提高检测灵敏度。免疫磁球由于其较大的比表面积、较快的反应动力学等特点,适用于快速、灵敏的免疫反应[17]。Peng等[18]提出了基于汞离子标记磁性免疫分析的ICP-MS检测方法,检测人血清癌胚抗原(CEA),并使用体积排阻色谱(SEC)分离标记汞离子的抗体和过量汞标记,结果与CLIA具有一致性。
在ICP-MS细胞分析领域,质谱流式细胞仪的出现具有重要意义。2009年,Bandura等开发了质谱流式细胞仪ICP-TOF-MS(CyTOFFM,DVS公司),通过不同稀土元素标记的抗体对白血病细胞株和白血病人单细胞表面20种抗原实现了同时检测。
在数据处理和误差补偿方面,研究者们也做了大量工作。2018年,Zhang等[17]使用Sm和Y元素标记建立了一种基于ICP-MS的竞争免疫分析比值定量法,使用Y标签修饰抗体作为内标,Sm结合抗原与待测β2-微球蛋白抗原竞争性结合,取两种元素的比值作为量化信号,补偿了操作过程中的粒子损失,提高了定量结果的精度,检出限为0.17 μg/mL。
早期用于ICP-MS免疫分析方法的元素离子标记物主要来自传统的免疫测定方法,如表1所示,标记元素应对ICP-MS有高灵敏度,并具有低的同质异位素干扰[19]。然而,大环化合物的高空间位阻、汞化合物的高毒性等问题,需要通过研究针对ICP-MS免疫方法设计的特殊标签来解决。
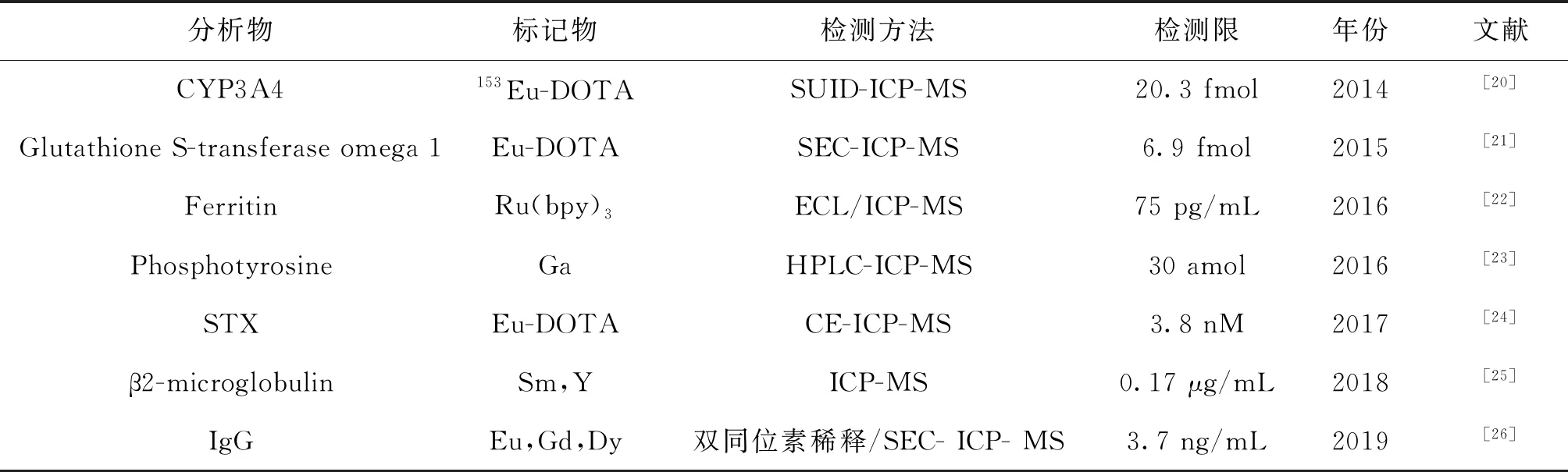
表1 元素标记结合ICP-MS免疫分析的应用
2.3 纳米颗粒标记结合ICP-MS免疫分析
使用纳米粒子标记放大检测信号引起了许多学者的兴趣,其优点在于:每个纳米颗粒6标签中包含大量可检测原子(以金纳米颗粒为例,10nm直径的AuNPs中含有约30000个Au原子),易于进一步提高抗体检测的灵敏度。2002年,Zhang等[27]建立了胶体金纳米颗粒标记抗体应用与夹心免疫反应的方法,使用标记过的羊抗兔免疫球蛋白G(IgG)测定兔抗人IgG,检出限为0.4ng/mL。
同年,Quinn等[28, 29]使用金纳米团簇和Eu作为标记,每个1.4nm的金团簇包含大约70个金原子,将离心过滤、体积排阻凝胶过滤、蛋白质琼脂糖A亲和色谱和酶联免疫吸附分析四种方法与ICP-MS连用,实现了复杂生物基质中两种蛋白质的同时检测。作者指出,使用金纳米颗粒的潜在缺点是金对典型的ICP-MS样品引入系统具有较高的表面亲和力,然而实验观察到在样品中存在蛋白质时这种效应显著降低,可能是由于表面的络合或钝化作用。
将纳米颗粒标记与其他方法联用可以在信号放大的同时获得更好的信号稳定性和灵敏度。如图3所示,Ko等[30]使用金纳米颗粒作为标记物,使用掺杂有Cs和FITC的多核磁性纳米颗粒(MMNP)用于磁分离,特异性的提取血清中的CA19-9,并且将掺杂的Cs用作标记颗粒的比率测量的内标。这种比率法补偿了磁分离中的颗粒损失,并抑制了信号波动,显着提高了校准线性度。该方法检测限为0.02 U/mL,比使用元素标记的ICP-MS报道方法的检测限低300倍以上,与ELISA相比提高约500倍。Liu等[31, 32]使用银增强-金纳米离子标记的方法,检测人癌胚抗原CEA,检出限低至0.03ng/mL,经过15分钟的信号放大程序,将检测灵敏度提高了60倍。

图3 量子点标记免疫反应示意图[30]
使用传统ICP-MS积分模式检测方法来分析纳米粒子只能实现单分子检测,不够灵敏,而使用时间分辨模式(SP-ICP-MS)有望进一步提高灵敏度。2009年,Zhang等[33, 34]首次证明了通过SP-ICP-MS可以实现单纳米粒子标记的免疫分析,并证明了该方法可以用于竞争和非竞争免疫分析(对AFP的检出限达到了0.016ng/mL,对兔抗人IgG的检出限达到了0.1ng/mL)。同时,讨论了不同直径金纳米颗粒的信号特征,与传统积分模式进行对比,证明了该方法可以实现更高灵敏度的免疫分析。
另外,量子点也可以作为ICP-MS免疫分析的标记物。Hu等报道了使用CdSe NPs[35]和PbS NPs[36]标签用于ICP-MS免疫分析。提出了用CdSe NPs标签和微同心雾化器(MCN)ICP-MS结合免疫亲和整体毛细管微萃取(CME)测定人血清中IgG的方法,给出基于Cd信号的检出限为0.058 ng/mL,基于Se信号的检出限为0.097 ng/mL。另外,在PbS NPs标记后,采用微流控芯片磁性免疫分析法法结合电热蒸发(ETV) ICP-MS法测定CEA,方法检出限为0.058 ng/mL。研究表明[37],ICP-MS检测方法能够降低基质效应,并减轻量子点表面非特异性吸附影响(表2)。

表2 纳米粒子标记结合ICP-MS免疫分析的应用
2.4 金属聚合物结合ICP-MS免疫分析
金属聚合物标签可以包含多个给定离子,ICP-MS信号随着给定元素原子的数量线性增加,极大地提高了免疫分析的灵敏度,并且动态范围广、复杂基质干扰小。2007年,Lou等[46]开发了一种带有多种金属螯合配体的水溶性聚合物作为标记物,如图4a所示,每条链带有33个镧系金属离子,同时测定两种细胞表面上的5种抗体,这些抗体的丰度相差超过两个数量级。2010年,Majonis等[47]合成了用于抗体标记的第二代金属螯合聚合物,如图4b所示,使用这种含有大量DTPA基团和Mal的聚合物在小鼠抗人IgG上标记了159Tb,ICP-MS检测结果显示每个抗体上含有161±4个159Tb,等温滴定量热法(ITC)结果显示一个抗体上含有2.4±0.3个聚合物。将这种金属螯合物用于11重单细胞分析,鉴定并丰富了人脐带血中的不同细胞群。
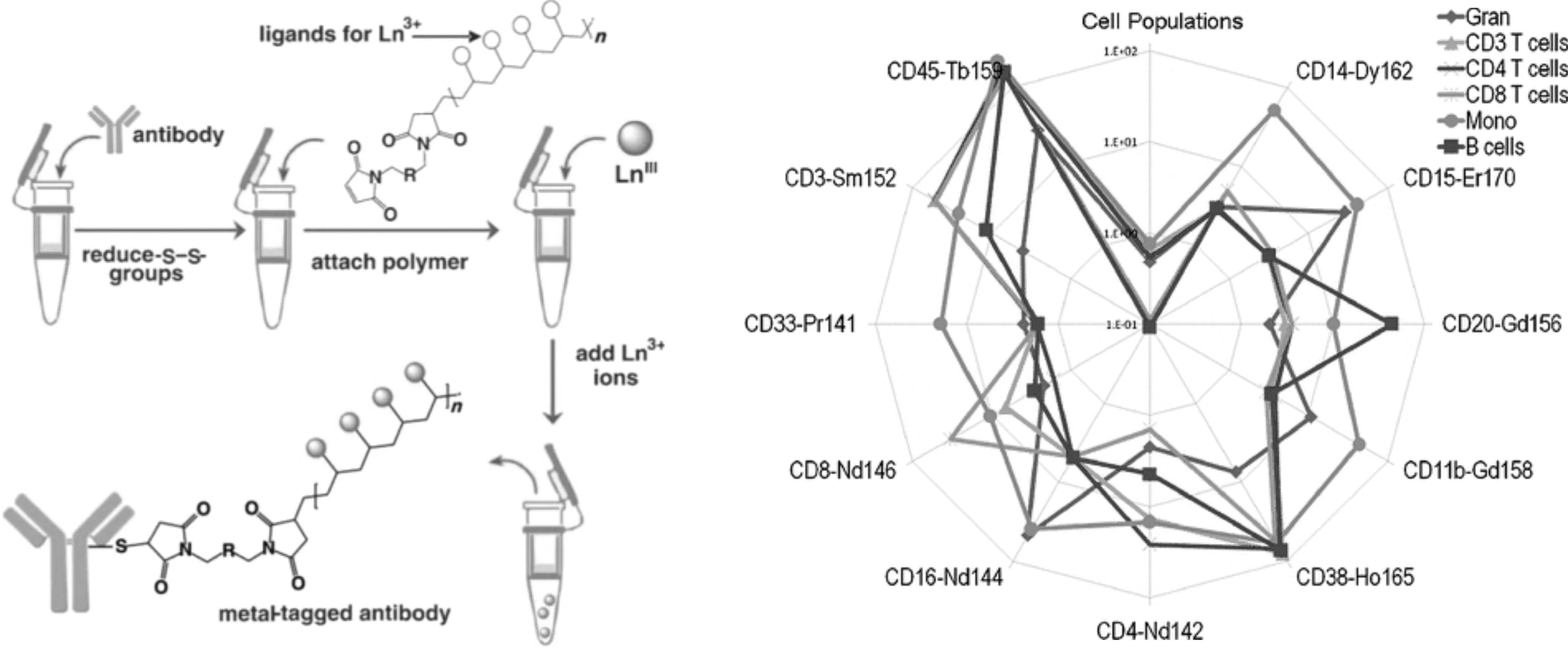
图4 图名
2014年,Bruckner等[48]用DOTA标记的氨基酸作为结构单元,合成了多肽作为稀土元素探针。使用的固相多肽合成法(SPPS)是一种寡聚多肽的合成方法,其合成标记物只有4个DOTA结构单元。尽管探针数量相对较低,但SPPS方法能够保证每个标记物上可络合确定数目的稀土离子,从而用于生物大分子的精准定量(表3)。
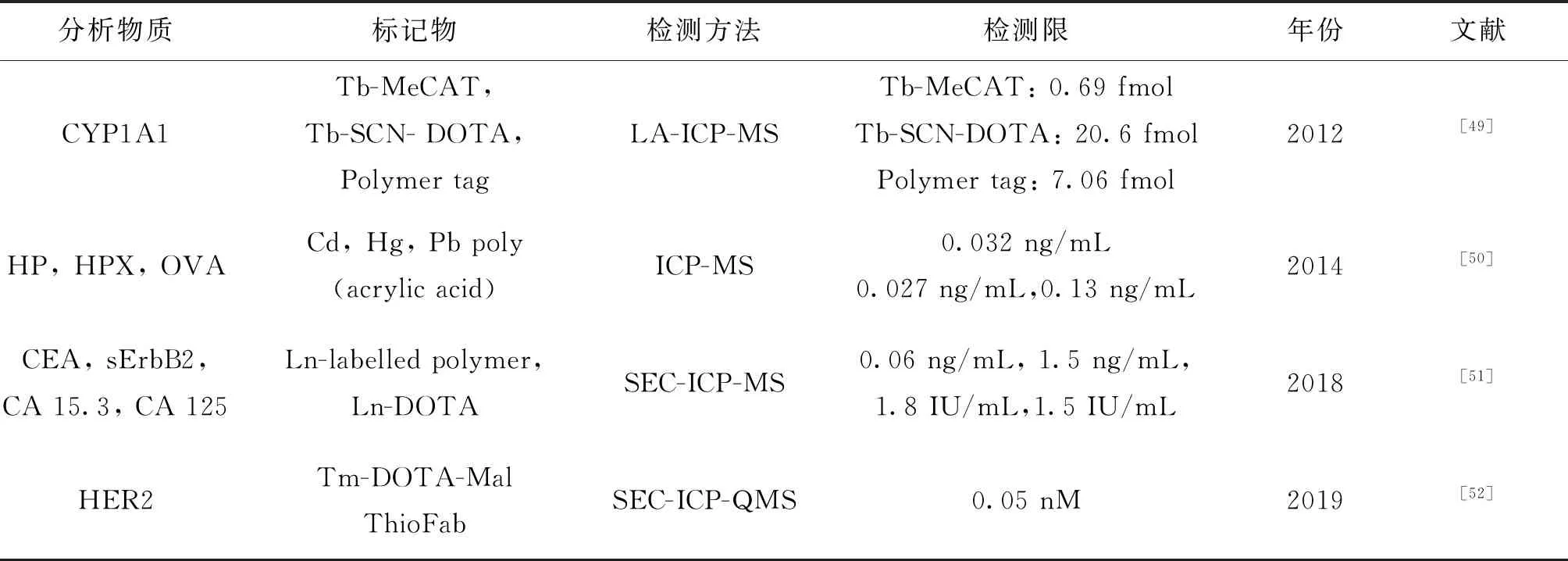
表3 金属聚合物标记结合ICP-MS免疫分析的应用
2.5 扩增技术结合ICP-MS免疫分析
传统元素标记方法结合DNA扩增技术能够很好的提高ICP-MS的检测灵敏度。最为普遍的放大反应包括聚合酶链式反应(PCR)、滚环扩增反应(RCA)、杂交链式反应(HCR)等,都已有基于ICP-MS的分析方法报道[53]。
2014年,Brukner等[55]使用DNA连接酶扩增和磁性微球分离,利用Tb标记DNA探针,对DNA的检出限达到2.6 amol,与传统无扩增DNA检测法的灵敏度提高了6000倍。2018年,Zhang等[54]提出了基于禽流感病毒(AIV)表面上凝集素ConA和糖蛋白之间的选择性识别和杂交链式反应(HCR)信号放大的ICP-MS病毒粒子分析方法,如图5所示,以H9N2为模型,由于AuNPs和HCR的双重扩增效应,检出限降至0.12 ng/mL,与ELISA方法相比,检出限提高了两个数量级,并且避免了耗时的病毒裂解和蛋白质或核酸提取程序。2019年,Li等[56]报道了一种用于计数循环肿瘤细胞(CTC)的方法,通过结合滚环扩增(RCA)和金纳米颗粒(Au NPs)标记,利用ICP-MS及双重放大策略实现了3HepG2细胞(15 细胞/mL)的最低检测限,与不使用RCA的Au NPs标记方法相比,灵敏度提高了756倍(表4)。
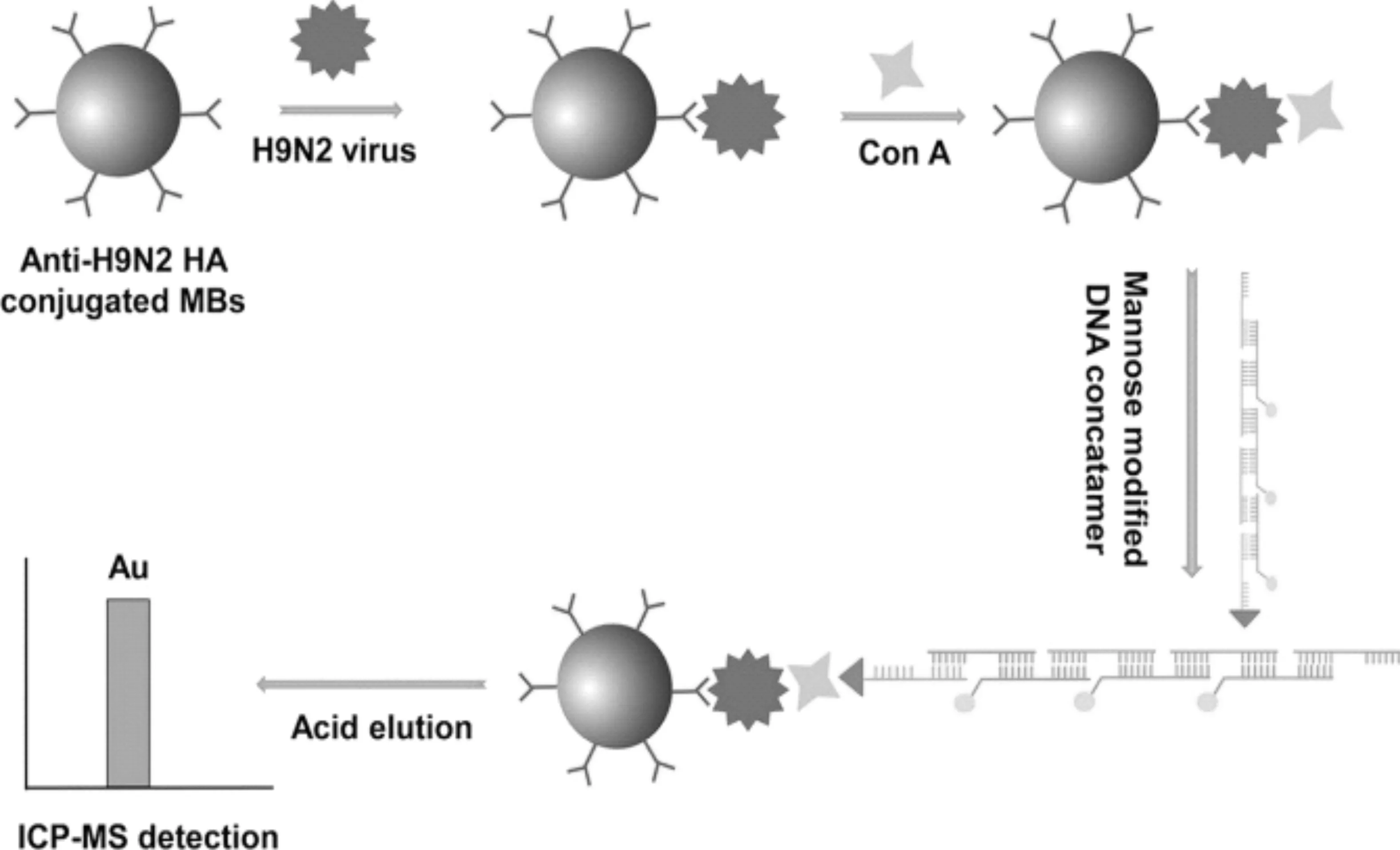
图5 H9N2病毒免疫分析示意图[54]

表4 扩增技术结合ICP-MS免疫分析的应用
3 总结与展望
纵观ICP-MS的免疫分析技术的发展历程,从放射元素、金属螯合物到骨架聚合物、再到纳米粒子标记,同时伴有单颗粒检测模式以及扩增方法的引入,始终不变的前进方向是放大检测信号、提高检测方法灵敏度。在这几种方法中,最容易实现的是纳米颗粒标记法,在其他免疫分析手段中常用的标记物如纳米金、纳米银、氧化物纳米颗粒、量子点等,即使不针对ICP-MS进行优化也可以取得更好的检测灵敏度,并且通过单颗粒检测模式(SP-ICP-MS)可以克服粒径不均一和溶解元素干扰测定的问题。聚合物标记物的主要优点在于放大倍数精确可控、结构稳定、基质效应低,但总的放大倍数不如其他方法高。扩增技术在核酸和细胞检测领域具有重要的应用价值,且方法较为成熟,目前是发展最快的一个方向。
对于生物分析来说,高敏分析方法的进步更有助于阐明微观水平(单个细胞或亚细胞水平甚至单分子水平[61])上的生命活动过程和机制,因此不断开发出灵敏度更高的分析方法具有重要的意义。基于ICP-MS的高灵敏度免疫分析可以降低对样本量的要求,实现微量样本的检测,对于临床疾病的预防和诊断也有着重要的作用。

