富勒烯在纳米生物医学领域中的应用
邵磊厚 刘珊珊 黄雯雯 张 梅 刘伟丽 马博凯
(北京市理化分析测试中心,有机材料检测技术与质量评价北京市重点实验室,北京 100089)
富勒烯是由Kroto 等人于1985年首次发现,三位科学家也因此荣获1996年诺贝尔化学奖,它的发现也极大地促进了纳米技术的发展[1]。富勒烯的结构特点赋予其独特的物理化学性能,使其在催化、环境、能源和生物医药等领域展现出巨大的应用潜力。富勒烯作为碳纳米材料家族的同素异形体之一,是由sp2杂化的碳原子构成,具有高度的对称性、独特的表面特性和不同的尺寸特征(C60、C76等)[2]。其中,C60是合成和研究最多的富勒烯材料,具有球形32面体结构,由包含C-C单键(12个五边形)和C-C双键(20个六边形)的60个碳原子组成[3-5]。富勒烯具有抗氧化活性、抗菌活性、光动力活性和细胞保护作用等多种生物学效应,可以作为药物载体用于药物递送,作为良好的光敏剂用于光动力治疗,在纳米生物医学领域发挥了重要作用。本文着重综述了近年来富勒烯在纳米生物医学领域中的应用进展,并对其未来发展进行了展望。
1 药物载体
恶性肿瘤是人类健康的主要威胁之一,是由体内变异细胞无限增值导致的一种疾病[6]。恶性肿瘤的治疗方式主要有:外科手术、放射治疗和化学治疗。其中,化学治疗主要是通过口服或者注射给药的方式利用化学药物治疗恶性肿瘤一种治疗手段。化学治疗面临的一大挑战就是缺乏特异性,容易造成明显的毒副作用。其次,肿瘤细胞的耐药性,需要更大剂量的药物或者更多种类的药物,这进一步增加了化学治疗的毒副作用。纳米技术的发展为克服化学药物治疗的局限性提供了新的思路,可以显著提高药物的递送效率,减小毒副作用[7]。富勒烯材料独特的碳笼结构特征使其有望成为良好的药物载体用于药物递送。肿瘤组织增强的渗透和滞留效应(enhanced permeability and retention,EPR)使得纳米药物载体可以通过被动靶向的方式相比于化学药物分子更好的在肿瘤部位累积。其次,富勒烯的表面结构可以通过连接多种基团进行功能化改性,不仅可以实现主动靶向给药的目的,进一步提高药物递送效率,而且可以改善富勒烯的生物相容性[8]。
富勒烯作为药物载体,不仅可以通过非共价键相互作用对药物分子进行负载,也可以通过共价键连接负载药物分子。化学治疗药物阿霉素(doxorubicin)作为临床常用的广谱抗癌药物之一,对乳腺癌、卵巢癌等多种癌症都具有一定的治疗效果。但是,其使用过程中会造成明显的毒副作用,例如心脏毒性。Grebinyk等[9]将富勒烯与阿霉素通过非共价键的方式结合制备得到一种基于富勒烯的纳米药物复合物(图1a)。实验结果表明,这种纳米药物复合物具有良好的稳定性,富勒烯可以高效的将阿霉素递送到肿瘤细胞中,促进肿瘤细胞对于阿霉素的摄取,并可以在肿瘤细胞中实现很好的药物释放,实现高效的治疗效果,从而可以显著降低药物的毒副作用。另一项研究工作中,Zakharian等[10]将天然抗癌药物分子紫杉醇(paclitaxel)通过共价连接的方式与富勒烯组合成一种新型纳米药物复合物(图1b)。实验结果表明,这种纳米药物复合物具有酶响应以及缓释的释放行为,并且针对肺癌细胞显示出高效的治疗效果。
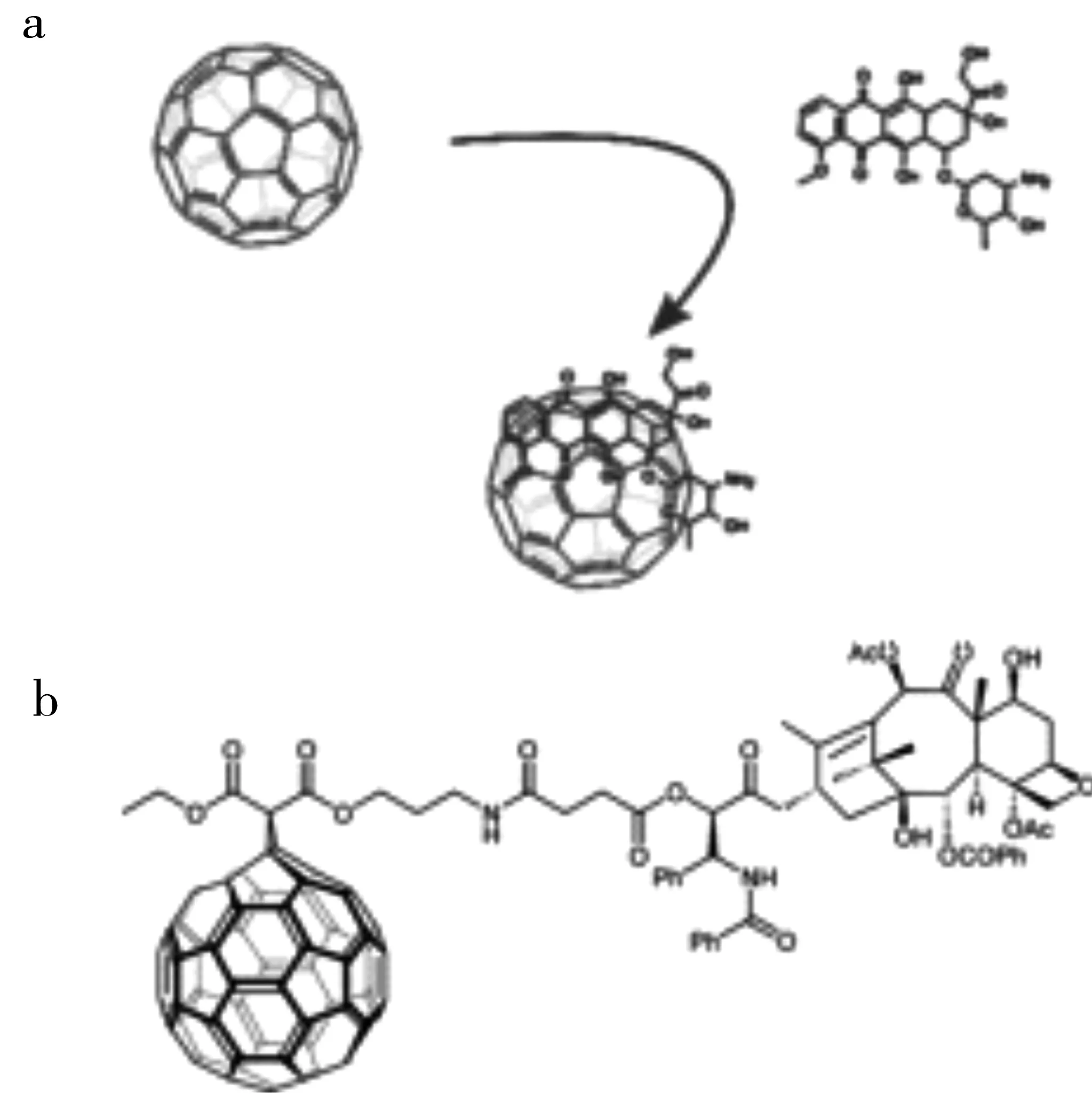
图1 富勒烯负载阿霉素[9]和紫杉醇[10]示意图
此外,富勒烯进行表面共价基团连接还可以实现主动靶向的功能。主动靶向是基于配体和受体的特异性结合,从而实现特定部位靶向给药的目的。透明质酸的受体CD44在多种肿瘤细胞中高表达,因此经透明质酸修饰后的药物载体可以与高表达CD44的肿瘤细胞特异性结合,从而实现主动靶向的功能。Kwag等[11]通过共价连接的方式制备得到一种透明质酸化的富勒烯材料,具有优异的水溶性、光敏性、近红外荧光性质和肿瘤特异靶向性(图2a)。体内荧光成像实验结果表明,接种有CD44高表达肿瘤的小鼠(CD44+)静脉注射透明质酸化的富勒烯材料4 h后可以检测到强烈的荧光信号,且信号强度随着时间的延长逐渐增加,与之对比,另一组小鼠(CD44-)的肿瘤部位则显示出较弱的荧光信号,说明相对于依靠EPR效应被动靶向累积至肿瘤组织来说,通过与肿瘤细胞表面CD44受体特异性结合的主动靶向给药方式可以使得纳米药物复合物更有效地积聚到肿瘤组织中。Shi等[12]通过共价连接的方式修饰上靶向分子叶酸,随后进一步通过非共价相互作用负载药物分子多西他赛(DTX),得到一种具有主动靶向功能的纳米药物递送体系(图2b)。多种肿瘤细胞都高表达叶酸受体,因此叶酸修饰后的药物载体可以特异性识别肿瘤细胞高表达的叶酸受体。实验结果表明,与裸药DTX相比,这种纳米药物递送体系可以更好的被肿瘤细胞所摄取,诱导更多的肿瘤细胞的死亡。进一步的体内实验表明,DTX经药物载体负载可以有效的延长血液循环时间,实现更高效的肿瘤部位的累积,保证高疗效的同时对小鼠正常器官没有造成明显的毒副作用。
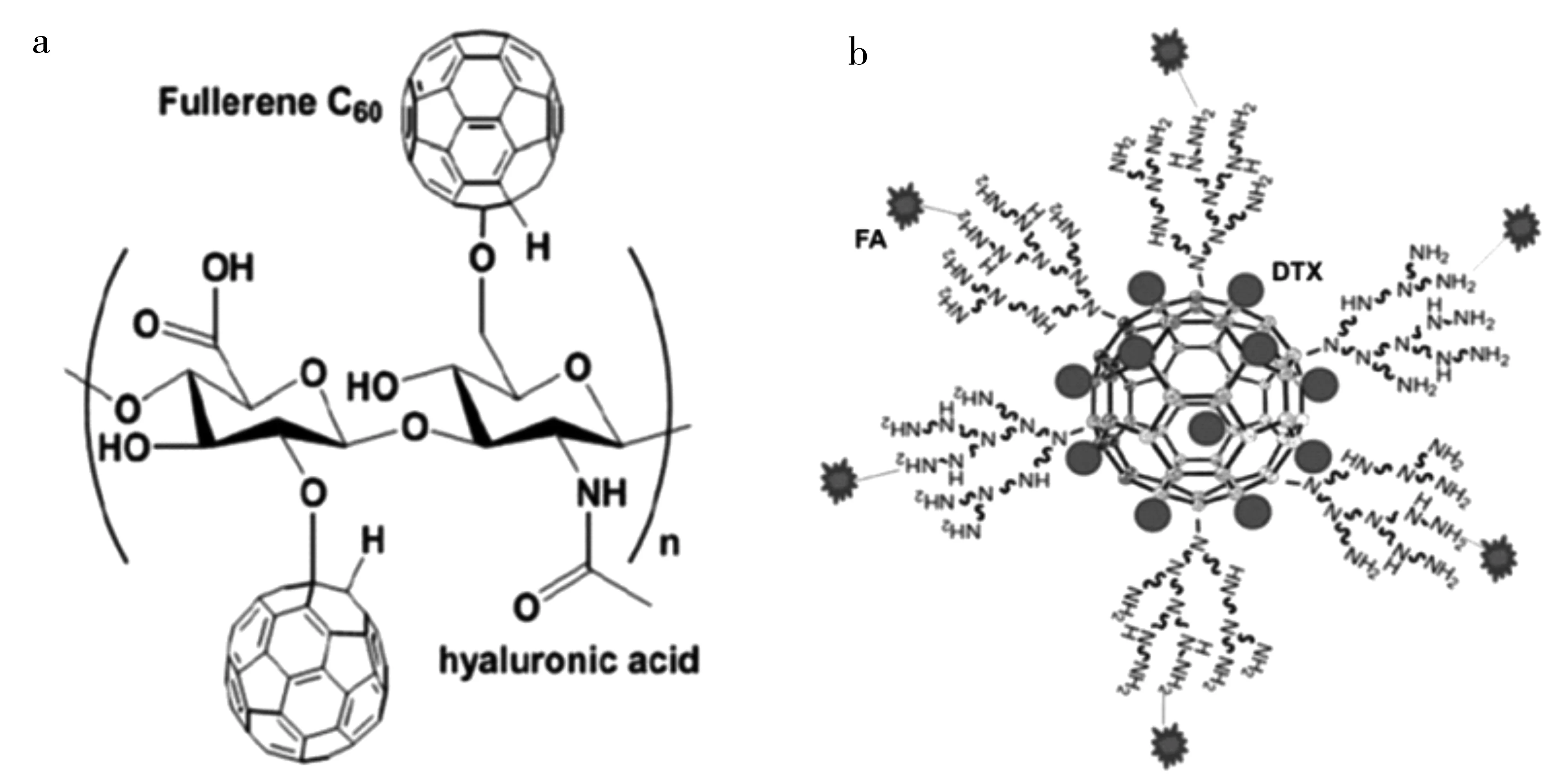
图2 透明质酸[11]和叶酸[12]功能化的富勒烯示意图
血脑屏障(blood-brain barrier,BBB)是由内皮紧密连接组成的物理屏障,可以阻止有害物质通过血液到达脑组织,也是中枢神经系统(central nervous system,CNS)给药面临的最大挑战[13]。有研究指出,富勒烯材料可以跨过血脑屏障进入到大脑组织,这使其在中枢神经系统药物递送中具有巨大的应用潜力[14,15]。Piotrovskiy等[16]制备了基于富勒烯的六甲铵药物复合物。单独的六甲铵分子对于中枢神经系统的渗透能力有限,所以需要在比较高的给药剂量下才能取得理想的治疗效果。与单独的六甲铵药物治疗组对比发现,在相同的给药剂量下,富勒烯与六甲铵药物复合物的疗效大约提高了40倍,说明药物复合物可以实现高效的中枢神经系统递送效率。Hsieh等[17]制备了多种不同表面官能团改性的水溶性富勒烯衍生物。体内实验表明,这些水溶性的富勒烯衍生物可以有效地穿越小鼠的血脑屏障,可以作为药物载体用于大脑组织的药物递送(图3a)。进一步的研究表明,不同的表面官能团改性决定了富勒烯的性质以及与中枢神经细胞和神经胶质瘤细胞的相互作用,产生神经保护或者抗肿瘤作用,从而可以用于治疗中枢神经系统相关疾病(图3b)。
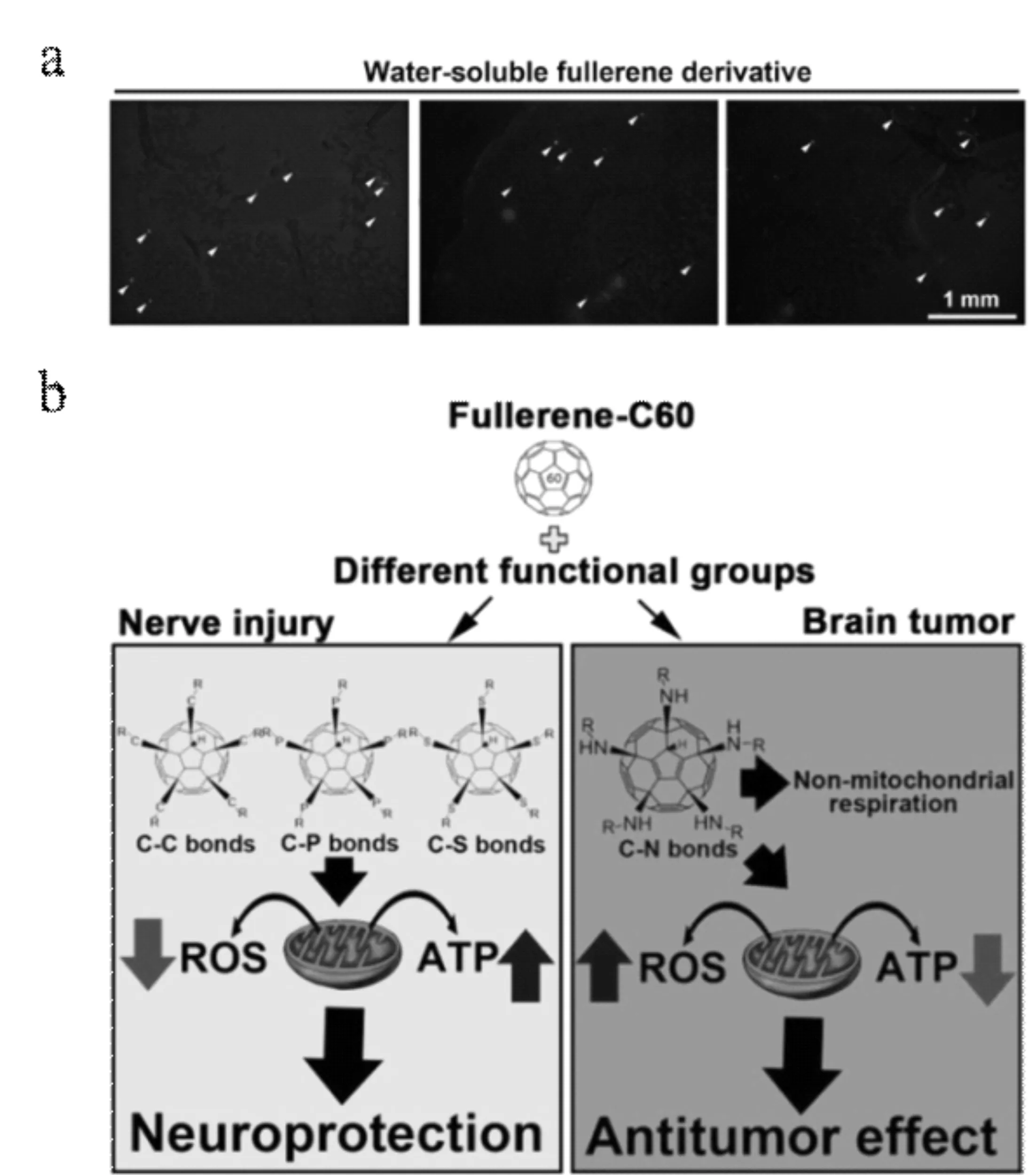
图3 富勒烯穿越血脑屏障及其在中枢神经系统疾病中的应用示意图[17]
2 光动力活性
光动力治疗(photodynamic therapy,PDT)是一种依赖氧诱导细胞和组织效应的治疗方式,基于目标组织中对于光敏剂(photosensitizer,PS)的吸收,特定波长的激光照射激活,光敏剂将光中的能量转移至分子氧,进而产生活性氧(reactive oxygen species,ROS),随后引起细胞凋亡和组织破坏[18,19]。这些反应只会发生在吸收有光敏剂的组织部位,对于光敏剂的生物学响应也只会在激光照射的组织特定区域发生。光动力治疗以其安全可靠的疗效,已经成为肿瘤治疗的重要手段,在纳米生物医学领域发挥越来越重要的作用。基态富勒烯可以吸收光子能量,跃迁至寿命较短的激发单重态,激发单重态可以通过系间窜越的方式生成寿命较长的激发三重态。激发三重态的富勒烯可以通过发出磷光回到基态,也可以与基态的三线态氧(3O2)进行能量转移从而生成单线态氧(1O2)或者通过电子转移反应形成HO·、超氧化物和过氧化氢。这些ROS会破坏脂质、蛋白质和DNA,从而有效杀死肿瘤细胞和破坏肿瘤组织(图4)[20-22]。与已有报道的光敏剂相比,富勒烯具有更高的量子产率,更加适用于光动力治疗[23]。Tokuyama等[24]首次报道了在光照下,富勒烯材料能够对肿瘤细胞的生长产生抑制作用。Tabata等[25]第一次研究了体内富勒烯材料的肿瘤光动力学治疗效果。为了提高富勒烯的水溶性,对富勒烯进行了表面聚乙二醇(polyethylene glycol,PEG)功能化修饰(C60-PEG)。C60-PEG通过静脉注射给药的方式注射到接种有移植瘤的小鼠体内。实验结果表明,相比于正常组织,C60-PEG可以更好的富集至肿瘤部位,并且具有较长的滞留时间。肿瘤部位经过可见光照射后,注射有C60-PEG的小鼠的肿瘤生长得到明显抑制,并且对于上皮组织没有造成损伤。
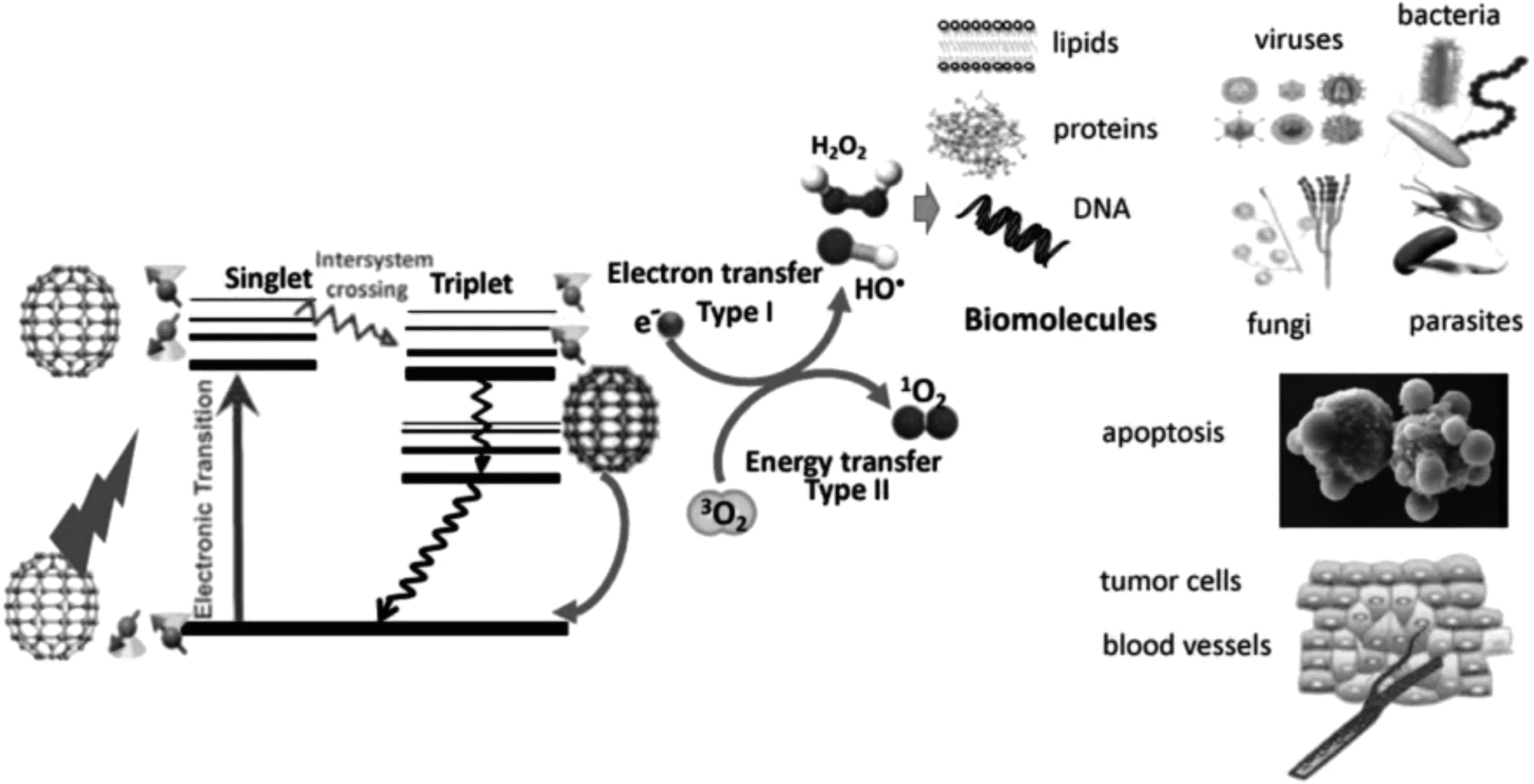
图4 富勒烯材料的光动力活性[22]
富勒烯材料作为光动力疗法的光敏剂在抗肿瘤领域得到广泛的研究,通过与肿瘤诊断和其他治疗手段结合,可以实现更高效的治疗效果,显示出其在肿瘤诊疗中的巨大应用潜力。Tang等[26]开发了一种基于富勒烯-罗丹明B的具有肿瘤微环境pH响应可见光吸收、荧光成像以及光动力治疗效果的新型光敏剂复合物材料(图5)。在酸性条件下,新型光敏剂复合物材料可以实现可见光吸收增强、荧光开启和激发三重态的产生。细胞实验表明,光敏剂可以很好的被肿瘤细胞摄取和具有溶酶体(pH 4.5~5.0)激活的特性,荧光开启的同时可以有效的产生ROS,实现高效的光动力治疗效果。
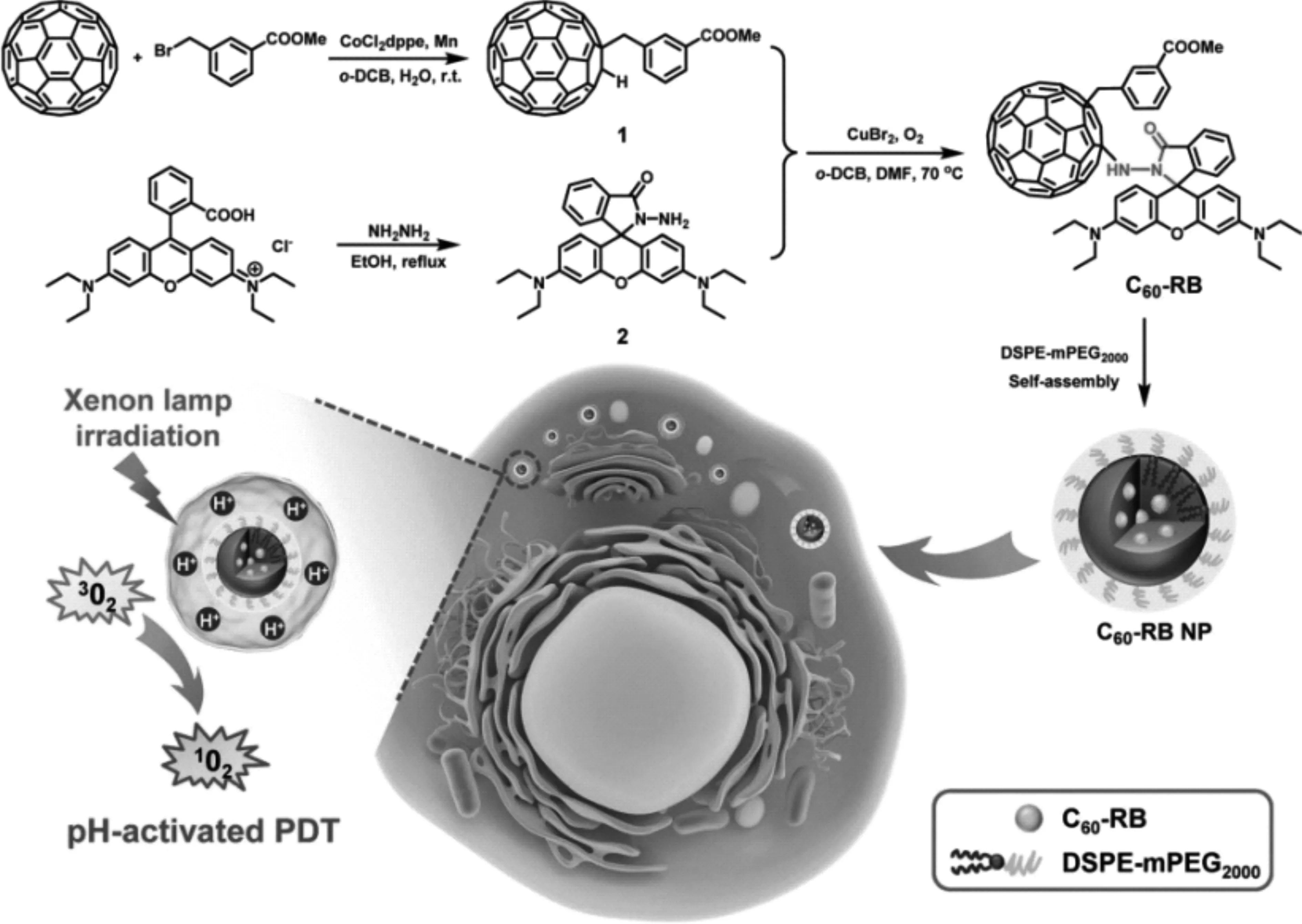
图5 基于富勒烯的具有光动力治疗效果的复合材料示意图[26]
此外,富勒烯还可以通过联合其他治疗手段,实现比单一治疗方式更高效的联合治疗。Fan等[27]基于富勒烯材料通过共价连接抗癌药物阿霉素(DOX)和特异性靶向配体叶酸(FA)开发了一种具有主动靶向、pH响应化疗和光动力治疗(PDT)特性的新型多功能抗癌前药体系(图6)。该前药可以特异性靶向叶酸受体高表达的肿瘤细胞,通过胞内pH响应性药物释放杀死肿瘤细胞。此外,富勒烯材料具有光动力活性,该前药经过光照后产生活性氧,使得对于叶酸受体高表达的肿瘤细胞的毒性进一步增加,实现相对于单一化疗和光动力治疗更高效的治疗效果。由于富勒烯材料具有较强的电子接收能力,化疗药物分子DOX共价偶联到富勒烯表面会使得DOX的荧光被富勒烯淬灭掉,而DOX从富勒烯中释放出来后,荧光就会恢复。因此,这种荧光淬灭-恢复的特性可用于示踪胞内DOX的释放过程。
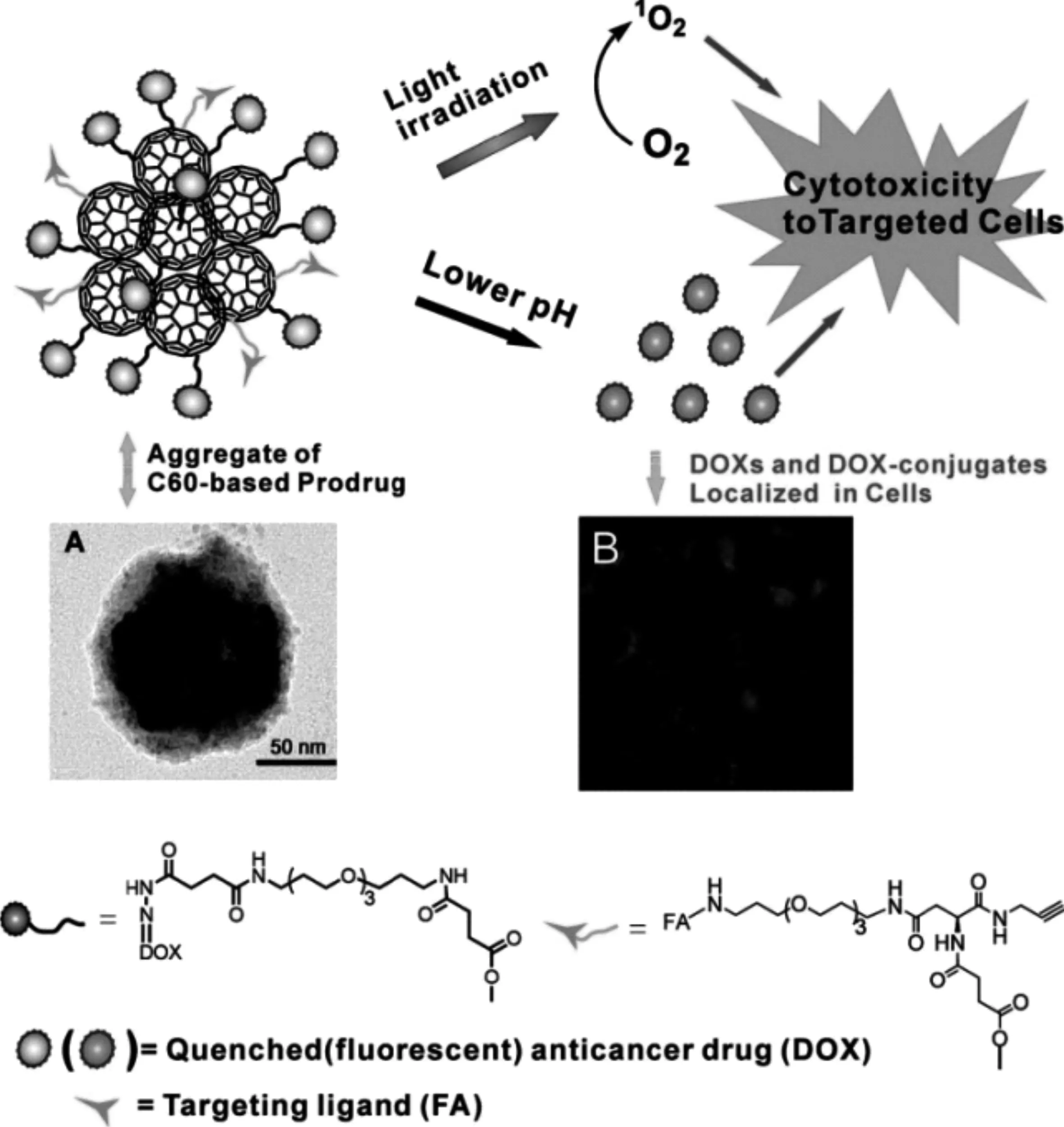
图6 基于富勒烯的多功能抗癌前药示意图[27]
3 抗氧化活性
生物体内氧化和抗氧化作用的平衡在维持机体生物系统的安全性中起到重要作用,化疗药物、外界辐射、细胞代谢以及细胞的异常反应导致产生的大量活性氧,比如超氧自由基阴离子、羟基自由基、单线态氧和过氧化氢等,使得氧化和抗氧化作用的失衡,进而诱导的氧化应激与许多急性和慢性疾病的发生机制密切相关,包括癌症、心血管疾病和许多神经退行性疾病等。因此,有效清除活性氧对于保持机体健康以及预防由自由基过多引起的疾病具有重要意义[28]。大量的研究指出,富勒烯不仅可以作为光敏剂在激光照射下产生ROS用于肿瘤治疗,还具有抗氧化活性,作为生物抗氧化剂用于清除ROS。富勒烯的抗氧化活性基于其拥有大量的共轭双键和低空位的LUMO轨道,容易吸收电子与自由基发生反应,清除自由基的同时本身并不被消耗。因此,富勒烯也被认为是最有效的自由基清除剂,被称为“自由基海绵”[29,30]。富勒烯作为医学抗氧化剂最大的优势就是可以进入到细胞病变时产生大量自由基的线粒体部位或者细胞内其他部位。Gharbi等[31]对大鼠进行的一项实验证实了富勒烯良好的抗氧化活性。实验结果表明,不使用任何极性有机溶剂制备的富勒烯水性悬浮液不仅对啮齿动物没有造成急性或亚急性毒性,而且还表现出一种剂量依赖性地保护肝脏免受自由基损害的作用。因此,富勒烯被认为是一种有效的肝脏保护剂。
此外,富勒烯经极性基团功能化后形成的富勒烯衍生物,比如羟基化后形成的富勒醇(fullerenol),具有更好的水溶性以及穿过细胞膜定位于线粒体的能力,依然保持其优异的抗氧化活性。Yin等[32]制备了3种不同功能化的水溶性富勒烯材料,羧基富勒烯(C60(C(COOH)2)2)、富勒醇(C60(OH)22)和金属富勒醇(Gd@C82(OH)22),研究了它们在清除活性氧和保护细胞方面的潜力(图7)。实验结果表明,这3种不同类型的富勒烯衍生物都可以有效清除活性氧(ROS),超氧自由基,单线态氧和羟基等不同类型的自由基,并且还可以有效抑制脂质过氧化,可以作为活性氧抑制剂(抗氧化剂和自由基清除剂)用于细胞保护。体外通过使用人肺腺癌细胞系A549和大鼠脑毛细血管内皮细胞系rBCECs在过氧化氢诱导的氧化损伤条件下,对于3种富勒烯衍生物对细胞的保护作用进行评价。细胞实验结果表明,3种富勒烯衍生物都可以保护细胞免受过氧化氢诱导的氧化损伤,稳定线粒体膜电位并减少细胞内ROS的产生,3种富勒烯衍生物的清除自由基能力也存在一定的差异,相对来说,金属富勒醇(Gd@C82(OH)22)对细胞线粒体的氧化损伤具有更好的保护作用。这些差异性可能是由于经不同基团功能化的富勒烯具有不同的化学性质(例如表面化学性质不同引起的电子亲和力的差异)和物理性质(例如聚集程度)从而导致了不同的生物和生物医学活性。另一项研究工作中,Andrade等[33]利用理论研究对金属富勒烯(铜,银和金)的稳定性和自由基清除剂的能力进行了评价。理论研究表明,金属的存在大大提高了富勒烯的抗自由基能力,这些研究为解释金属富勒烯更好的抗氧化能力以及富勒烯基抗氧化剂的设计提供了理论支撑。
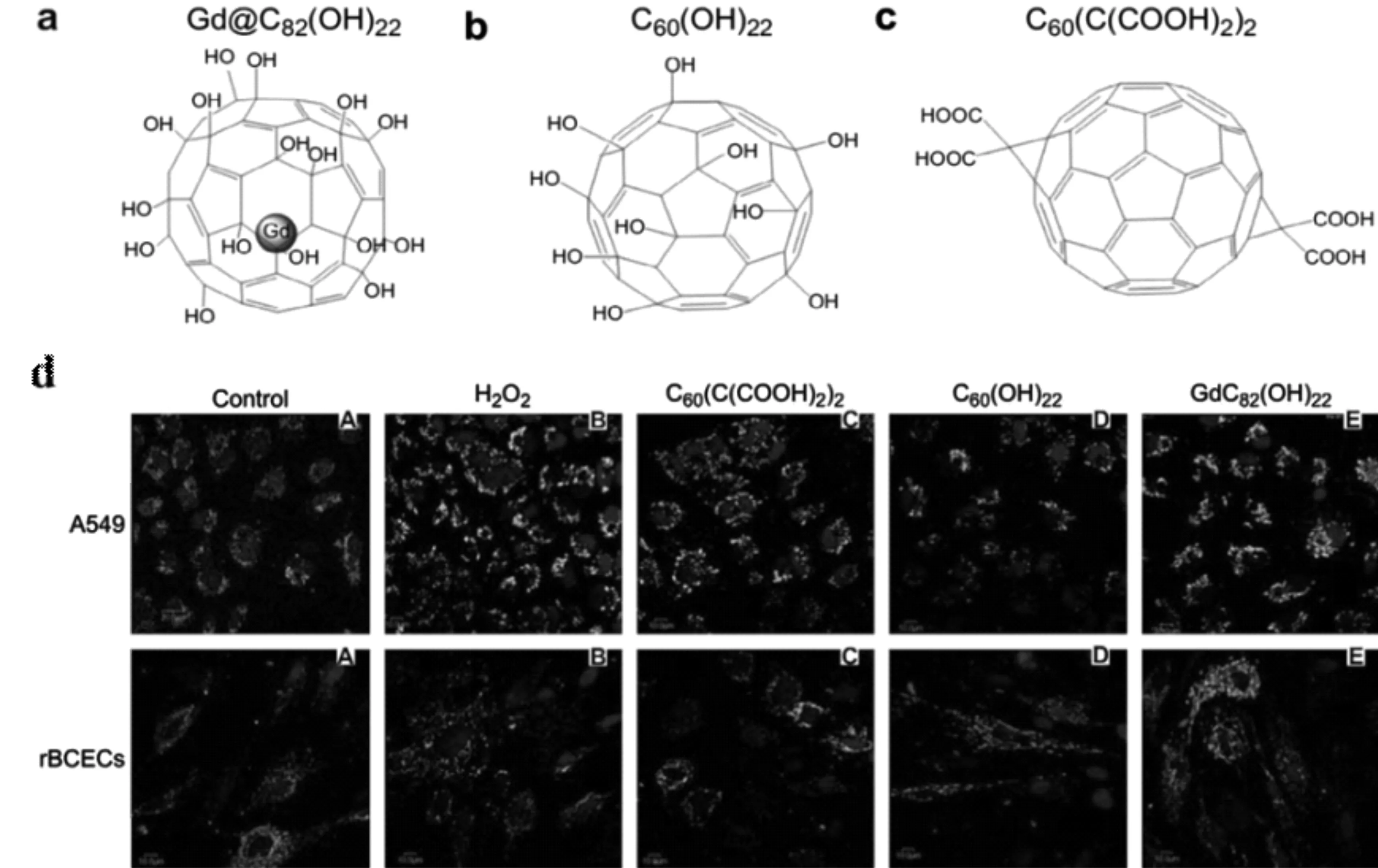
图7 3种富勒烯材料的结构
4 抗菌活性
富勒烯的抑菌活性早有研究,早在90年代,对富勒烯的抗菌活性评估结果表明,富勒烯有希望用于实现对于包括枯草芽孢杆菌、白色念珠菌和大肠杆菌等细菌的抑制作用[34,35]。对羧基富勒烯的研究表明,它可以作为抑菌剂用来抑制A群链球菌感染。对羧基富勒烯对酿脓链球菌感染的抗菌活性进行了评价。体外实验表明,该衍生物可以抑制酿脓链球菌的生长,对小鼠给药后可保护33%的小鼠幸免于感染死亡[36]。另一项工作中,Tsao等[37]研究了羧基富勒烯对二十种细菌菌株的抗菌活性。结果表明,该富勒烯衍生物对于革兰氏阳性细菌具有较强的抑制作用,而对于革兰氏阴性细菌并没有抑制作用。富勒烯的抗菌活性可能是由于细菌将富勒烯纳米颗粒内在化后,纳米颗粒抑制了细菌的能量代谢[38,39]。也有一部分研究者认为富勒烯是通过破坏细菌的呼吸链从而抑制细菌的生长[40,41]。起初,在富勒烯及其衍生物的浓度较低时,细菌的摄氧量减少,随后摄氧量增加,并伴随着过氧化氢产物的增加。另一种富勒烯抑菌作用的机理是富勒烯可以破坏细胞膜。富勒烯的疏水表面很容易与膜脂相互作用,并嵌入其中诱导细胞膜的破坏,进而实现抑菌作用[38,40,41]。
此外,PDT由于对抗生素的耐药性较低,是一种新兴的对多抗生素耐药细菌的有前途的治疗方法。富勒烯具有较高的PDT效率和优异的化学稳定性,已被提出作为细菌光动力灭活的有效光敏剂用于抗菌作用[30]。在激光照射下,水溶性良好的富勒烯衍生物对于革兰氏阳性细菌和革兰氏阴性细菌都具有抗菌活性[42]。为了克服富勒烯材料有限的水溶性和较强的聚集倾向,Zhang等[43]开发了一种基于富勒烯的肽调节的自组装杂合超分子水凝胶用于靶向和持续光动力抗菌疗法(图8)。水凝胶中富勒烯的聚集趋势通过肽和富勒烯之间的非共价相互作用而被大大抑制。因此,与未处理的富勒烯相比,肽-富勒烯水凝胶的PDT效率得到了极大的提高。富勒烯的掺杂也极大地改善了水凝胶的机械性能,使得这种杂合水凝胶称为更好的可注射制剂用于生物医学领域。体外和体内抗菌结果表明,肽-富勒烯水凝胶可有效抑制耐多种抗生素的金黄色酿脓葡萄球菌,并促进伤口愈合。
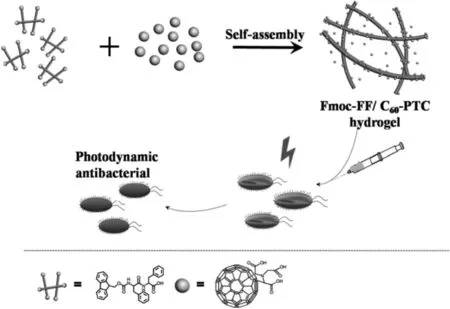
图8 基于富勒烯的超分子水凝胶抗菌应用示意图[43]
5 总结与展望
在过去的几十年中,富勒烯已经成为一种在不同健康相关领域都具有巨大应用价值的碳纳米材料。随着富勒烯材料更多应用领域的开发与拓展,对于富勒烯的需求也将大大增加。富勒烯具有的抗氧化活性、抗菌活性、光动力活性和细胞保护作用等多种生物学效应,使其在纳米生物医学领域发挥着重要作用。
本文综述了有关国内外研究学者对富勒烯在纳米生物医学领域中的应用研究。富勒烯在纳米生物医学领域应用中具有诸多优势,各种不同功能化的富勒烯被开发出来以提高其水溶性、生物相容性和赋予其靶向性等,但是富勒烯材料正式应用于临床依然面临着一些挑战。首先,这些研究工作集中在体外细胞以及体内动物水平的研究,这些临床前实验可能与人体中的作用机制存在一定的相似之处,但是人体毕竟不同于其他生物体,生物学行为与动物实验中收集的数据有所不同。再者,影响富勒烯材料临床转化最大的挑战之一就是对于富勒烯的毒性问题存在着争议[44]。已有研究工作指出,富勒烯在实验模型中具有良好的生物安全性,但要完全理解此类纳米材料的实际性能和功能还有很长的路要走[2]。虽然仍有许多问题需要克服,但富勒烯在纳米生物医学领域的应用无疑将拥有广阔前景。

