葡萄膜炎并发白内障患者晶状体前囊膜中NLRP3炎症小体相关蛋白的表达和前囊膜超微结构改变△
张楚 朱子诚 应充慧 展欣 刘夏薇
葡萄膜炎并发白内障是严重的眼科疾病,可引起视力障碍甚至致盲[1]。近年来研究发现,葡萄膜炎患者的前囊膜晶状体上皮细胞靠近前房,容易受到眼内炎症因子影响。晶状体上皮细胞是晶状体纤维与房水间的调解屏障,起到调节离子浓度和水分积聚的作用,因而其结构功能变化被认为是白内障发展的细胞基础[2]。由此推测,葡萄膜炎并发白内障患者晶状体上皮细胞可能存在结构改变。
NLRP3炎症小体是由Caspase-1前体与NLRP3通过接头蛋白ASC组成。Caspase-1前体自身活化后,促进炎症因子白细胞介素(interleukin,IL)-1β、IL-18释放,从而进一步加重炎症反应。研究发现,NLRP3炎症小体参与一些眼科疾病,如糖尿病性视网膜病变、年龄相关性白内障、葡萄膜炎等的发病过程[3-5]。本研究探讨葡萄膜炎并发白内障患者晶状体前囊膜中NLRP3 炎症小体相关蛋白的表达情况,以及前囊膜超微结构变化。
1 资料与方法
1.1 一般资料
1.1.1 研究对象以及分组随机选取2018年8月至2019年6月我院眼科住院部收治的葡萄膜炎并发白内障患者17例(22眼)作为试验组,老年性白内障患者10例(18眼)作为对照组。均于白内障超声乳化手术中环形撕囊获取前囊膜。纳入标准依据 2016 年中华医学会制定的《葡萄膜炎并发白内障患者的诊断与治疗标准》。排除葡萄膜炎继发青光眼、葡萄膜炎合并糖尿病、葡萄膜炎合并高度近视的患者;排除受糖尿病、器官损伤以及高血压影响或受年龄、工作性质、生活环境、病情严重程度、性别以及生活习惯等因素影响的患者。上述病例均无长期眼科用药史。在手术前所有葡萄膜炎患眼炎症反应安静期均大于3个月。本研究方案获得安徽医科大学附属省立医院伦理委员会批准,患者均签署知情同意书。
1.1.2 主要试剂与仪器兔抗人Caspase-1抗体(巴傲得生物科技有限公司),兔抗人NLRP3抗体、兔抗人ASC抗体(北京博奥森生物技术有限公司),免疫组织化学二抗通用型PV 6000、DAB显色试剂盒(北京中杉金桥生物科技有限公司),生物组织包埋机(湖北亚光公司),徕卡切片机(德国Leica公司),JEM1400型透射电子显微镜(上海铸金分析仪器有限公司)。
1.2 方法
1.2.1 免疫组织化学检测将晶状体前囊膜上皮细胞组织取下后立即用石蜡包埋机进行包埋,把包埋好的标本置于液氮预冷2 min,随后置于-80 ℃低温冰箱保存。将石蜡切片用二甲苯脱蜡后置于酒精和蒸馏水中浸泡水化,PBS液浸泡;抗原高压修复。切片浸入水中,倒入EDTA修复液后煮沸,随后修复约2 min后停止。冷却后滴加30 g·L-1H2O2,室温孵育20 min,PBS冲洗3遍,将切片甩干,加一抗,37 ℃孵育60 min,PBS冲3遍,甩干后加二抗孵育30 min,PBS冲3遍,DAB显色。并运用图像分析软件(Image ProPlusV6.0)对NLRP3、Caspase-1和接头蛋白ASC蛋白的表达进行光密度分析。
1.2.2 前囊膜超微结构观察将前囊膜放入戊二醛后于5 ℃冰箱保存24 h。使用PBS缓冲液漂洗后固定在10 g·L-1四氧化锇中,固定后再次漂洗,乙醇脱水、固定后包埋,取出包埋块修整后超薄切片,片厚70 nm,铜网捞片,铅、铀电子染色,于透射电镜下观察并摄片。
1.3 统计学分析采用SPSS 17.0软件对数据进行分析,本研究测量指标数据呈正态分布,均采用均数±标准差表示。试验组和对照组间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 两组患者晶状体前囊膜中NLRP3炎症小体相关蛋白的表达免疫组织化学检测显示,两组患者晶状体前囊膜中均有NLRP3炎症小体相关蛋白表达;试验组晶状体前囊膜中NLRP3、Caspase-1及接头蛋白ASC表达水平均明显高于对照组(均为P<0.05)。见图1至图3和表1。

图1 NLRP3在晶状体前囊膜中的表达 A:对照组;B:试验组。放大倍数:×200

图2 Caspase-1在晶状体前囊膜中的表达 A:对照组;B:试验组。放大倍数:×200
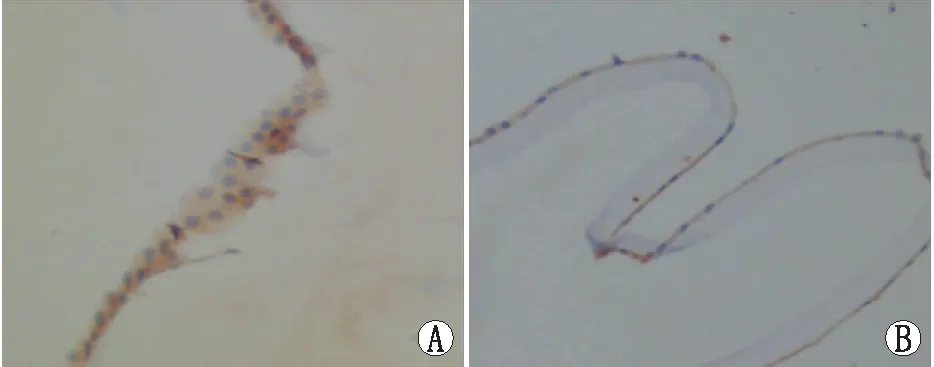
图3 接头蛋白ASC在晶状体前囊膜中的表达 A:对照组;B:试验组。放大倍数:×200

表1 两组患者晶状体前囊膜中NLRP3、Caspase-1、接头蛋白ASC表达的光密度值
2.2 两组患者前囊膜的超微结构情况试验组患者前囊膜的晶状体上皮细胞可见明显的细胞核固缩,染色质浓缩边集,细胞核膜皱褶、轻度增宽,线粒体形态基本正常、部分线粒体嵴突消失,细胞质中可见典型的凋亡小体。对照组有轻度凋亡改变。见图4。
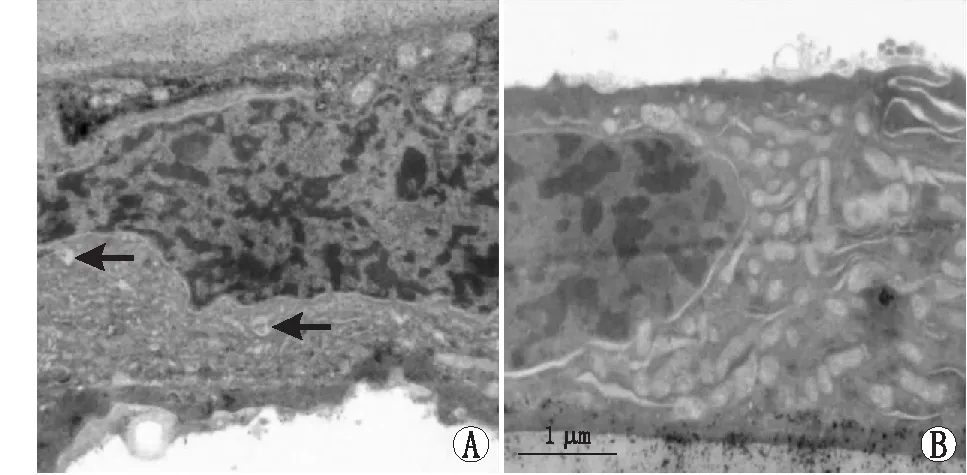
图4 电子显微镜下晶状体前囊膜超微结构 A:试验组患者前囊膜晶状体上皮细胞可见细胞凋亡改变,有典型的凋亡小体(箭头所示);B: 对照组患者前囊膜晶状体上皮细胞形态多数正常,有轻度凋亡改变
3 讨论
已有研究表明,晶状体上皮细胞异常是白内障进展的基础,使用H2O2产生氧化应激会促进上皮细胞凋亡导致白内障形成[6]。晶状体上皮细胞的氧化应激可以促使NLRP3介导的IL-1β激活,说明NLRP3炎症小体可能与白内障的进展存在一定关系[7-8]。本研究结果显示,两组患者晶状体前囊膜中均有NLRP3炎症小体相关蛋白的表达,说明NLRP3炎症小体亦可能参与老年性白内障的发展。
目前,人们对葡萄膜炎的发病机制仍不明确,普遍猜测其最常见原因为自身免疫反应。已经证实葡萄膜炎发病与多种细胞因子有关,包括IL-1、IL-6 、IL-8、IL-23等。其中IL-1β最常见和最主要的来源是NLRP3炎症小体。研究证实,NLRP3炎症小体与葡萄膜炎的发生有关[9]。IL-1β可以促进VEGF的产生,葡萄膜炎并发白内障患者的房水及血清中血管内皮生长因子的含量增多[10]。使用IL-1β调节抗体XOMA052可以有效治疗急性加重耐药型Behcet葡萄膜炎[11],IL-18与Behcet病的发生及疾病活动有关。在HLA-B27相关性葡萄膜炎患者的房水中,IL-18含量增高,且其与房水闪辉有关[12-13]。葡萄膜炎通过引起晶状体上皮细胞病理改变,促进并发性白内障的进一步发展。但NLRP3炎症小体相关蛋白在葡萄膜炎并发白内障患者的晶状体上皮细胞是否表达尚未见文献报道。本研究结果显示,试验组晶状体上皮细胞有NLRP3炎症小体相关蛋白的表达。说明NLRP3炎症小体与葡萄膜炎并发白内障的发病可能存在一定关系。
电镜观察可以了解细胞的超微结构改变,以往的电镜观察发现,晶状体上皮细胞的凋亡是白内障的发病机制之一[14-15],但关于葡萄膜炎并发白内障患者晶状体上皮细胞电镜观察研究较少。本研究结果显示,电镜下,试验组有明显的细胞凋亡变化,说明细胞凋亡是葡萄膜炎并发白内障患者前囊膜中重要的病理改变。在细胞凋亡改变明显的试验组,NLRP3炎症小体相关蛋白表达亦较高,表明细胞凋亡与NLRP3炎症小体可能存在一定的相关性。
细胞焦亡是一种快速的炎症反应性的细胞死亡,表现为早期细胞膜孔隙形成、细胞渗透性膨胀[16]。由于NLRP3在细胞焦亡与细胞凋亡中都起到重要作用[17],且细胞焦亡也可能是白内障发病的机制之一[18],因此NLRP3炎症小体通过细胞凋亡和细胞焦亡这两种途径来参与白内障的进展。以上研究显示,在NLRP3炎症小体相关蛋白明显表达的试验组,存在细胞焦亡改变。

