CD19-CART治疗复发难治性B细胞非霍奇金淋巴瘤的有效性及安全性
何鸣霞,来锦,翁益琴,马泳泳,林峰洋,邢冲云,江松福
(温州医科大学附属第一医院 血液内科,浙江 温州 325015)
B细胞非霍奇金淋巴瘤(B-cell non-Hodgkin’s lymphoma,B-NHL)是一类异质性明显的恶性肿瘤[1]。近年来,抗CD20单克隆抗体(利妥昔单抗)联合CHOP的化疗方案的应用显著提高了疗效,成为目前的一线治疗方案[2-5]。但始终有部分患者难免复发,并对现有的挽救治疗发生耐药,针对这部分患者的有效治疗手段仍然非常有限。对于初次复发后对化疗敏感的受试者再次化疗后中位生存期只有10个月[6]。嵌合抗原受体T细胞(chimeric antigen receptor T cells,CART)治疗是一种肿瘤特异性的T细胞疗法,通过基因工程改造T细胞使其能够识别并结合特异性肿瘤相关抗原,从而发挥靶向杀伤作用,达到抗肿瘤效应[7]。CD19作为B细胞重要的调节因子,其表达于B细胞几乎整个细胞生命周期,直至消失于终末浆细胞分化期,并在促进B细胞分化及维持生存过程中起重要作用。由于CD19在绝大多数B细胞和95%的B-NHL细胞中表达,且其表达仅局限于B细胞及卵泡DC细胞,避免了“脱靶”毒性的产生,使得其成为B-NHL治疗的潜在靶点之一[8-11]。本研究旨在观察在复发、难治性B-NHL患者中应用CART治疗的有效性及安全性。
1 资料和方法
1.1 一般资料 2017年4月至2018年10月间共10例复发性难治性B-NHL患者在温州医科大学附属第一医院接受CD19-CART细胞免疫治疗。所有患者肿瘤细胞均表达CD19。所有患者均签署知情同意书。该研究经由温州医科大学附属第一医院伦理委员会批准。所有患者在接受CART治疗前均接受过多次化疗,化疗疗程9.5(5.8,14.3)次,1例患者此前接受过自体造血干细胞移植。接受CART治疗前的疾病状态均为复发难治且未缓解[12],见表1。

表1 10例患者既往治疗过程
1.2 CART细胞制备及输注 CART细胞均由第三方制备,属于第2代CART细胞产品。CART细胞结构包括胞外区域、跨膜区域及胞内区域三部分,分别由抗CD19scFv、跨膜区和4-1BB或CD28/CD3ζ信号区。其中8例患者使用小鼠来源的嵌合抗原受体,2例患者采用人源化嵌合抗原受体。首先使用细胞单采机(COM.TEC,德国Fresenius公司)采集患者外周血淋巴细胞,制备过程均在符合GMP标准的实验室完成,具体过程包括质粒构建,质粒转化提取,慢病毒包被,磁珠分选CD3+T细胞,转染,CART细胞培养、检测、计数、回输。采集至回输的间隔时间为43(29~124)d,回输前2~5 d均给予FC(氟达拉滨25 mg/m2+环磷酰胺500 mg/m2)方案预处理,目的在于清除患者体内淋巴细胞以便输入CART细胞的增殖并减少高级别的细胞因子释放综合征(cytokine release syndrome,CRS)发生。
1.3 疗效及不良反应判定标准 采用2014版Lugano标准进行淋巴瘤疗效评估[12],分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD),7例患者采用普通CT作为评估手段,3例患者采用PET-CT评估疗效。不良反应主要关注CRS,根据LEE等[13]提出的修订的CRS分级系统进行分级,CRS等级每天至少评估1次,并且当患者的状态发生变化时随时进行评估。根据不良事件的常用术语标准(CTCAE)v4.0.3对神经病学和其他一般不良事件(adverse events,AEs)进行分级。
1.4 随访及检测 输注CART后中位随访9(1~24)个月,随访截至2019年6月15日。在CART输注期21 d内严密监测患者各项生命体征及实验室指标,常规1、3、7 d监测各项指标,4周内每周随访,6个月内每月随访,18个月内每3个月随访,18个月后可每6个月随访,目前最长随访期约为24个月。随访评估内容主要包括疗效、不良反应评估及CART拷贝数的监测。
1.5 统计学处理方法 采用SPSS23.0软件进行统计分析。计量资料符合正态分布以±s形式表示,不符合正态分布以M(P25,P75)表示;计数资料以数值或百分比表示;生存分析采用Kaplan-Meier法及Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者特征 10例接受CD19-CART细胞治疗的BNHL患者均为复发难治且处于未缓解状态。CART治疗前的化疗疗程为9.5(5.8,14.3)次,共1例患者接受过自体造血干细胞移植。男6例,女4例,年龄48.0(33.8,52.5)岁。原发疾病全部为B细胞恶性淋巴瘤,其中弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)8例,滤泡淋巴瘤(follicular lymphoma,FL)向DLBCL转化1例,FL 1例。疾病分期7例患者为IV期,1例为II期,2例为I期。IPI评分2例为高危,3例中高危,1例中低危,4例低危。输注CART细胞距离疾病初次确诊的时间为12.2(6.5,23.9)个月,9例患者为一次性输注,1例患者分2次输注,输注细胞总量为14.4(8.3,39.0)×107,单位体质量的细胞数为1.0(1.0,2.1)×106/kg。患者的一般情况及治疗特征见表2。
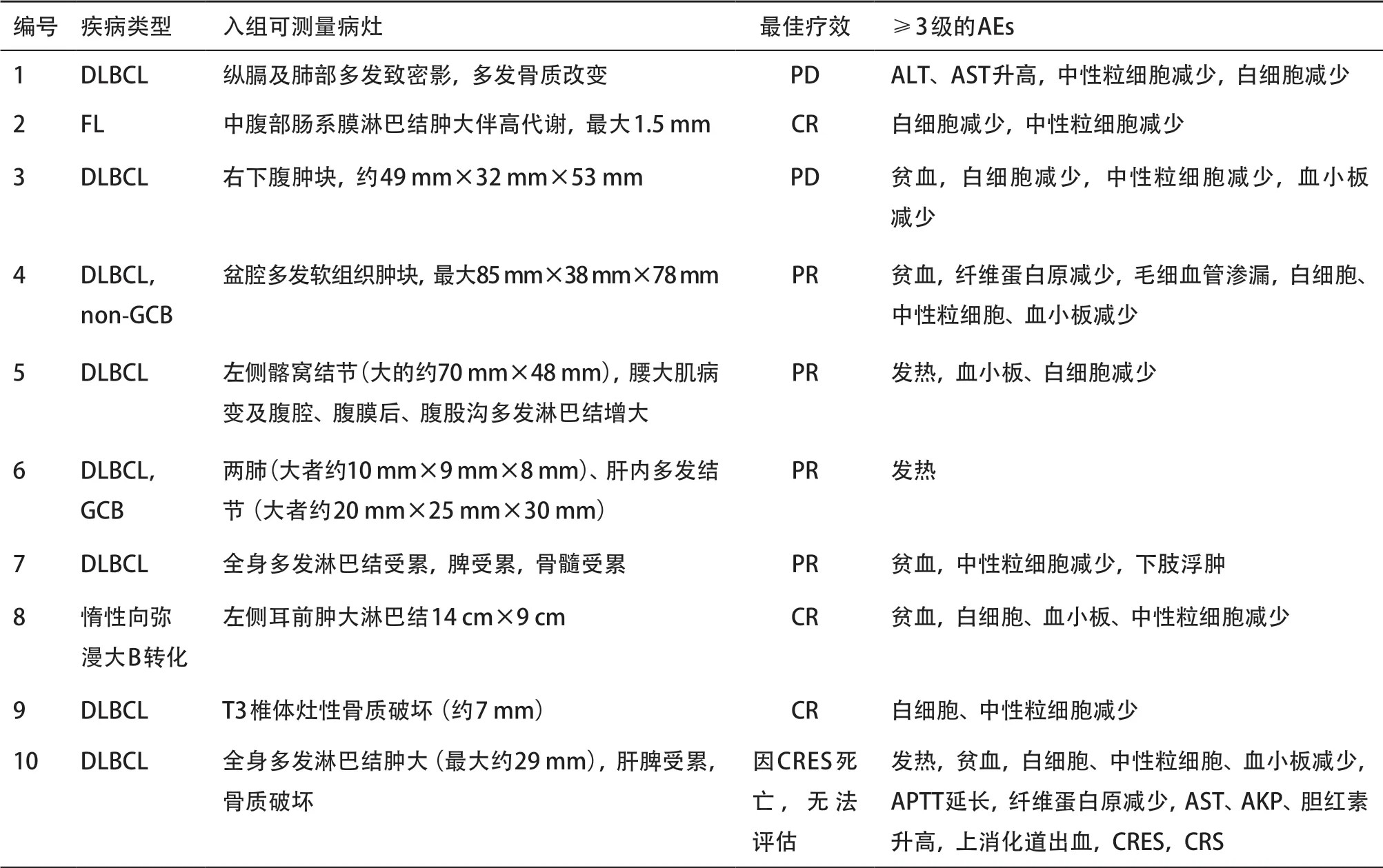
表2 患者的一般情况及治疗特征
2.2 CART疗效 10例患者输注CART细胞后,3例达CR,4例达到PR,总体有效率为70%。输注CART后,通过PCR的方法检测其在外周血中的扩增情况,全部患者外周血中均能检测到CART细胞增殖。CART细胞的中位峰值拷贝数约15.0×104(7.6×102,2.3×105)copies/μg,达峰时间为10.5(7.0,21.0)d。CART细胞增殖到达峰值后往往快速下降,大部分患者持续约3个月。通过流式细胞术检测CAR+细胞占CD3+细胞比例,CAR+细胞比例峰值为4.35%(0.91%,9.22%),扩增达峰时间为12.0(9.0,17.5)d,同PCR方法测得的CART扩增吻合。输注CART后中位随访9个月,随访截至2019年6月15日。其中最长随访时间约为24个月,此患者在CART输注后达持续的CR至今。其中6例患者在随访期内死亡,7例患者在不同时间点出现疾病进展。所有患者OS为(10.5±4.0)月,PFS为(4.6±3.9)月,生存曲线见图1A-B。采用Ann Arbor疾病分期分组进行生存分析发现,分期≥3期的患者较<3期的患者OS及PFS均更短,但差异无统计学意义,见图2A-B;不同IPI评分患者之间的预后差异无统计学意义,见图3A-B。其中1例患者在CART输注后6个月左右疾病进展,予以依布替尼及来那度胺协同CART无效,后予2次输注人源化CD19-CART细胞(来源于第一次输注前所制备细胞)疾病仍未能控制,予以使用Venatoclax(Bcl-2抑制剂)口服治疗,后死于疾病再次进展。另1例患者疾病进展后予以Venatoclax联合RICE方案多次化疗,后Venatoclax联合来那度胺维持治疗,目前存活。
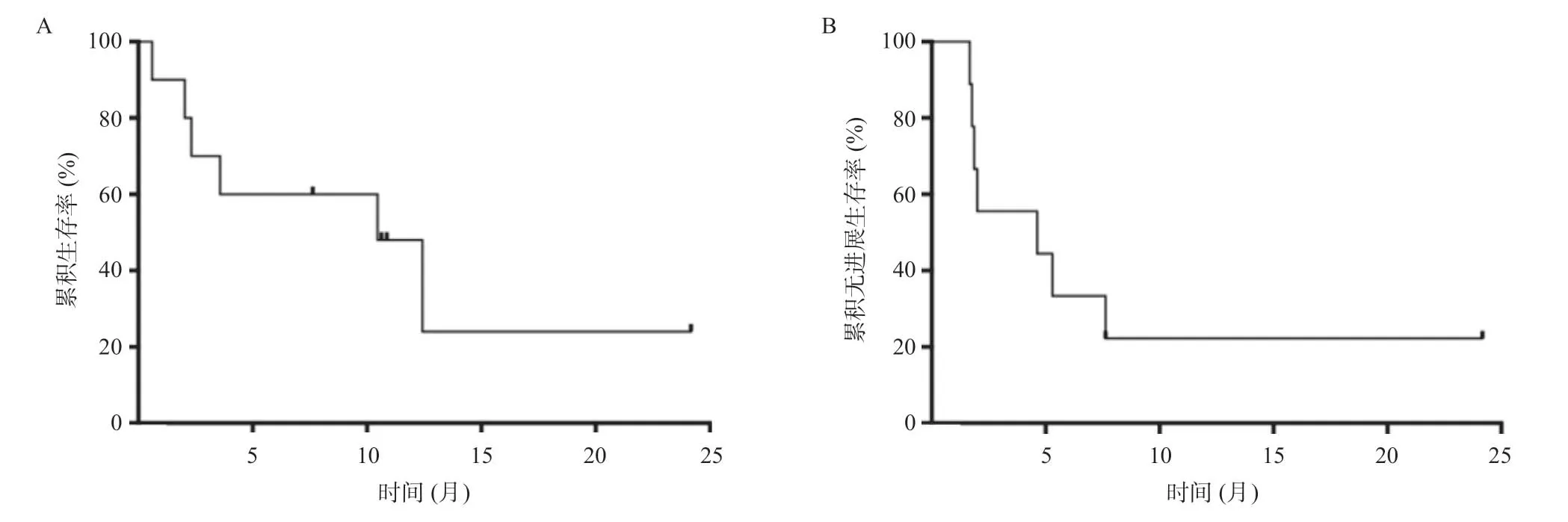
图1 全部患者生存分析
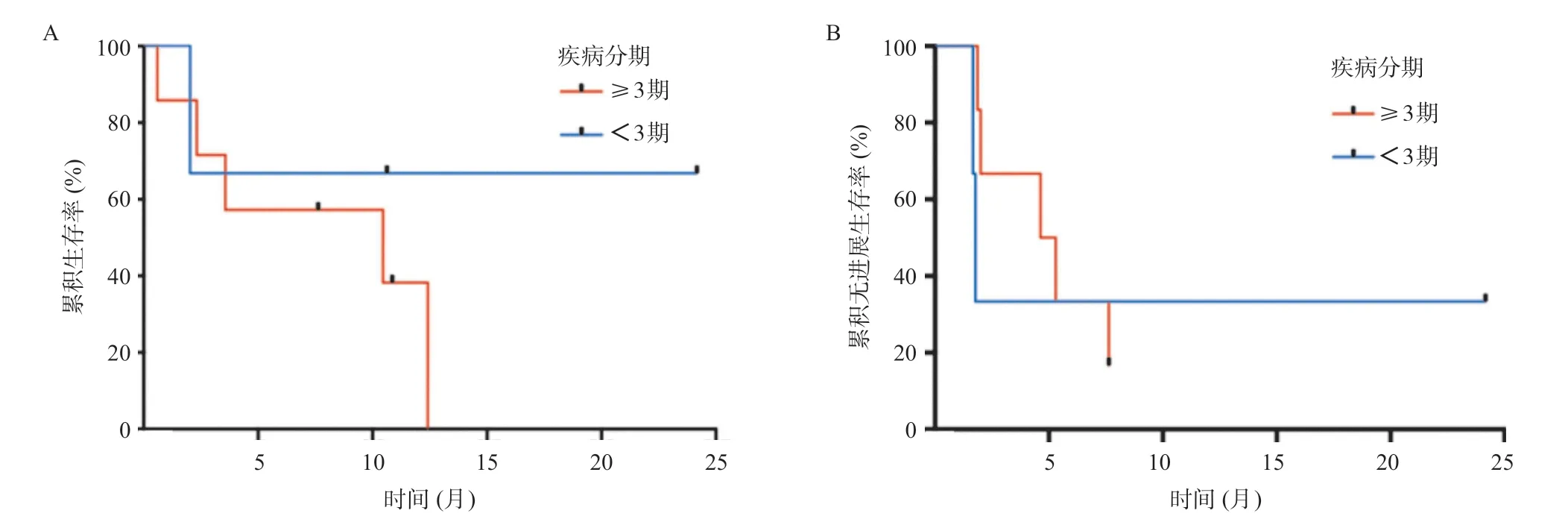
图2 不同疾病分期患者的生存分析

2.3 CART治疗相关的CRS反应及神经毒性 8例患者在CART输注后发生不同程度的CRS反应,其中7例为低级别CRS,5例为1级CRS,2例2级CRS,仅1例患者发生4级CRS。同时除发生4级CRS的患者合并有4级神经毒性外,其余患者均未出现脑病。共2例患者使用IL-6受体抑制剂托珠单抗,其中1例同时使用了糖皮质激素。发生4级CRS的患者在输注期第10天出现原发性腹膜炎,转氨酶升高,低纤维蛋白原血症,凝血功能障碍等,在使用IL-6抑制剂雅美罗240 mg/d,地塞米松20 mg q12治疗后CRS症状减轻;第17天突发意识障碍及癫痫发作,经神经内科联合会诊后考虑CRES 4级,经镇静、甘露醇降颅压、德巴金抗癫痫等对症支持治疗,后家属要求自动出院,于输注后第18天死亡。其余患者的CRS在严密监测及积极处理下均得到有效控制并快速缓解。所有患者出现体温大于38 ℃的时间为输注后5(0,11)d;体温峰值为38.9(38.0,40.4)℃,持续3(1,12)d左右。患者在CRS发生时检测到IL-6的快速升高,较基线升高4.0(1.0,31.5)倍,在CRS控制时快速回落。
3 讨论
B细胞淋巴瘤在经过传统的抗肿瘤治疗后往往难逃复发、难治的结局。单克隆抗体-利妥昔单抗的出现使得表达CD20的B细胞淋巴瘤的患者生存时间有了明显延长,然而仍然有相当部分患者最终因复发和难治而死亡[14]。靶向肿瘤细胞表面特异性抗原的CART疗法在免疫治疗中取得显著疗效,目前在全世界范围内开展的CART疗法的注册临床研究超过200项,主要集中在美国和中国。
2008 年,有研究指出经基因修饰的特异性靶向B淋巴细胞的自身T细胞可以安全治疗B细胞肿瘤[15]。2010年KOCHENDERFER等[16]应用二代CD19-CART细胞治疗1例复发难治FL患者,CART细胞体内持续时间达27周,最终达PR。后该团队又分别在2012[17]、2015[18]、2017年[19]分别报道了其成功治疗多种类型NHL的研究成果,均显示出一定的有效性。2014年第56届美国血液学会年会上,美国国家癌症研究所报告显示:利用反转录病毒转染的19~28zCART治疗B淋巴细胞肿瘤患者,27例可评估病例中有22例获得CR或PR,其中1例患者CR持续37个月[20]。CART的应用使B细胞淋巴瘤的生存率和治愈率均得到进一步提高,其中NEELAPU等[21]报道的成果中客观缓解率(objective remission rate,ORR)达82%,CR率达54%;同时15.4个月的中位随访期,40%的患者持续缓解。回顾已有的研究成果,多数临床研究ORR率为64%~82%,CR率43%~71%,维持缓解最久在38月以上[18-19,21-24]。本研究提示总缓解率达70%,CR率达30%,CR最长持续时间约24个月,且目前仍处于持续缓解及随访中。相较于其他团队,本研究中短期ORR率达国际平均水平,CR率稍低,长期缓解率方面,除1例患者外大部分患者疗效无法长时间维持,PFS及OS有待提高,可能与病例原发病侵袭性较强,分期更高,既往经历三线以上方案化疗患者占比高(达80%)相关,另由于病例数有限、随访时间短,尚未获得更全面及长期随访数据。以上提示CD19-CART疗法在复发难治CD19+B细胞淋巴瘤中初步出显示疗效,但较CD19-CART在急性淋巴细胞白血病中的缓解持续时间仍明显缩短[25],淋巴瘤本身的异质性、内部物理屏障及肿瘤的免疫微环境等可能是阻碍其持续缓解的因素。CART后的维持治疗可能有助于降低复发,例如联合来那度胺等免疫调节剂或PD-1等免疫检查点抑制剂。
CRS和神经毒性是CART细胞治疗常见的不良反应之一,其他常见不良反应包括中性粒细胞减少、贫血、血小板减少等。CRS通常认为是由于T细胞的扩增激活其他免疫细胞(如巨噬细胞、单核细胞等)导致的一种非抗原特异性毒性,与包括IL-6和IFN-γ等在内的细胞因子循环水平的升高相关[13,26-27]。CRS通常表现为全身症状,如发热、低血压、低氧血症,但可影响体内任何器官系统,包括心血管、呼吸系统、皮肤、胃肠、肝、肾、血液和神经系统,表现为器官功能障碍。严重的可出现凝血功能障碍、毛细血管渗漏及巨噬细胞活化综合征/嗜血细胞综合征,甚至可能危及生命。IL-6受体抑制剂托珠单抗和糖皮质激素可用于控制CRS[27-29]。本研究提示CRS发生率占全部患者的80%,其中1~2级发生率为70%,3~5级发生率为10%。其中1例CRS 4级患者在使用托珠单抗及糖皮质激素治疗后仍出现4级神经毒性,考虑可能与IL-6受体抑制剂使用后中枢IL-6浓度升高相关[30]。2017年SCHUSTER等[24]报道CTL019治疗复发难治性NHL研究,其中1/5的患者发生严重CRS,约1/3患者发生短暂脑病,11%的患者发生严重脑病。而我们的高级别CRS及脑病发生率明显较低,提示严密的监测及积极的管理包括积极使用IL-6拮抗剂有助于控制相关不良反应,防止高级别CRS的发生。
综上,CD19-CART在复发难治性B-NHL中显示出初步疗效,其可作为复发难治患者的挽救治疗,不良反应较小,经严密监测及积极管理不良反应可逆且可控,但长期疗效有待随访观察。

