脂肪抑制T2WI影像组学模型在子宫肌瘤和子宫腺肌瘤中的鉴别价值
陈程,叶苗苗,陈博,朱雪琼
(温州医科大学附属第二医院,浙江 温州 325027,1.妇产科;2.放射影像科)
子宫肌瘤和子宫腺肌瘤在临床表现方面存在较多相似之处,常发生误诊或漏诊。两者治疗方案不尽相同,子宫肌瘤易于手术剥除[1-2],而子宫腺肌瘤手术时难以完整剥除[3]。目前,彩色多普勒超声检查被广泛用于子宫腺肌瘤的诊断,其能探测到子宫肌层内的异常回声团,但有时较难与子宫肌瘤鉴别[4]。影像组学(radiomics)最早于2012年由LAMBIN等[5]提出,是指通过计算机软件从医学影像中高通量地提取海量影像信息,对其进行深层次的挖掘、预测和分析,将疾病的视觉影像信息转化为深层次的可量化的影像纹理特征,以辅助医师做出准确的诊断。影像组学基本步骤包括图像获取、病灶识别、病灶图像分割、特征提取及筛选、预测模型的建立及相关临床信息的分析[6]。由于MRI对于软组织分辨率高,在鉴别子宫肌瘤和子宫腺肌瘤方面具有较大的优势[7]。本研究旨在通过影像组学的方法探讨脂肪抑制T2WI在术前子宫肌瘤与子宫腺肌瘤鉴别诊断中的价值。
1 对象和方法
1.1 对象 回顾性分析2015年4月至2019年9月温州医科大学附属第二医院临床诊断为子宫肌瘤或子宫腺肌瘤的120例妇科手术患者,其中子宫肌瘤63例,子宫腺肌瘤57例。纳入标准:①经术后常规病理检查确诊为子宫肌瘤或子宫腺肌瘤;②术前使用同一种磁共振扫描仪行盆腔磁共振平扫检查。排除标准:①临床和影像学资料不完整;②术后常规病理提示同时存在子宫肌瘤和子宫腺肌瘤;③术前盆腔磁共振图像伪影严重影响分析。参考影像组学相关研究[8]以7:3的分配比例随机将120例研究对象分成训练组84例和验证组36例。其中训练组用于预测模型的建立,验证组用于预测模型的优化与验证。
1.2 MRI检查方法 采用美国GE公司Discovery MR7503.0T超导型磁共振扫描仪进行检查。所有患者排除磁共振检查禁忌后,取仰卧位,采用体部相控阵线圈,线圈中心置于耻骨联合,下腹部用海绵垫压迫减轻呼吸运动伪影,扫描范围覆盖整个盆腔。常规扫描序列:轴位T1快速自旋回波(fast spin echo,FSE)、轴位脂肪抑制T2快速恢复快速自旋回波(fast recovery-fast spin echo,FR-FSE)、冠状位T2FSE、矢状位脂肪抑制T2FSE。多b值DWI采用自旋回波-回波平面成像(spin echo-echo plane imaging,SE-EPI)序列。
1.3 影像学分析
1.3.1 图像分割:运用ITK-SNAP软件(Version 3.4.0,http://www.itksnap.org/)在脂肪抑制T2WI图像上勾画感兴趣区(region of interest,ROI)。由1名高年资放射科医师通过ITK-SNAP软件在脂肪抑制T2WI图像上逐层勾画靶病灶(最大病灶)边缘,并融合成三维ROI,同时由另1名高年资放射科医师进行修改核对,见图1。
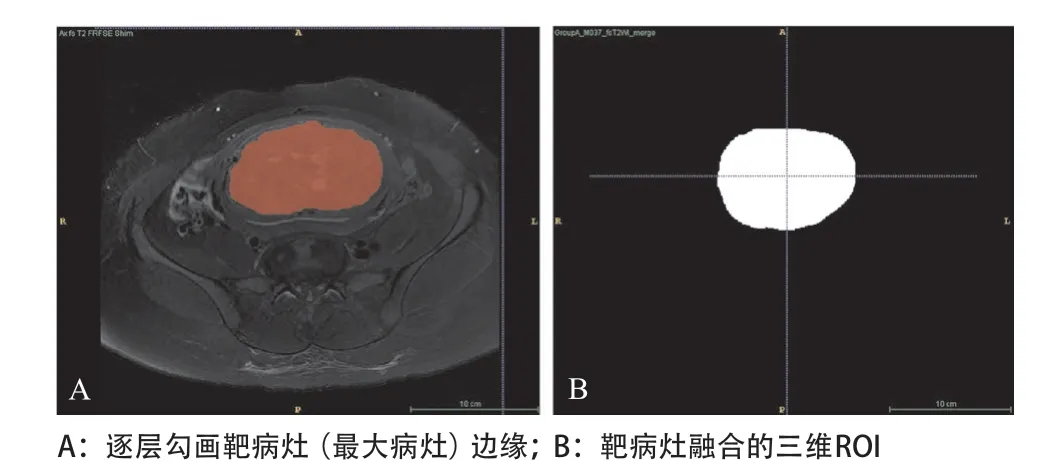
图1 在脂肪抑制T2WI图像上分割子宫靶病灶并生成融合图像(手动分割法)
1.3.2 MRI影像组学特征提取及降维:①特征提取:应用美国GE公司AI-Kit(Artificial Intelligence Kit,Version:3.0.1.A)软件对120例研究对象手术前的盆腔MRI脂肪抑制T2WI图像进行影像组学特征提取。纹理参数包括4大类特征共396个定量参数,分别为一阶直方图特征、纹理特征、灰度共生矩阵(gray-level co-occurrence matrix,GLCM)和灰度步长矩阵(gray-level run-length matrix,GLRLM)特征。②特征降维:采用最大相关-最小冗余(maxrelevance and min-redundancy,mRMR)和最小绝对收缩算子特征选择法(least absolute shrinkage and selection operator,LASSO)[9]对提取的影像组学特征进行降维,以降低预测模型的复杂程度,且LASSO回归选择十折交叉验证。
1.3.3 数据标准化处理:用Excel进行Z-score标准化,先求出所有参数的算数平均值xi和标准差si;再进行标准化处理,zij=(xij-xi)/si,其中zij为标准化后的参数值,xij为实际参数值;最后将逆指标前的正负号对调。
1.4 统计学处理方法 采用R(Version:3.4.4,https://www.r-project.org/)软件进行统计学分析。正态分布的计量资料用±s表示,2组间比较用t检验;非正态分布用M(P25,P75)表示,2组间比较用秩和检验;将筛选获得的影像组学特征通过logistic回归得到各自的回归系数,建立预测模型,并对回归方程做拟合优度检验。每例研究对象的影像组学评分(Rad-score)通过mRMR和LASSO选取的特征与其logistic回归系数的线性组合来计算[10]。用Delong检验比较2组接受者操作特性曲线下面积(area under the receiver-operating characteristic curve,AUC),AUC的值越接近于1,该模型的预测效能越高。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 120例手术患者中术后常规病理诊断为子宫肌瘤患者63例,年龄22~67(49±8)岁,肿瘤直径为3.7(2.4,5.6)cm;术后常规病理诊断为子宫腺肌瘤的患者57例,年龄25~71(45±8岁),肿瘤直径为5.6(4.6,7.2)cm。
2.2 影像组学分析 在脂肪抑制T2WI图像上勾画的ROI区域中,共提取出396个特征参数,其中394个特征具有较好的可重复性。首先进行mRMR以消除冗余和无关的特征,保留了20个特征;然后通过LASSO回归筛选并纳入6个纹理参数构建鉴别子宫肌瘤和子宫腺肌瘤的预测模型,见图2和3。其中包括了1个纹理特征、2个GLCM特征和3个GLRLM特征。该预测模型的Rad-score=-2.1366+(2.6501×10-8×特征1)-(4.1243×10-8×特征2)+(4.3418×10-8×特征3)+(6.2868×10-4×特征4)+(1.1305×10-2×特征5)-(4.4976×10-7×特征6),见表1。子宫腺肌瘤Rad-score值的均数为-0.633,95%CI(-0.834~-0.431),子宫肌瘤Rad-score值的均数为1.330,95%CI(0.857~1.802),2组Rad-score值的差异有统计学意义(Z=-7.102,P<0.001)。Hosmer-Lemeshow拟合优度检验显示,训练组和验证组间的预测值和观察值差异均无统计学意义(P=0.148、0.472),表明无拟合偏离,数据与模型配合较好。
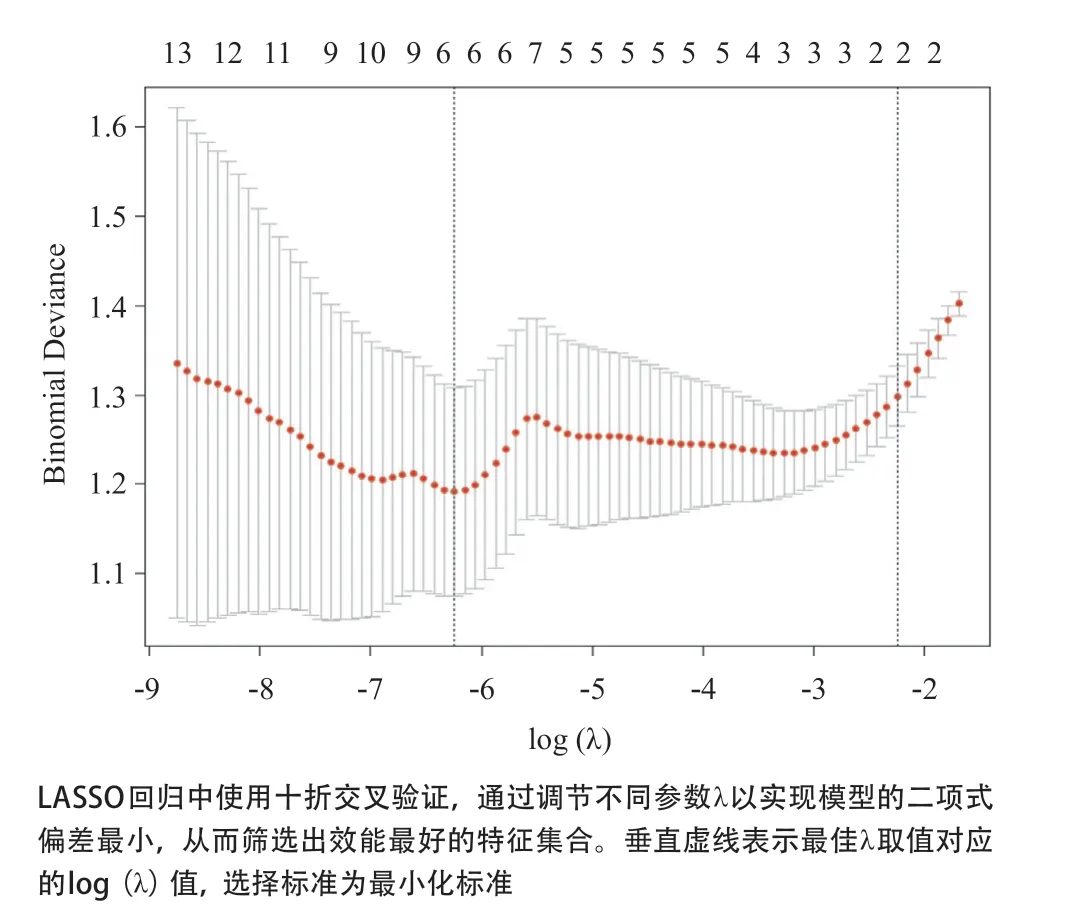
图2 LASSO模型中调节参数(λ)的选择图
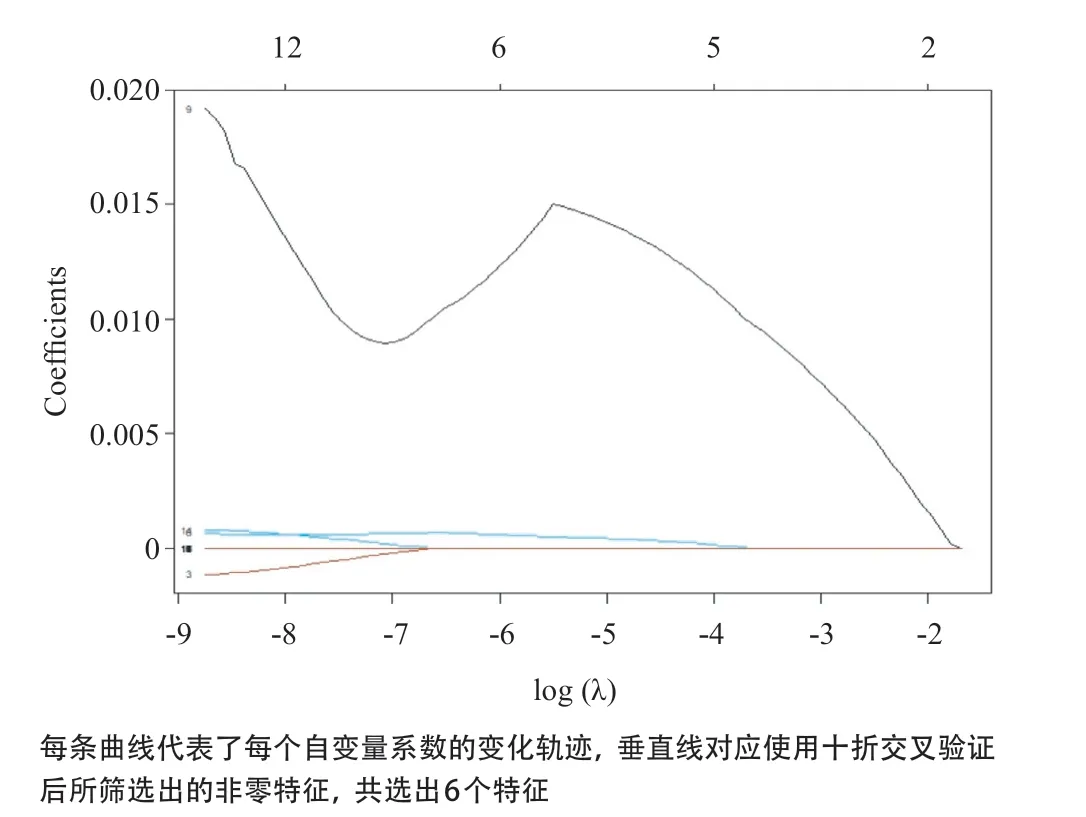
图3 LASSO回归模型中使用十折交叉验证筛选特征的特征系数收敛图
2.3 预测模型评价 训练组中影像组学特征构建的预测模型对鉴别子宫肌瘤和子宫腺肌瘤的AUC值为0.861,敏感度为84.1%(37/44),特异度为82.5%(33/40),模型准确率为83.3%(70/84),模型预测结果的ROC曲线见图4。验证组中鉴别子宫肌瘤和子宫腺肌瘤的AUC值为0.913,敏感度为84.2%(16/19),特异度为94.1%(16/17),模型准确率为88.9%(32/36),2组ROC曲线差异无统计学意义(D=-0.836,P=0.405),见图5。
3 讨论
子宫肌瘤和子宫腺肌瘤是育龄期女性常见的妇科疾病,2者的临床表现相似,均会造成经量增多、经期延长等症状,甚至导致患者习惯性流产、不孕[11-12],严重影响患者的身心健康及生活质量。子宫腺肌瘤区别于子宫肌瘤的最主要临床表现是继发性痛经并进行性加重[13]。目前,彩色多普勒超声检查是子宫肌瘤和子宫腺肌瘤常用的诊断手段,但子宫肌瘤和子宫腺肌瘤在声像图上存在相似之处,特别是不典型子宫肌瘤和局限性子宫腺肌瘤的鉴别诊断,容易误诊及漏诊[14]。由于子宫肌瘤和子宫腺肌瘤的治疗原则及治疗方式不同,因此较准确地鉴别子宫肌瘤和子宫腺肌瘤对于患者尤为重要[15]。

表1 基于脂肪抑制T2WI图像最小误差对应的6个纹理参数
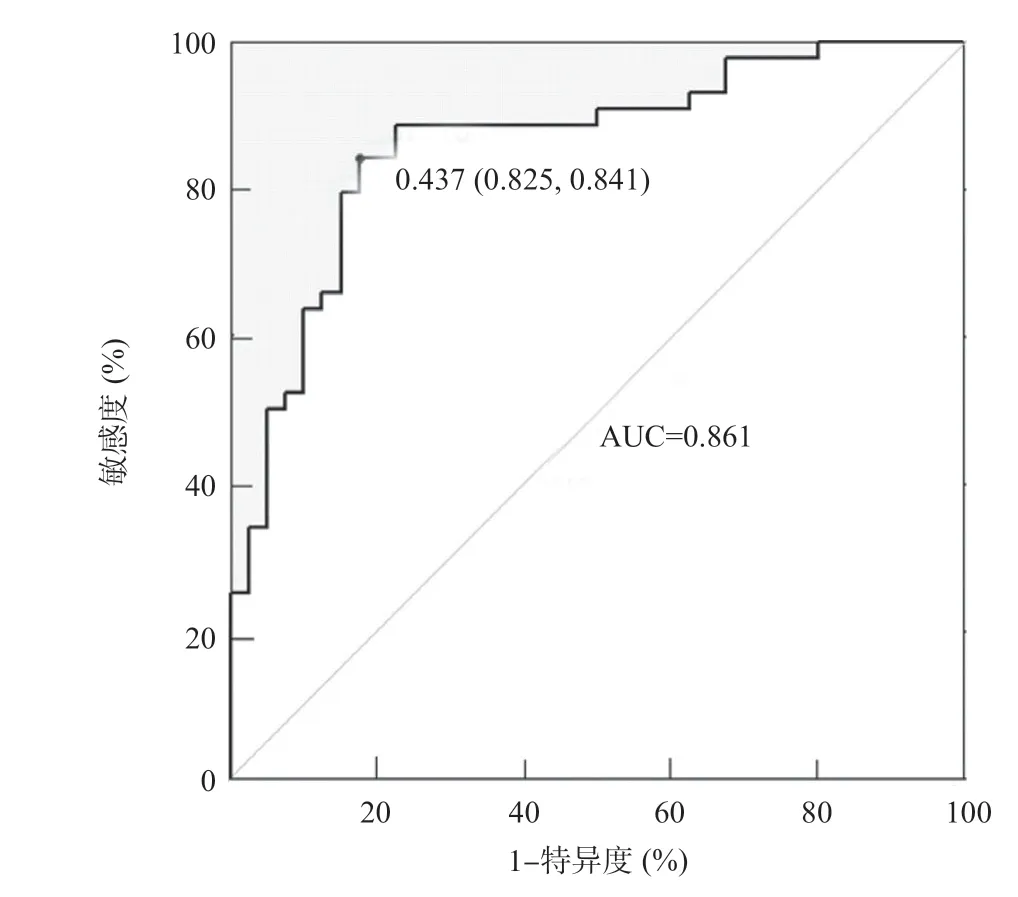
图4 基于脂肪抑制T2WI图像纹理特征预测模型在训练组中的ROC曲线

图5 基于脂肪抑制T2WI图像纹理特征预测模型在验证组中的ROC曲线
影像组学技术来源于计算机辅助诊断(computer aided diagnosis,CAD),目前已经发展成为融合影像、基因、临床等信息的辅助诊断、分析和预测的方法[16]。本研究以磁共振脂肪抑制T2WI图像的影像组学特征为基础,以术后常规病理结果为金标准,建立鉴别子宫肌瘤和子宫腺肌瘤的影像组学预测模型。
子宫肌瘤为平滑肌组织,故脂肪抑制T2WI呈低信号,肌瘤发生变性时信号增高;子宫腺肌瘤为子宫内膜组织,由于内膜组织周期性出血,陈旧性出血脂肪抑制T2WI呈低信号,亚急性出血呈高信号。因此,部分子宫肌瘤与子宫腺肌瘤依靠视觉影像鉴别存在困难。近年来,磁共振成像在鉴别子宫肌瘤和子宫腺肌病方面的优势逐渐显现[17]。JHA等[18]通过分析50例子宫肌瘤和43例子宫腺肌病患者的DWI图像发现表观扩散系数(apparent diffusion coefficient,ADC)在正常子宫肌层、子宫肌瘤和子宫腺肌病之间存在明显差异;研究者选取了其中的20例子宫肌瘤和20例子宫腺肌病患者,通过ROI法测量ADC值,发现与子宫腺肌病相比,子宫肌瘤具有更高的组织异质性。另一项研究对17例子宫肌瘤和22例子宫腺肌病患者展开研究,通过比较DWI图像的ADC值及ADC-D值(定义为高信号密集灶的ADC值与病变组织的ADC值的差值)来鉴别子宫肌瘤和子宫腺肌病,结果发现DWI成像上的ADC值有利于子宫肌瘤和子宫腺肌病的鉴别诊断,但是ADC-D值的鉴别能力较ADC值高;相较于子宫肌瘤而言,子宫腺肌病的ADC-D值较低[19]。
本研究首次提出基于脂肪抑制T2WI图像建立鉴别子宫肌瘤和子宫腺肌瘤的影像组学预测模型,发现子宫肌瘤的Rad-score值大于子宫腺肌瘤,且诊断准确率为83.3%(训练组)、88.9%(验证组)。虽然目前大多采用彩色多普勒超声检查鉴别子宫肌瘤和子宫腺肌瘤,但其鉴别诊断水平受制于影像科医师的工作经验,而影像组学预测模型则是对海量影像数据信息进行深层次的挖掘、预测和分析来辅助医师做出准确的诊断,具有客观性。我们相信通过更大样本的影像数据和诊断数据,不断进行深度机器学习训练,特别是融入临床资料构建临床影像组学模型,能够进一步提高该预测模型的诊断准确率。
通过构建影像组学预测模型,提供量化的子宫肌瘤和子宫腺肌瘤的鉴别诊断标准,是一种更加优越、无创、客观地鉴别子宫肌瘤和子宫腺肌瘤的工具。该预测模型在临床工作中的应用,可为临床医师制定治疗方案提供可靠的诊断依据。此外,将成熟的临床影像组学模型开发为人工智能(artificial intelligence,AI)诊断软件可以帮助影像医师削减读片时间,提升工作效率。

