宫腔镜电切术联合左炔诺孕酮宫内缓释系统治疗子宫内膜息肉疗效观察
李巧婵,庞土寿,柯秋霞
吴川市妇幼保健计划生育服务中心妇产科,广东 湛江 524500
子宫内膜息肉(endometrial polyps,EP)属于临床常见的子宫内膜病变,表现为子宫内膜表面突出的良性结节,其构成部分为子宫内膜腺体和子宫内膜间质(含厚壁血管且已经纤维化)[1]。EP 以30~60 岁的女性常见,其发病率较高,在我国综合报道其发病率为5.7%~25%[2]。EP最主要的临床症状为异常子宫出血以及腹痛、不孕等,对患者的生活质量及身体健康均造成了严重影响。宫腔镜是EP诊断的“金标准”,且宫腔镜电切术治疗EP 具有创伤小的优点。不过随着治疗病例数的增多及临床资料的积累,临床发现患者术后具有较高的复发率,甚至复发率高达10%。根据EP的发病机制,术后指导患者使用孕激素可以提高疗效且避免复发[3]。左炔诺孕酮宫内缓释系统(LNG-IUS)作为一种新型宫内节育系统,其最大的优势在于能够将孕激素在局部高效、缓慢的释放[4]。本研究探讨了宫腔镜电切术基础上联合应用LNG-IUS 对子宫内膜息肉的治疗作用。
1 资料与方法
1.1 一般资料 选择2016年1月至2017年12月期间吴川市妇幼保健计划生育服务中心收治的90 例子宫内膜息肉患者为研究对象。纳入标准:①已婚已育女性,且无再次生育要求;②超声及宫腔镜检查均符合EP 的诊断,术后经病理学检查证实诊断;③EP可以单发也可以为多发;④无宫腔镜手术禁忌,且无孕激素应用禁忌。排除标准:①合并恶性肿瘤、子宫脱垂、肝肾功能不全、盆腔感染者;②近3 个月内曾接受内分泌治疗者;③无法完成随访者。本研究经医院医学伦理委员会批准,患者均知情并签署同意书。根据随机数表法将患者分为观察组(宫腔镜+LNG-IUS,4例5)和对照组(宫腔镜,45 例)。其中观察组患者年龄31~49 岁,平均(37.69±3.27)岁;息肉单发、多发分别为30 例、15例;直径最大5~13 mm,平均(7.28±1.46) mm。对照组患者年龄32~48 岁,平均(38.42±4.05)岁;息肉单发、多发分别为34 例、11 例;直径最大5~14 mm,平均(7.37±2.15)mm。两组患者的临床资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 手术方法 两组患者均在完善相关检查、排除手术禁忌后接受宫腔镜电切术治疗,手术时间为月经干净后3 d~1周。术前将患者阴道冲洗干净,并在术前1 d 将米索前列醇0.4 mg 放置于阴道后穹窿位置。静脉麻醉,膨宫介质为生理盐水,用10#扩宫棒扩张宫颈口后行宫腔镜宫腔检查,观察息肉位置、大小、数量、形态,确认后实行电切术及诊刮术。宫腔压力范围、电切功率分别为80~100 mmHg(1 mmHg=0.133 kPa)、70~80 W。术后均预防性应用抗生素。观察组患者术后月经来潮的第3~5 天由专业人员放置LNG-IUS,操作步骤严格按照指南进行,放置完毕后采用腹部超声检查以确认其放置位置。
1.3 观察指标 术后对两组患者进行定期随访,分别于术后6 个月、12 个月、24 个月测定并记录患者月经量、血红蛋白水平及子宫内膜厚度。其中月经失血量采用月经失血图(PBAC)评分法[5]进行评估;血红蛋白则抽血测定血常规;子宫内膜厚度在月经周期第15~16 天行阴道超声检查,对子宫内膜厚度的厚度进行测定,并观察子宫内膜息肉术后复发情况。
1.4 统计学方法 应用SPSS17.0 统计软件进行数据分析,计量数据以均数±标准差(±s)表示,组间均数比较采用t 检验,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后PBAC 评分比较 90 例患者均顺利完成为期24 个月的随访。两组患者在术后6个月、12 个月、24 个月时,PBAC 评分均明显低于术前,且观察组均明显低于对照组,差异均有统计学意义(P<0.05),见表1。
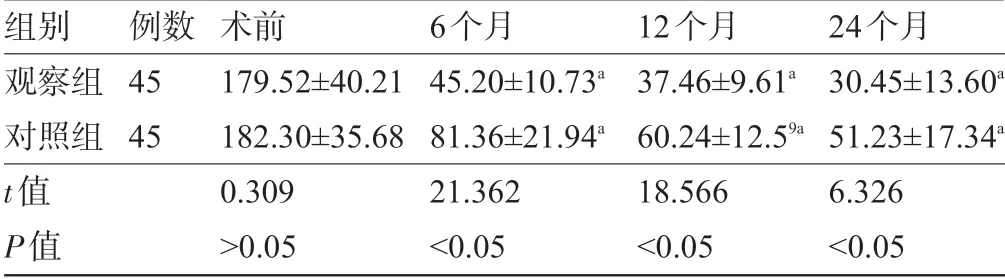
表1 两组患者术后PBAC评分比较(x-±s,分)
2.2 两组患者术后血红蛋白水平比较 两组患者术后6 个月、12 个月、24 个月时血红蛋白水平明显高于术前,且观察组明显高于对照组,差异均有统计学意义(P<0.05),见表2。

表2 两组患者术后血红蛋白水平比较(x-±s,g/L)
2.3 两组患者术后子宫内膜厚度比较 两组患者术后6 个月、12 个月、24 个月时子宫内膜厚度明显低于术前,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表3。
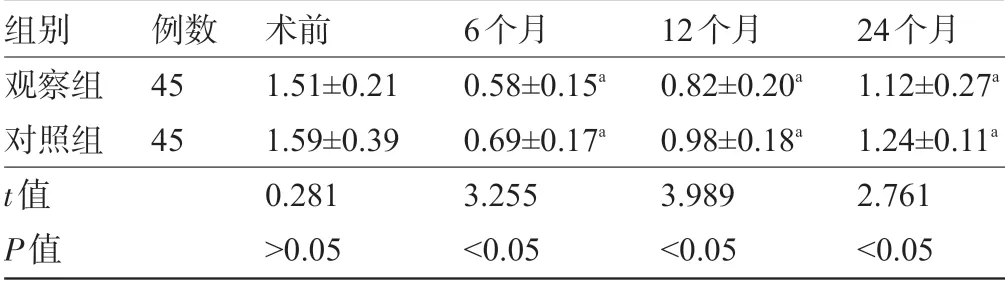
表3 两组患者术后子宫内膜厚度比较(x-±s,cm)
2.4 两组患者术后子宫内膜息肉复发及不良反应比较 观察组患者随访中出现复发病例3 例,复发率为6.67%,对照组出现7 例复发,复发率为15.56%,观察组患者的复发率明显低于对照组,差异有统计学意义(χ2=3.992,P<0.05)。两组患者治疗期间均无严重不良反应发生,观察组患者有4例出现闭经。
3 讨论
子宫内膜息肉最常见于35岁以上的女性人群,高峰发病年龄为50岁,该病是一种以子宫异常出血为主要症状的宫腔内病变[6]。子宫内膜息肉常见症状为子宫异常出血,部分患者会有腹痛、不孕等表现,但是本病属于良性病变,极少会发生癌变,尤其是生育年龄的EP患者恶变率更低,这一比例仅仅为0.5%~1.0%[7-8];围绝经期和绝经期患者中EP的恶变率会出现增加的趋势,因而临床上需要积极的应对。子宫内膜息肉的发病原因及机制目前尚未完全阐明,有研究指出子宫内膜息肉患者出现孕激素受体表达水平下降及雌激素受体表达增高,因而激素水平的失调可能是子宫内膜息肉发生的关键因素。目前公认的是该病是一种良性病变,最主要的原因在于子宫内膜炎症以及持续的雌激素作用,子宫内膜不能及时剥脱而出现增生过度,形成向宫腔内突出的良性结节。临床上针对子宫内膜息肉尚不能应用药物进行有效的预防和治疗,而随着宫腔镜技术的发展进步,宫腔镜电切术已经成为EP治疗的最常用方法。使用宫腔镜对EP 进行治疗可以将局部组织予以放大,视野变得更为清晰,进而准确的切除病变,并且有效破坏息肉的基底部,降低术后的复发率;另一方面,宫腔镜电切除术送入器械的通道为阴道宫颈自然腔道,无需另行做切口,也减少了患者的痛苦[9-10]。因而,宫腔镜电切术治疗EP 具有创伤小、出血少、术后恢复快及术后复发率低的优势。宫腔镜电切术治疗EP虽然效果良好,但是也无法避免EP 的复发,主要原因仍然是雌激素水平过高,且患者缺乏孕激素转化,进而引起子宫内膜增生过度。如何有效降低宫腔镜电切术后EP 的复发仍然是临床上研究的重要问题[11]。
研究显示,对EP 患者补充孕激素治疗是降低EP复发最有效的措施,长期口服孕激素不可避免的会引起一系列的不良反应,使其广泛应用受到限制[12]。左炔诺孕酮宫内缓释系统是近年来在临床上获得应用的一种新型宫内节育器,不仅可以发挥较好的宫内避孕作用,重要的是能在宫腔内释放左炔诺孕酮。这种释放作用是持续低剂量进行的,且可以直接将激素释放到靶器官子宫内膜处,在局部形成较高的药物浓度,直接发挥作用[13-14]。本研究结果显示,宫腔镜电切术治疗基础上联合应用LNG-IUS的观察组,与对照组比较,其在术后6 个月、12 个月、24 个月时PBAC 评分降低更加明显,差异均有统计学意义(P<0.05)。同时,血红蛋白水平改善程度及子宫内膜厚度在观察组均明显优于对照组,差异均有统计学意义(P<0.05)。随访期间发现,观察组患者复发率也明显低于对照组,差异有统计学意义(P<0.05)。说明在宫腔镜电切术治疗术后联合使用LNG-IUS,由于在局部存在持续释放的孕激素,可以有效的抑制子宫内膜的增生,减少月经量和子宫内膜厚度,也有效降低了EP的复发率。
本研究对两组患者均进行了长达两年的随访,主要观察使用LNG-IUS 治疗的观察组患者的不良反应。虽然LNG-IUS释放的左炔诺孕酮剂量极低,仅有微量可以进入血循环,因而全身药物不良反应并不明显,且不对患者的卵巢功能造成影响。但是由于持续释放的左炔诺孕酮对子宫内膜产生持续的抑制作用,这一作用虽然减少了月经出血,但是也增加了月经量减少及闭经的发生风险[15]。本研究也发现有4例患者在随访期间出现闭经,但是目前认为LNG-IUS引起的闭经并不会对患者造成严重影响,患者的雌激素水平是正常的,卵巢功能也正常。但是在应用LNG-IUS治疗前应该与患者进行充分沟通,使患者认识到这一情况且能够接受,以免对患者造成较大的心理压力。
综上所述,宫腔镜电切术联合LNG-IUS治疗子宫内膜息肉具有确切的临床疗效,可有效减少月经量,使血红蛋白水平得以提高,并且使患者的子宫内膜变薄,预防术后复发。

