贝莱斯芽孢杆菌SZAD1 对大丽轮枝菌的生物防治效果
张琼,Zabihullah Sherzad,唐灿明
(南京农业大学农学院,南京210095)
棉花是重要的经济作物,黄萎病是棉花的主要真菌病害之一。1914 年首次在美国弗吉尼亚州被报道,随后蔓延到包括中国在内的数十个国家和地区[1],对棉花产量造成巨大损失,棉花黄萎病成为棉花高产稳产的主要障碍。 我国主产棉区的棉花黄萎病病原菌均属于大丽轮枝菌Verticillium dahliae[2]。 棉花黄萎病病原菌的传播途径非常广泛,研究发现病株各部位的组织均可带菌[3],通过种子带菌和人为操作长距离传播,通过病残体和土壤浇水近距离传播等使该病广泛传播。 当生长环境不适宜时,大丽轮枝菌会形成由许多厚壁细胞组成的黑色、近球形、长条形或不规则形的微菌核[4]。 黄萎病菌以微菌核的形式长期存在于土壤中,可存活15 年之久[5]。
目前主要通过培育棉花抗病品种、 生物防治、改善土壤的生态条件以及诱导棉株抗病性相结合来控制棉花黄萎病危害[6]。 目前关于植物内生细菌防治植物病害的研究报道很多,现已从棉花、水稻、玉米、油菜、马铃薯等多种作物内分离筛选到对棉花黄萎病、枯萎病和立枯病、大豆菌核病等常见植物真菌病害具有良好生防效果的内生菌[7]。 内生细菌最常见的属有芽孢杆菌属(Bacllius)、假单胞菌属(Pseudomnoas)、肠杆菌属(Enterobacter)、沙雷菌属(Serratia)、土壤杆菌属(Agrobacteriu)和节杆菌属(Arthrobacterium),其中芽孢杆菌属(Bacllius)已被证明能够控制多种真菌病害,是有效生防菌[8]。在棉花病害生物防治方面研究和应用最多的是假单胞菌属(Pseudomnoas)[9]和芽孢杆菌属(Bacllius)[10]。 贝莱斯芽孢杆菌是2005 年发现的芽孢杆菌属的1 个新种,在自然界中广泛分布且对人畜无害、环境无污染且对很多病原微生物有抑制作用[11]。 本研究探讨棉花内生细菌贝莱斯芽孢杆菌SZAD1 菌株对棉花黄萎病的防效及相关机理,为棉花黄萎病生物防治提供理论依据。
1 材料与方法
1.1 菌株、植物材料
大丽轮枝菌菌株VD080,为本实验室于冰箱中留存。 感病棉花品种为冀棉11。 从健康棉花根系中分离的菌系中筛选出1 株抗菌效果最佳的内生菌,并将其保存在固体Luria-Bertani(LB)培养基中。
1.2 试验方法
1.2.1 菌株DNA 分离、 聚合酶链反应(Polymerase chain reaction, PCR) 与菌株生理生化检测。 使用TIANamp bacteria DNA Kit(TIANGEN Biotech Co, Ltd, Beijing, China) 提 取 细 菌 总DNA。 用通用引物 (F27:5′-AGAGTTTGATCCTGGCTCAG-3′和R1492:5′-GGTTACCTTGTTACGACTTT-3′)[12]和DNA 聚合酶扩增16S rDNA 序列。 用通用引物 (F:5′-GAAGTCATCATGACCGTTCTGCA-3′和R:5′-AGCAGGGTACGGATGTGCGAGCC-3′)[13]扩增gyrB 基因序列。PCR 反应体系:1 μL DNA 模板、0.5 μL 正向引物、0.5 μL 反向引物、12.5 μL rTaq 酶和10.5 μL无菌蒸馏水。 PCR 反应起始于95 ℃的初始变性1 min, 引物退火53 ℃30 s, 引物延伸72 ℃1 min,PCR 产物用2%(质量分数,下同)琼脂糖凝胶进行分析。 扩增后的基因由中国北京六合华大基因科技有限公司测序,BLAST 分析。
参见东秀珠等[14]方法检测生理生化特征,包括革兰氏染色、芽孢染色、鞭毛染色、接触酶试验、淀粉水解,厌氧生长不同温度生长测定。 用以下程序检查革兰氏染色: 制作一层薄薄的细菌细胞切片。 用95%(体积分数) 甲醇固定2 min,风干。 用结晶紫染色试剂浸泡玻片30 s。 用自来水轻轻间接地冲洗载玻片2 s, 吸干多余的水。 在载玻片中注入碘染色剂30 s,再用间接自来水冲洗载玻片,吸干水分。 倾斜载玻片加脱色剂大约30 s,水洗后吸干水分。 用藏红花(粉红色)染色30 s,用自来水温和地冲洗载玻片,直到没有颜色被冲洗掉,干燥后镜检。 细菌呈蓝色,为革兰氏阳性菌指标;细菌呈红色,为革兰氏阴性菌指标。
1.2.2 平板对峙试验中的拮抗活性。 采用扩散法, 在马铃薯葡萄糖琼脂 (Potato dextrose agar,PDA)平板培养基上测定该菌株的拮抗活性。 大丽轮枝菌分生孢子悬浮液的制备:将冰箱里保存的VD080 菌块接种于200 mL 的液体PDA 培养基中,28 ℃、160 r·min-1培养3~5 d。 生防菌的制备: 将500 μL 菌液接种于液体LB 培养基中,37 ℃、180 r·min-1过夜培养。 PDA 培养基成分:马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水1 000 mL,pH 7.0。 LB 培养基成分:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂18 g,蒸馏水1 000 mL,pH 7.0。 将2 mL 大丽轮枝菌分生孢子悬浮液(孢子含量106mL-1)与200 mL 半固体(45 ℃)PDA 培养基混合,倒入培养皿中冷却备用。用直径0.6 mm 的打孔器在PDA 培养基中打孔,将过夜培养的10 μL 的生防菌菌液放入培养孔中 (对照添加LB)。 在25 ℃下培养3 d 后,在BX53-Olympus 显微镜下观察大丽轮枝菌菌丝的形态变化。
1.2.3 温室条件下SZAD1 的生物防治。 种子处理法:将冀棉11 种子洗净,用5.5%(质量分数)次氯酸钠消毒1 min,用无菌蒸馏水冲洗3 次。 将灭菌种子在生防菌发酵液(SZAD1 菌接种于LB 培养基中,37 ℃、180 r·min-1,培养2 d)中浸泡2 h后装入无菌蛭石的300 mL 塑料杯中,对照(CK)种子泡在液体LB 中。20~25 d 后,在棉花处于两叶一心时在土中灌入10 mL VD080 孢子悬浮液(孢子含量106mL-1),放置在27 ℃、14 h/10 h 光周期的温室并隔天浇水。 接种VD080 孢子悬浮液15 d 后,观察棉花发病程度。
灌根防治法: 将灭菌种子装入无菌蛭石的300 mL 塑料杯中,15~20 d 后杯中土壤中灌入10 mL 生防菌发酵液(CK 为液体LB)。 7 d 后,土中灌入10 mL VD080 孢子悬浮液(孢子含量106mL-1), 放置在27 ℃下14 h/10 h 光周期的温室并隔天浇水。 接种病原菌后15 d,观察棉花发病程度。
根据病害严重程度进行分级, 按国家标准GB/T 22101.5-2009 中所述分级标准进行棉花黄萎病发生及防病效果调查,按黄化、坏死叶片或落叶的比例进行分类(0:棉株健康,无病叶,生长正常;1:棉株1/4 以下叶片发病,变黄变蔫;2:棉株1/4 以上,1/2 以下叶片发病,变黄变蔫;3:棉株1/2 以上叶片,3/4 以下叶片发病,变黄变蔫;4:棉株3/4 以上叶片发病,或叶片全部脱落,棉株枯死)。 试验按照2 种方法,每处理19~25 株,3 次重复,以液体LB 处理为对照。
相关公式:病情指数=∑(各级的病株数×对应病级)/ (总株数×最高病级)×100; 防病效果(%)=[(对照病指-处理病指)/对照病指]×100。
1.2.4 羧甲基纤维素(CMC)、胶体几丁质琼脂平板培养基的制备。 在含有CMC 或几丁质的琼脂平板培养基上,检测纤维素酶和几丁质酶。 (1)纤维素酶检测: 制备含1%(质量分数, 下同)CMC的琼脂平板培养基。 在培养板中接种SZAD1 菌株 (37 ℃,180 r·min-1,2 d) 并在30 ℃下培养2 d。 用0.1%(质量分数)的刚果红染色20 min 后,将刚果红倒出,用1 mL 氯化钠洗涤10 min,形成的透明区表明菌株可以分泌纤维素酶。
(2)几丁质酶检测。 胶体几丁质制备:将5 g几丁质粉末加入50 mL 浓盐酸中,用力搅拌2 h。将混合物添加到500 mL 95%(体积分数)的冰冷乙醇中,用力搅拌,在25 ℃下过夜,然后储存在-20 ℃以备将来使用。 使用0.1 mol·L-1磷酸盐缓冲液清洗胶体滤液, 直到使用前变成中性。制备含1%(质量分数,下同)胶体几丁质的琼脂平板培养基。 接种SZAD1 菌株并在30 ℃下培养3 d。 菌株周围出现透明带表示有几丁质酶。
1.2.5 SZAD1 菌株抑菌物质的分离及其抗菌活性的检测。 将500 μL SZAD1 种子液接种于1 L的液体LB 培养基中,37 ℃、160 r·min-1下培养2 d。 1.2×104r·min-1离心15 min,留上清液冷冻干燥保存。
在平板培养基中检测菌液离心上清液的抑菌活性。 用玻璃涂布器将大丽轮枝菌孢子液涂布在PDA 培养基表面。 用直径为0.5 cm 的无菌打孔器打孔,加入10 μL 经孔径0.22 μm 滤膜过滤后的粗提取物,CK 加LB 培养基。 在28 ℃培养2~3 d 后测量打孔周围抑菌圈的直径。
在液体PDA 培养基中, 检测上清液对VD080 的抗菌活性。 将SZAD1 菌株发酵上清液冷冻干燥后粉末溶于无菌水中得到25 mg·L-1和50 mg·L-1的抑菌提取物,在50 mL 液体PDA 培养基中加0.5 mL 抑菌提取物同时接种0.5 mL VD080 孢子悬浮液,28 ℃、80 r·min-1共培养10 d 后,用血细胞仪计数活孢子数。
1.2.6 SZAD1 对VD080 定植能力影响试验。 将棉花的茎从基部切成2 cm 长的小段, 在纯水中清洗后用75%(体积分数) 乙醇对小段进行表面消毒,在1%(质量分数)次氯酸钠中消毒1 min,然后用无菌蒸馏水冲洗3 次, 最后切割成厚度2~3 mm 的横截面碎片。 在加100 mg·L-1潮霉素B 的PDA 平板培养基上放10 个植株碎片,在28 ℃下培养5 d。 计算不同浓度粗提物处理土壤对大丽轮枝菌在棉花茎部定植的影响。
1.2.7 几丁质酶、总纤维素酶活性检测。 SZAD1菌液经37 ℃、180 r·min-1发酵2 d 后,4 ℃、8 000 r·min-1下离心5 min 去菌体,经孔径0.22 μm 滤膜过滤后冷冻干燥。 该粗提物作为酶源用于水解酶活性试验。
在几丁质酶活性测定中,以胶体几丁质为底物。 将1 mL 上述酶源与1 mL 1%胶体几丁质磷酸盐缓冲液(pH 7.0)混合。将反应混合物在50 ℃培养60 min, 然后添加2 mL 1%(质量分数)3,5-二硝基水杨酸(Dinitrosalicylic acid,DNS)以停止反应。 将混合物在水浴中煮沸15 min,冷却至室温,在530 nm 处测量吸光度。
总纤维素酶的活性通过测量DNS 在酶促反应过程中产生的还原糖量来测定[15]。 制备含0.5 mL上述酶源、0.5 mL 0.05 mol·L-1柠檬酸磷酸盐缓冲液(pH 7.0)和1.0 mL 1%CMC 的反应混合物,于37 ℃反应15 min,加入1.5 mL DNS 试剂终止反应,煮沸15 min,冷却后在540 nm 处测量吸光度。 不加提取物的混合物用作空白对照。 每单位纤维素酶活性被定义为每毫升酶溶液每分钟催化纤维素酶释放1.0 μg 葡萄糖所需的酶量, 即1 U·mL-1。 试验进行3 次重复。
2 结果与分析
2.1 SZAD1 菌株的鉴定和生理生化特征
根据16S rDNA 基因、gyrB 基因测序, 系统发生树分析显示该菌株与其他类似菌株之间的进化关系(图1~3)。 该菌株与B.velezensis 菌株FZB42 的相似度达99.29%。 菌株SZAD1 为革兰氏阳性,白色光滑。 在3%~8%(质量分数)NaCl溶液中可生长,为需氧菌。 苹果酸、蔗糖、L- 鼠李糖、L- 组氨酸、 水杨酸、D- 核糖、E- 山梨糖醇、柠檬酸三钠、肌醇、乳酸、脲酶、褪黑糖、硝酸盐还原成亚硝酸盐检测阳性,醋酸钠、β- 半乳糖苷酶、精氨酸二氢酶、己二酸、戊酸、丙酸、阿拉伯糖检测阴性。 在42 ℃下能生长,pH 5.7 条件下也能生长。结合菌株生理生化特征以及16S rDNA 基因、gyrB 基因测序结果对比, 最终确定菌株SZAD1为贝莱斯芽孢杆菌(Bacillus velezensis)。

图1 贝莱斯芽孢杆菌SZAD1 的16S rDNA 基因系统发育分析Fig. 1 Phylogenetic analysis of Bacillus velezensis strain SZAD1 16S rDNA gene

图1 SZAD1 与Bacillus velezensis strain FZB42 16S rDNA 基因比对结果Fig. 1 16S rDNA gene comparison results of SZAD1 and Bacillus velezensis strain FZB42
2.2 体外分离及抑菌活性测定
从冀棉11 根中分离出66 株内生细菌,用扩散法测定它们对大丽轮枝菌VD080 菌系的拮抗能力。其中,SZAD1 菌株对VD080 的抑制能力最强。 将SZAD1 菌株发酵液加入含VD080 孢子的平板培养基中时,在加入菌液的小孔周围出现明显的抑菌圈, 对照区小孔周围的VD080 菌丝生长正常。 在拮抗区域,菌丝体出现膨胀、增大、变黑等异常现象(图4)。 而对照区域的分生孢子形态正常。 这些结果表明,SZAD1 菌株能够抑制VD080 菌丝的生长。
2.3 SZAD1 菌株对棉花黄萎病的防治效果
按照1.2.3 的方法,用SZAD1 菌液处理棉花植株,可显著减轻叶片变黄、坏死和落叶,使植株的发病程度降低,而对照土壤中生长的植株表现严重枯萎和落叶。 分别用种子浸泡法和灌根法进行处理,对照组叶片病情指数为62.43,种子浸泡处理组病情指数为24.91, 组间差异显著 (P<0.05),防治效果为60.10%;灌根法处理组叶片病情指数为27.47,与对照组差异显著,防治效果为56.00%(数值均为3 次重复的平均值, 差异显著性分析采用Tukey HSD 检验)。
2.4 菌SZAD1 的抗黄萎病机制
2.4.1 菌SZAD1 水解酶的产生及培养时间对水解酶活性的影响。 当菌株接种于含有1%的CMC或胶体几丁质酶的培养基中,其周围出现一个清晰的区域, 表明菌株SZAD1 具有分泌纤维素酶和几丁质酶的特性(图5-A、5-B)。 不同时间间隔提取菌SZAD1 发酵物粗提物质为酶源, 进行纤维素酶和几丁质酶活性测定。 纤维素酶活性培养48 h 后增加到0.088 U·mL-1,培养72 h 时达到峰值3.14 U·mL-1, 培养96 h 和120 h 后纤维素酶的活性持续下降(图5-C)。 几丁质酶在培养48 h后活性为0.67 U·mL-1, 到72 h 时达到峰值1.69 U·mL-1, 在培养120 h 后活性基本丧失 (图5-D)。

图3 SZAD1 的gyrB 基因系统发育分析Fig. 3 Phylogenetic analysis of the gyrB gene of SZAD1

图4 SZAD1 菌株对VD080 菌丝的抑制作用Fig. 4 Inhibition of strain SZAD1 on the mycelium of VD080
2.4.2 不同时间和浓度的发酵液上清液的抗菌活性。 以不同的时间收集SZAD1 液体培养基中的上清液,以尽可能提高抗菌活性。 不同时间间隔的上清液经冷冻干燥后的颜色不同。培养48 h,冷冻干燥后上清液呈黄灰色,抑菌圈小,抗黄萎病菌能力弱。 72 h 上清液冻干后呈淡黄色,抑菌圈直径为48 h 上清液抑菌圈的3 倍(图6-A),抗VD080 能力最强。而96 h 和120 h 上清液冻干后呈深灰色和深色,无抗菌能力(图6-B)。该结果表明从分离株培养72 h 后上清液中提取的粗提物具有最高的抗VD080 活性。
SZAD1 发酵上清液对VD080 的孢子萌发有明显抑制效果。 28 ℃培养5 d 后对照组中液体PDA 培养基中活孢子含量达到1.5×105mL-1, 而添加质量浓度为25 mg·L-1和50 mg·L-1活性粗提物的液体PDA 培养基中, 孢子含量分别为4×104mL-1和1.5×104mL-1,较对照降低了30.20%和96.53%(图6-C)。该结果表明,SZAD1 发酵上清液直接抑制VD080 孢子的萌发和繁殖。
2.5 SZAD1 粗提物对VD080 在棉花茎上定植的影响
在对照培养基中,10 个茎段中有9 个出现VD080 菌落。 在用25 mg·L-1和50 mg·L-1活性粗提物对土壤处理后,PDA 培养基中10 个茎段中分别有4 个和1 个出现菌落,可以初步推测粗提物显著降低VD080 在棉花植株茎部的定植程度(图7)。
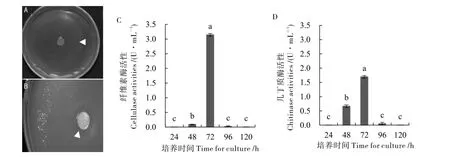
图5 SZAD1 的水解酶活性及不同培养时间对水解酶活性的影响Fig. 5 Hydrolytic enzyme activity of strain SZAD1 and effect of different culture times on hydrolase activity

图6 不同时间上清液的抗大丽轮枝菌能力及PDA 液体培养基中粗提取物的拮抗活性Fig. 6 Resistance to Verticillium dahliae of the supernatants at different times and antagonistic activity of crude enzyme extract in PDA liquid medium
3 讨论
棉花黄萎病属于土传维管束病害,病原菌寄主范围广,并且存在明显的致病力分化;因此,其防治难度很大。 内生菌存在于植物体内,受环境的影响较小, 相对于其他生物防治因子而言,具有较大的生防利用优势[16]。 目前已有利用内生细菌防治棉花黄萎病的报道,但真正用于推广应用的不多,且对不同生理型的病原菌防效可能存在差异[17]。本研究中从冀棉11 根中筛选出的1 株内生细菌SZAD1, 经过16S rDNA 基因结合gyrB基因测序对比,属于贝莱斯芽孢杆菌。 通过平板抑菌检测、模拟自然条件下的温室接种病原菌试验,以期筛选出对黄萎病菌有明显防治效果的生防菌。
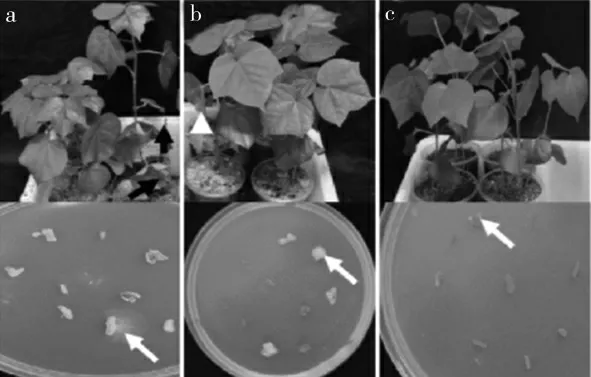
图7 SZAD1 粗提物对VD080 在棉花茎部定植影响Fig.7 The effect of SZAD1 crude extract on VD080 colonization in cotton stem
前人研究表明, 贝莱斯芽孢杆菌B.velezensis 对很多病原微生物有抑制作用,有作为生防菌应用的前景。 B.velezensis 2A-2B 能够显著抑制辣椒疫霉菌(Phytophthora capsici)、腐皮镰刀菌(Fusarium solani)、尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)的生长,抑制率最低也在60%以上[18]。 B.velezensis 3A3-15具有较好的生防和促生潜力,是防治尖孢镰刀菌引起的大豆根腐病的潜在菌株[19]。 2016 年报道,B.velezensis YP2 可有效抑制叶类蔬菜上的病原真菌包括褐斑病菌(Septoria sp.)、茎点霉(Phoma sp.)、灰葡萄孢石竹变种(Botrytis cinerea)和油菜菌核病菌(Sclerotinia scleotiorum)的菌丝生长;在温室试验中,B.velezensis YP2 以4 次间隔5 d、3次间隔7 d、2 次间隔10 d 施用,防治红叶芥菜白粉病效果分别为70.6%、65.0%和40.9%[20]。 B.velezensis HYEB 能显著抑制日本大叶黄杨(Buxus megistophylla Levl.) 离体叶片上的炭疽菌(Colletotrichum gloeosporioides)[21]。此外,贝莱斯芽孢杆菌还对一些植物病原细菌具有较强的拮抗活性。 B.velezensis LS69 对软腐病果胶杆菌(Pectobacterium carotovorum)和梨火疫病菌(Erwinia amylovory) 抑制效果好[22]。 本试验中B.velezensis SZAD1 菌株发酵液在温室下用种子浸泡法和灌根法处理, 对棉花黄萎病的防效分别为60.10%和56.00%, 能显著减轻黄萎病的发生。
平板拮抗活性一直以来都是生防菌株室内初步筛选的重要指标之一,不少研究表明,生防菌株直接抑制病原物生长, 减少病原物群体数量,达到较好的防治效果[23]。 本研究结果与之一致,平板拮抗活性鉴定中,菌株SZAD1 能在体外通过使菌丝膨大、 畸形而抑制黄萎病菌的生长。菌株SZAD1 的发酵上清液可以抑制黄萎病的发生, 活性粗提物与VD080 共培养试验也表明它可以抑制VD080 的生长。 贝莱斯芽孢杆菌可以分泌产生多种生物活性物质,包括酶类、抗菌物质、植物激素,其中拮抗蛋白大多是细胞壁降解酶类[24]。生防菌可通过产生水解酶如纤维素酶和几丁质酶来降解真菌细胞壁从而导致真菌菌丝体生理异常,降低其感染能力和毒力[25]。 本研究结果与之相一致,本试验中菌株SZAD1 能产生纤维素酶和几丁质酶, 这些酶能分解真菌的细胞壁从而引起真菌细胞的紊乱、 抑制菌丝的生长。 产生细胞壁降解酶已被证明是拮抗真菌病原体的有效机制[26]。 纤维素酶和几丁质酶活性在培养72 h 时达到最高,这与粗提物平板抑菌活性检测的结果一致。 据报道, 一些B.velezensis 菌株可释放出与促进植物生长有关的化合物,如植物激素和挥发性化合物[27]。本试验中菌株SZAD1 是否对植株有促生作用仍有待进一步探索。
4 结论
SZAD1 及其发酵液粗提物能显著抑制VD080 菌丝的生长和孢子的萌发,对棉花黄萎病有很好的生物防治效果。SZAD1 能产生纤维素酶和几丁质酶,可降低VD080 定植棉花茎部的能力。

