大麦种质资源成株期对西藏白粉菌自然群体的抗性评价及8 个菌株的毒性谱分析
王延宇,王凤涛,郎晓威,冯 晶,旺 姆*,蔺瑞明*
(1.西藏农牧学院植物科学学院,西藏林芝860000;2.中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京100193)
根据种子是否带稃,大麦(Hordeum vulgareL.)分为有稃型皮大麦和无稃型裸大麦[1],它是世界第四大禾谷类作物[2],也是我国第四大禾谷类作物,主要用于饲料、酿造业、医药工业原料和保健食品,少部分作为粮食。在青藏高原及其周边地区,裸大麦(H.vulgareL.var.nudum)也被称作青稞,它是该区域内唯一广泛栽培的主要粮食作物和重要饲草来源[3]。大麦栽培区域广泛分布于全球温带地区,因而其病害种类多,主要病害有80 多种[1],造成大麦平均减产15.0%~38.5%,其中白粉病是最重要的叶部病害之一,在世界各大麦种植区域均有分布,平均造成的产量损失为1%~14%[4]。大麦白粉病是由禾谷布氏白粉菌大麦专化型(B. graminisf. sp.hordei)引起的气传真菌病害,病原菌能在大麦整个生育期的任何阶段侵染寄主植物地上部分的各个部位。白粉病主要发生在潮湿、半潮湿地区,感染白粉病的叶表面被菌丝覆盖,严重影响了作物叶片的光合作用和蒸腾作用;另外,感病大麦叶片合成的养分流向被侵染部位,造成全株营养不良[1]。在英国,白粉病造成大麦减产6%~14%,但在美国平均产量损失不到1%,这主要与主栽品种的抗性水平和病原菌的毒性变异有关[4]。因此,在白粉病流行年份,品种抗病水平是决定产量损失的关键因素。大麦对白粉病的抗性主要由主效和微效抗病基因所控制[5-7]。目前已经标记定位了100 多个大麦抗白粉病基因,其中一些抗病基因如mlo具有持久广谱的抗病特点,已经在生产上广泛利用[7]。大麦不同染色体上分布了22 个主效抗病基因位点,其中Mla、Mlra、Mlat、Mli、MRu2、Mlk、Mlnn、MlGa和Mlp定 位在1H 染色体上,MlLa和Mlhb定位在2H 染色体上,Mlg和MlBo定位在4H 染色体上,Mlj和Mlh定位在5H 染色体上,mlt和Mlf定位在7H 染色体上[7]。野生型感病Mlo基因通过突变产生一系列mlo隐性等位抗病基因。已获得30 个Mlo突变等位基因[8],其中只有mlo-11为自然突变基因,其余均为人工诱导突变。通过自然突变和有性杂交,病原菌B.graminisf.sp.hordeide群体中存在非常丰富的毒性变异,新致病类型不断出现[9]。由于大麦白粉病抗源基因大规模多年单一化利用,加快了病原菌群体毒性变异速度,导致主栽品种中广泛利用的具有小种专化性的抗病基因“丧失”抗性而变为感病[10],缩短了优良品种在生产上的使用周期,给抗病新品种选育造成极大的压力。因而,发掘和利用抗病谱宽而且抗病性持久稳定的基因尤为重要。在欧洲,大麦抗病育种中广泛使用mlo-11基因,已经有效控制了大麦白粉病的流行[11]。白粉病是我国东部和西南大麦主要种植区的主要叶部病害之一,特别是在浙江、江苏和云南危害较重[7,12]。近年来,由于全球气候变暖等因素影响,西藏自治区大麦白粉病流行区从南部林芝地区逐年向拉萨扩展,为害呈明显加重趋势,已发展成为西藏青稞上主要的病害[13]。
相比于化学防治措施,培育和广泛应用抗白粉病大麦品种具有更经济安全和环保的特点,尤其在我国云南、西藏等生态条件较脆弱的高海拔地区,推广应用抗病品种尤为迫切[13-14]。因此,需要更加合理使用和布局现有抗病主栽品种。同时,针对不断出现的新流行小种,需要从大麦种质资源中筛选鉴定新抗源材料。这些基础性研究对大麦品种的抗病改良和合理利用具有重要意义。本研究分析了4 个来自云南和4 个来自西藏的白粉菌菌株的毒性变异情况;选用毒性谱较宽的强毒性菌株16248-4 在苗期鉴定了300 个大麦品种对白粉病抗性水平;另外,利用白粉病常发流行区病原菌群体田间自然接种,在西藏林芝鉴定了大麦材料成株期对白粉病的抗性。筛选获得的抗病种质能为大麦抗白粉病育种和新抗源创制提供抗病基因。

表1 以大麦高感白粉病品种Pallas 为遗传背景的抗白粉病近等基因品系
1 材料与方法
1.1 供试大麦品种(系)
用高感白粉病大麦品种花30 扩繁供试菌株,以30 个高感白粉病大麦品种Pallas 为遗传背景的抗病近等基因品系(表1)作为分析病原菌毒性谱变异的鉴别品种,以及300 份大麦品种(系)作为待鉴定的大麦品种资源材料(表2)。

续表
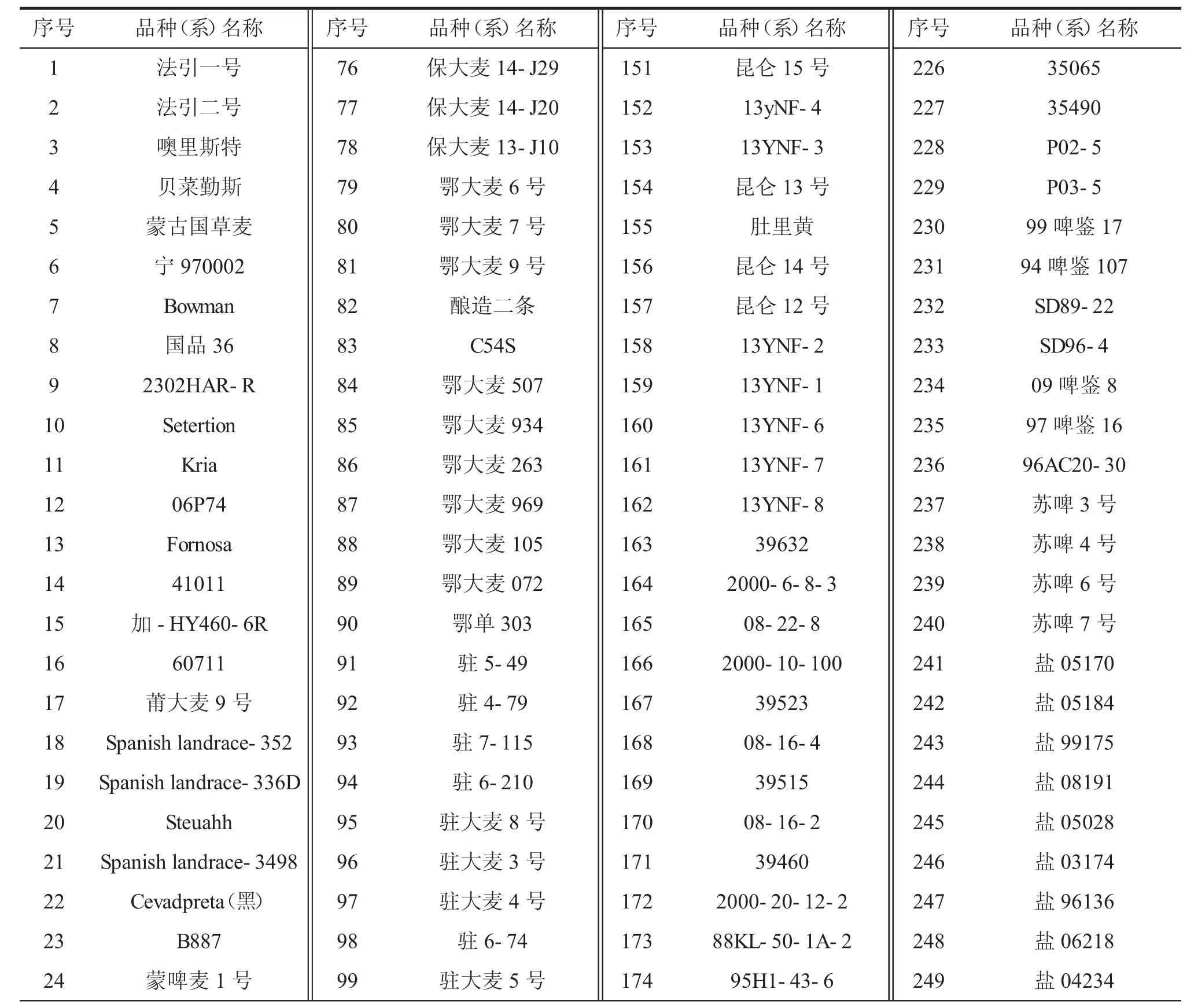
表2 300 份拟进行抗白粉病鉴定的大麦品种(系)

续表
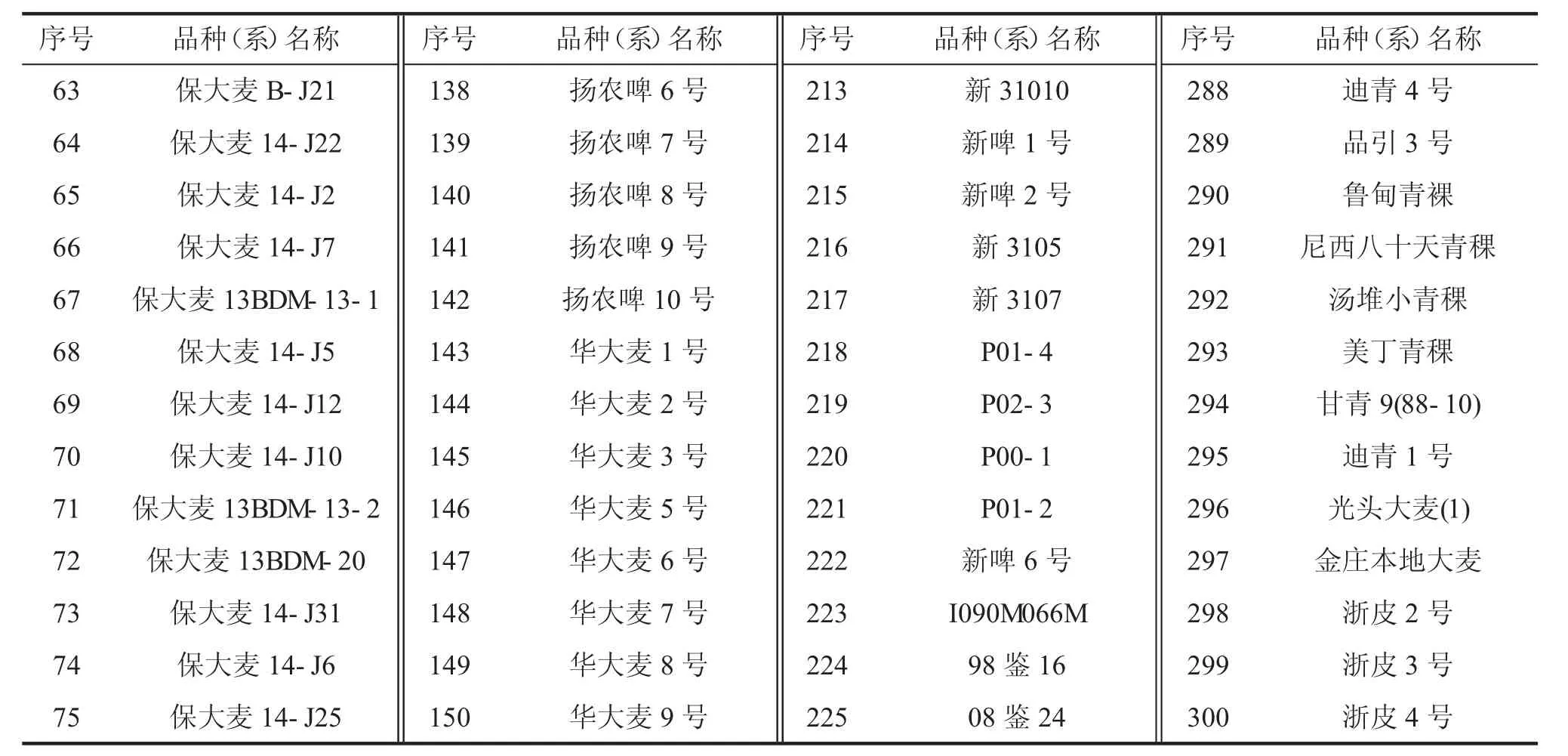
续表
1.2 供试大麦白粉菌株
将分离自西藏林芝地区19677、19681、19683和19688 菌株的单孢菌系和来自云南不同流行地区16248-4、16243-2、16420-1 和16204-1 菌株的单孢菌系进行毒性谱聚类分析。选用强毒性菌株16248-4 进行苗期抗病性接种鉴定;在西藏林芝地区利用流行病原菌群体以田间自然接种鉴定成株期抗病性。
1.3 大麦白粉菌毒性谱分析
1.3.1 大麦幼苗种植。将按1∶3 比例的营养土与地表土壤混合均匀后装入规格为11.5 cm×11 cm×8 cm(口径×高×底径)的花盆中,用于播种培育高感白粉病大麦品种花30 幼苗,培养间温度19~22℃,光照周期16 h(昼)/8 h(夜)。出苗7~8 d 后待第1 张叶完全展开时用于接种和扩繁白粉菌菌系。其他大麦材料的培养条件与花30 的相同。
1.3.2 白粉菌培养。用扫接涂抹的方法将活体保存的大麦白粉菌菌株接种在第1 张叶完全展开的花30 幼苗上进行扩繁,接种后套上直径11 cm、高20 cm 的玻璃罩,玻璃罩顶部覆盖3 层纱布,并用橡皮筋扎紧。接种后潜育培养的环境条件与育苗条件相同。接种7~10 d 后,花30 叶片表面形成大量菌丝和分生孢子,用于后续试验。
1.3.3 毒性谱鉴定。利用1 套由30 个以Pallas 为遗传背景的抗白粉病基因的近等基因品系作为鉴别品种,播种在规格为11.5 cm×11 cm×8 cm(口径×高×底径)的花盆中,每盆穴播5 个品种(系),按照逆时针方向顺序点播,每穴播种1 个品种(系),每个品种(系)播7~8 粒种子,并插牌标注每一盆的起始品种(系)序号,用漏网过滤的细土覆盖种子。然后将播种好种子的种植盆放入事先加好水的托盘中进行渗水处理。最后将充分吸水的花盆放在19~22℃温室中光照培养7~8 d,待第1 张叶完全展开后用扫接涂抹的方法将花30 扩繁的8 个菌株的单孢菌系接种到鉴别品系上进行毒性谱分析。接种后幼苗在温度16~18℃、光照周期16 h(昼)/8 h(夜)条件下潜育培养8 d,待感病对照品种花30 充分发病,接种叶片白粉病严重度达到80%~100%,按照0~4级标准调查第2 张叶片的侵染型,每个鉴别品系调查5~8 株。
1.3.4 毒性谱聚类分析。根据单孢菌系在每个鉴别品系上的侵染型计算其平均值,同时按照公式(毒性频率= 感病鉴别品系个数/ 鉴别品系总数×100%)统计各菌系的毒性频率。平均侵染型0~2 级为抗病反应,3~4 级为感病反应。将抗病类型记为‘0’,感病类型记为‘1’。将表1 转化为单孢菌系侵染型组成的二进制矩阵,用群体遗传结构分析软件PopGene32 对二进制矩阵进行分析,计算出来自不同地点的大麦白粉菌群体的毒性距离和毒性一致度,最后运用群体遗传结构聚类分析软件NTsys 对结果进行聚类分析。
1.4 大麦品种抗白粉病鉴定
1.4.1 苗期抗白粉病鉴定。1)麦苗培养。鉴定材料的播种方法和培养条件与近等基因系的相同。播种后在19~22℃温室中光照培养7~8 d 后,待第1张叶完全展开即可用于抗大麦白粉病的接种鉴定试验。2)接种方法。采用扫接的方法,用提前在感病品种花30 上扩繁好的强毒性菌株16248-4 分生孢子的大麦叶片轻轻扫抹待鉴定的大麦品种幼苗。接菌后,用直径10 cm 的玻璃罩套在种植盆上,并用纱布对罩子进行封口。将接菌后的材料转移至18℃温室继续培养,光照周期16 h(昼)/8 h(夜)。3)调查方法。苗期抗病性鉴定是以品种Pallas 作感病对照品种。接种约10 d 后,待Pallas 发病完全,严重度达到80%~100%,对待鉴定材料进行侵染型调查并记录,每个品种调查6~8 株。
1.4.2 成株期抗性鉴定。1)大麦种植。选取西藏自治区林芝市西藏农牧学院历年大麦白粉病发病最严重的地块,行播311 个供试大麦品种,每行长2 m,每行1 个品种,播撒20~30 粒种子,每10 行种植1 行高感大麦白粉病品种花30,根据当地田间管理要求进行除草浇水等日常管理。最后仅获得300份材料的调查数据(表2)。2)接种方法。西藏林芝市及周边地区是重要的青稞白粉病流行区,利用自然菌源接种感病诱发型品种花30 和待鉴定品种。3)调查方法。成株期抗性鉴定以品种花30 为感病对照,在大麦至灌浆后期感病对照发病完全(侵染型>3 型)时,依据国家行业标准《大麦品种抗病性鉴定技术规程第2 部分:抗白粉病》(NY/T 3060.2—2016),对待鉴定的大麦材料进行成株期白粉病侵染型分级鉴定,侵染型分级和抗性评价标准与苗期抗性鉴定相同,也采用0~4 级分级标准。
2 结果与分析
2.1 白粉菌毒性谱鉴定
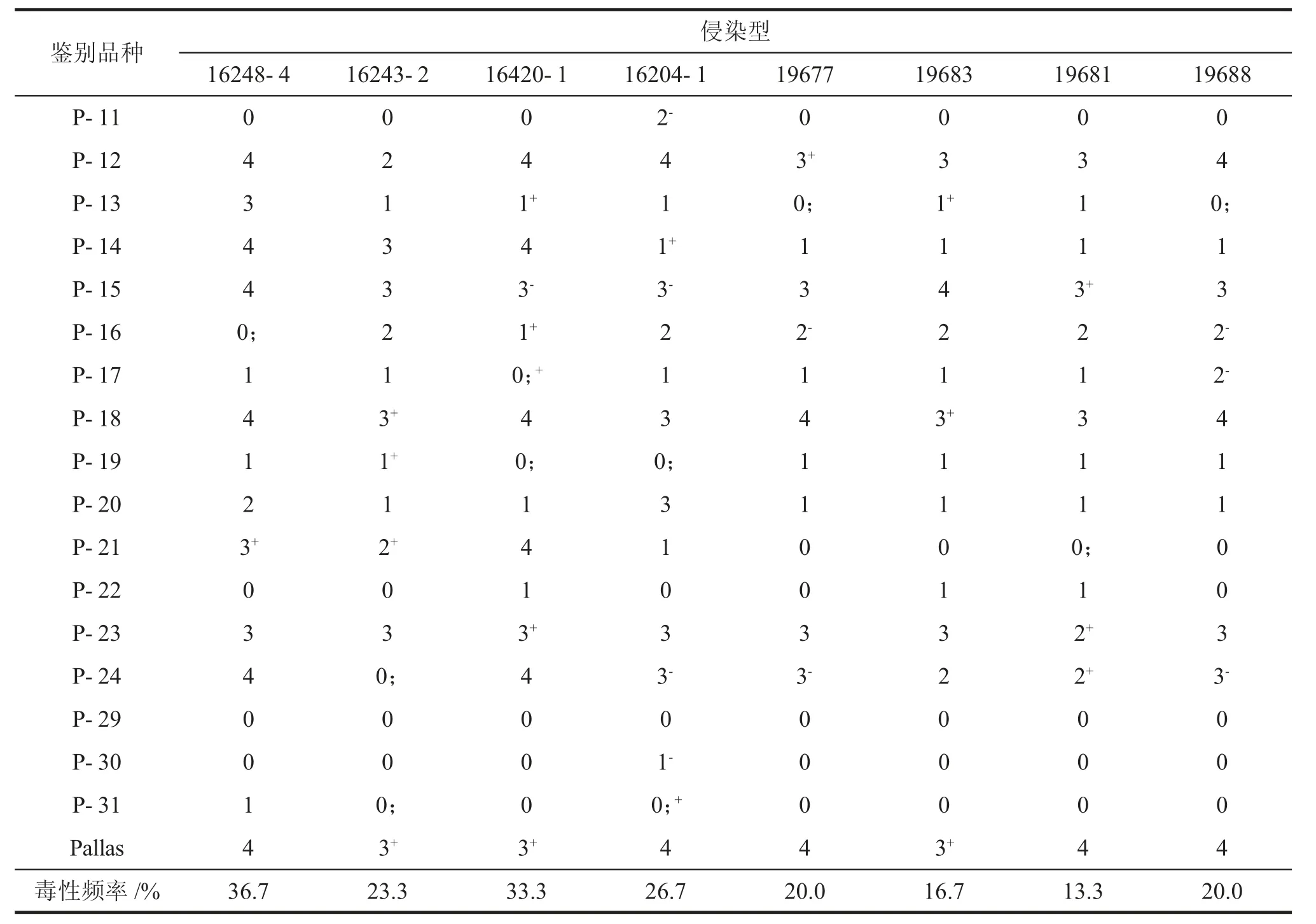
利用30 个鉴别品种对8 个白粉菌菌株的毒性谱进行分析,结果表明,毒性频率介于13.3%~36.7%(表3),其中:4 个分离自西藏林芝地区的菌株19677、19681、19683 和19688,毒性频率为13.3%~20.0%;而其他4 个来源于云南的菌株毒性频率为23.3%~36.7%,说明其毒性谱范围明显较来自西藏林芝地区菌株的毒性谱宽。从中还发现部分抗病基因或基因组合如[Mla1,Mla(Al2)]、Mla22、Ml(Ru2)、Mlnn、MlLa、Mlh和MlLa已‘丧失’抗病功能,不能继续利用。对来自于云南和西藏地区的8 个菌株毒性谱进行聚类分析,比较2 个地区间白粉病菌群体致病表型之间的关系。发现云南的3 个菌株16248-4、16420-1 和16243-2 在相似系数0.88 时聚为一组,西藏的4 个菌株在相似系数为0.943 时聚为一组,云南菌株16204-1 在相似系数为0.905 时与西藏菌株聚在同一组,其毒性谱更类似于西藏菌株(图1)。因此,我国西南地区的2 个大麦白粉病主要流行区西藏林芝和云南的大麦白粉病菌群体的毒性谱存在较大的差异,但不排除两地白粉菌群体之间也存在着交流。

表3 大麦白粉病菌8 个菌株对抗白粉病近等基因系鉴别品系的毒性谱分析
续表
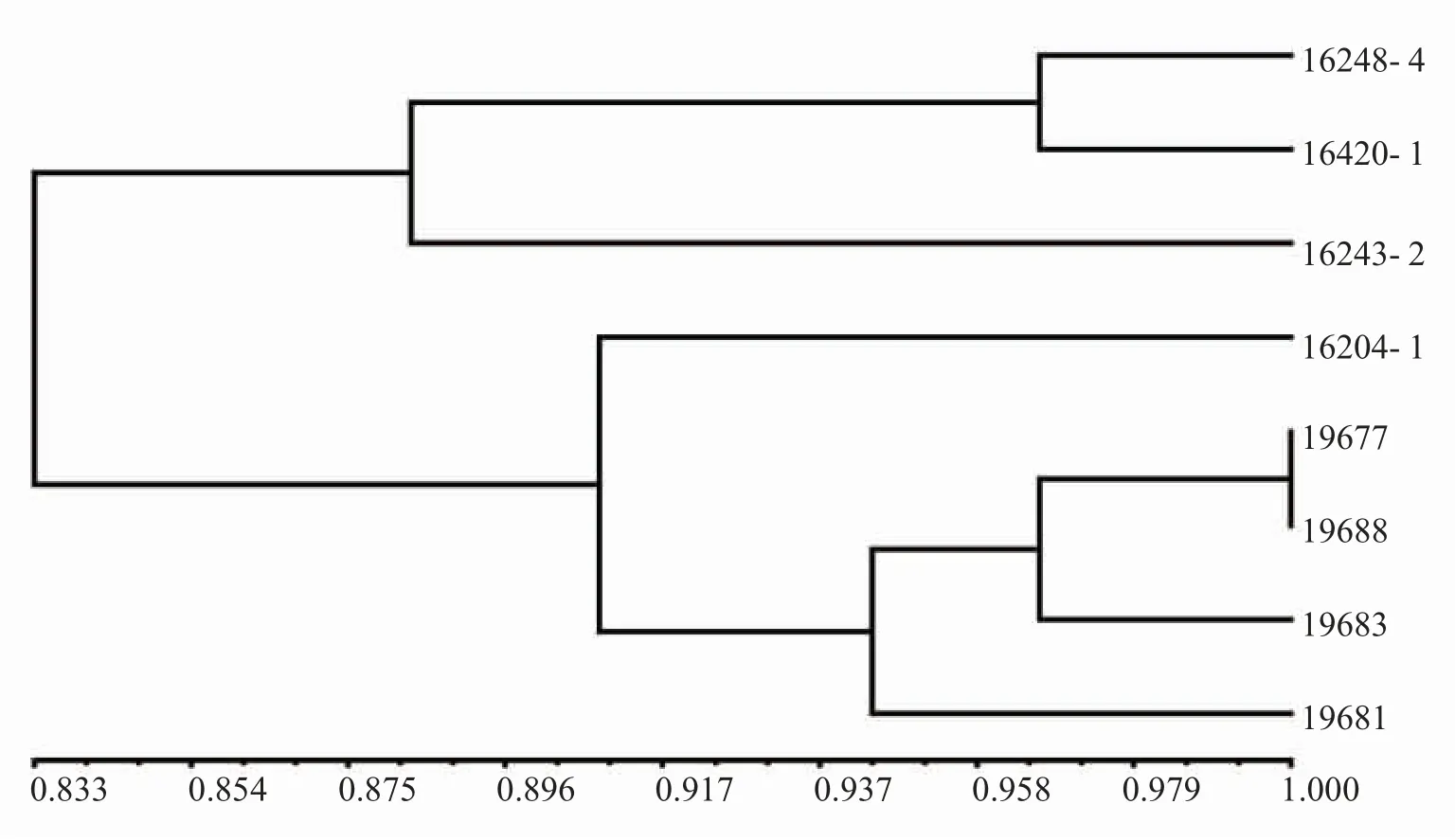
图1 大麦白粉菌8 个菌株的毒性谱聚类分析
2.2 大麦品种(系)抗白粉病鉴定
利用毒性谱比较宽的菌株16248-4 苗期接种鉴定300 个大麦品种(系)抗白粉病水平。其中103个品种(系)表现为高抗类型(侵染型为0~1+),28个品种(系)表现为中抗类型(侵染型2-~2+),146个品种(系)表现为中感类型(侵染型为3-~3+),23个品种(系)表现为高感类型(侵染型4)。在西藏林芝利用白粉菌自然菌源进行成株期抗病鉴定,发现其中153 个品种(系)为高抗类型,63 个品种(系)表现为中抗类型,82 个品种(系)为中感类型,2 个品种(系)为感病类型。
结合苗期和成株期抗性鉴定结果(表4、图2),在所鉴定分析的300 份材料中,92 个大麦品种(系)如法引一号、法引二号和贝菜勤斯等在苗期与成株期均表现为高抗白粉病,9 个大麦品种(系)如莆大麦9 号、昆仑15 号和保大麦14-J5 等在苗期与成株期均为中抗材料,上述101 个大麦品种(系)具有全生育期抗性特点;12 个品种(系)如驻大麦6 号、扬饲麦1 号和扬农啤9 号等在苗期表现为抗病类型,但在成株期表现为感病反应;97 个品种(系)如蒙古国草麦、西引2 号和青裸喜马拉19 号等在苗期表现为感病类型,但在成株期却表现为抗病,具有成株抗性特点;另外,还有72 个品种(系)在苗期和成株期均为感病类型。

表4 大麦品种(系)资源苗期和成株期白粉病侵染型与抗性表型评价

续表

续表

续表
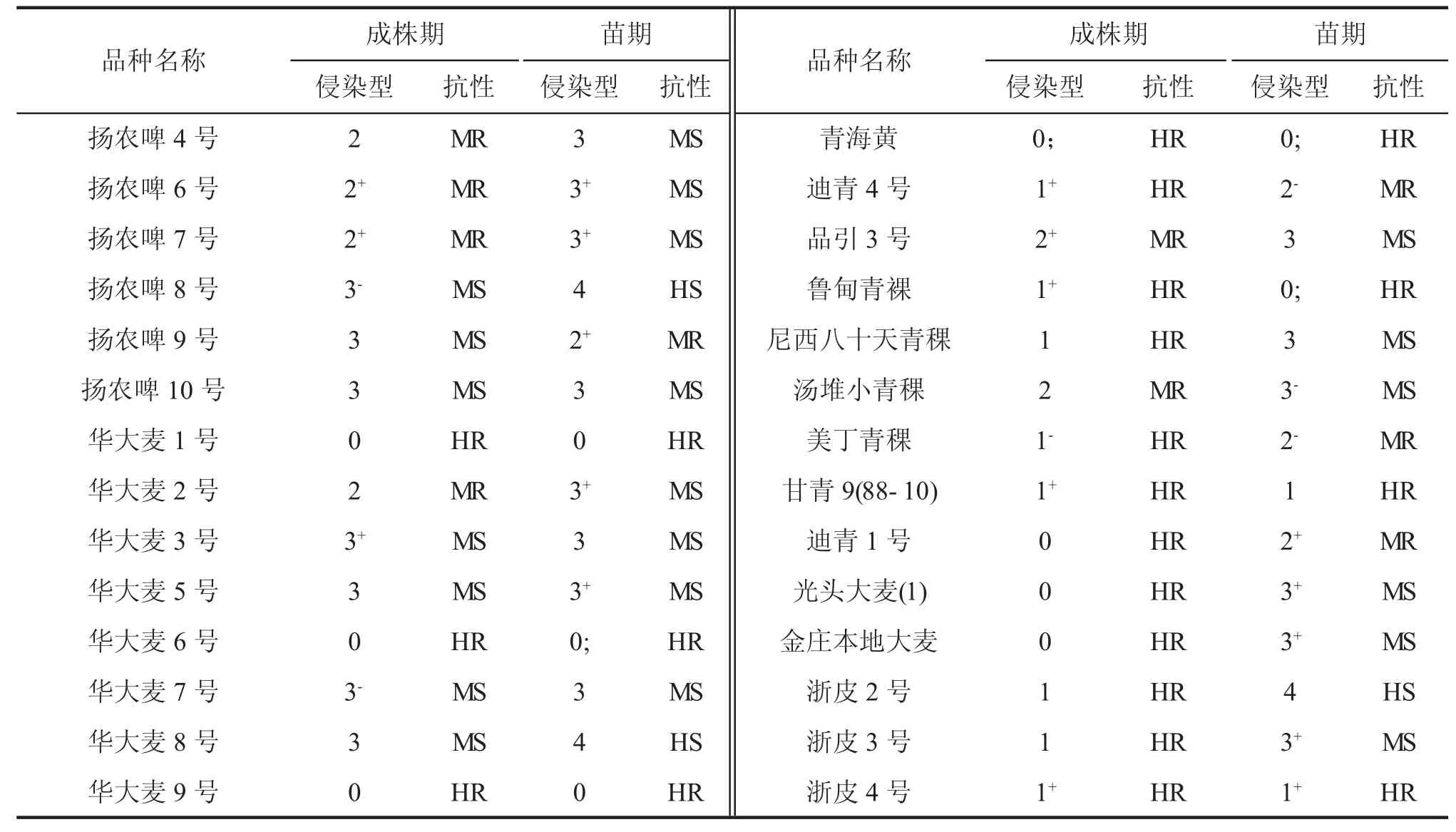
续表

图2 大麦品种(系)苗期和成株期抗白粉病类型鉴定
3 结论与讨论
大麦白粉病是我国大麦生产上的重要气传病害之一,在冬大麦区包括浙江、江苏、湖北、安徽、福建和春大麦区云南及西藏能造成严重的经济损失[7,12]。特别是在云南、福建和浙江,白粉病为害尤为严重。近年来,由于受全球气候变暖的影响,我国白粉病发生为害情况和主要流行分布区域发生了明显变化,尤其是在青稞主产区西藏白粉病为害日益加重,流行区域从南部林芝地区向北逐步扩展蔓延。目前,拉萨河流域也是白粉病的常发流行区,西藏多数青稞栽培区域均发生白粉病。类似小麦白粉病,大麦白粉病病原菌可以通过气流远距离传播,病原菌群体间跨地区交流频繁[15]。云南是我国西南地区大麦白粉病的主要菌源地,自然条件下普遍存在有性生殖,因而病原菌群体毒性变异频率高,群体毒性结构复杂,但在西藏林芝地区自然条件下极少发生白粉菌有性杂交并形成子囊壳。在本研究中也发现,云南菌株的毒性频率比来自西藏林芝地区的菌株的毒性频率高,毒性谱更宽。这种现象的出现不仅与环境条件有关,寄主抗性的选择压力也是促进病原菌毒性变异的重要原因。因白粉病的持续严重为害,云南皮大麦和裸大麦(即青稞)抗病育种中更重视将抗病基因引入育种体系,从而加大了对病原菌群体的抗性选择压力,促进病原菌毒性变异。同时笔者发现,西藏和云南白粉菌群体并没有完全隔离,2 个群体之间存在一定程度的交流。目前,还缺乏证据表明林芝是我国西南地区另一个大麦白粉菌菌源地。已经鉴定出100 多个大麦抗白粉病基因,但大多数抗病基因由于病原菌流行优势小种更替而“丧失”抗病功能,仍在利用的如mlo等抗病性持久稳定的基因较少[16]。在本研究中也发现部分抗病基因已经“丧失”对鉴定的8 个菌株的抗病功能,在生产上不能继续使用这些基因。
相比其他气传真菌病害,白粉菌群体毒性变异频率更高,致病类型更丰富,因而抗病基因有效使用寿命更短。因此,不断筛选和发掘抗病基因尤为重要和迫切,也是培育抗病大麦新品种的前提和基础。大麦在我国长江流域中部地区、东部地区和西南地区具有悠久的栽培历史,这些区域也是白粉病主要流行区域,因而在我国大麦资源中也存在重要的抗病遗传资源[7]。在本研究中,利用苗期人工接种鉴定并结合成株期在病害常发区利用病原菌自然群体进行成株期抗病性鉴定,获得92 份全生育期高抗材料和97 份具有成株抗性材料。这些材料为我国大麦白粉病抗病育种提供了重要的抗病基因资源。
白粉病是欧洲国家大麦上非常重要的叶部病害之一,因而其特别重视大麦抗白粉病基因发掘和利用[16-17]。国内有关大麦抗白粉病工作投入相对较少,目前已从种质资源中筛选获得了抗病材料[18]。利用多基因聚合方法[19],已有育种家利用有效抗白粉病基因转育到农艺性状优良的主栽品种中进行抗病性遗传改良,利用大麦白粉菌自然菌源对回交后代株系进行抗病性选择。大麦抗病基因的选择压力、病原菌长距离传播和有性重组是促进白粉菌群体毒性结构改变和遗传进化的主要因素[20]。因此,更应积极挖掘新抗源,改良大麦品种抗病性,及时淘汰感病品种,合理布局抗病品种。这也有利于稳定大麦白粉菌群体的毒性结构,降低新流行小种的出现频率。

