基于人乳头瘤病毒初筛的海南省农村女性子宫颈癌筛查结果分析
罗庆 董春波 黄翠敏 劳海红 窦倩如 黄垂灿 樊利春
1海南省妇女儿童医学中心,海口,570206;海南医学院公共卫生学院,海口,570102
宫颈病变是我国持续存在的公共卫生问题,特别是在经济文化发展较为落后的农村地区,由宫颈癌引起的高死亡率尤为突出[1]。持续的高危型人乳头瘤病毒((High-risk Human Papillomavirus, HR-HPV))感染是宫颈癌发生进展的最主要影响因素,因此,早期开展基于HPV检测的宫颈癌初筛是有效预防和控制宫颈癌的最佳手段[2]。由于我国HR-HPV感染分布具有明显的区域性,加之海南地区基于HR-HPV检测的宫颈癌筛查工作报道尚不充分[3-7],故本研究旨在基于海南农村女性大规模的宫颈癌筛查,了解海南农村女性HR-HPV感染现状,为宫颈癌的早期防治及筛查政策完善提供一定的参考。
1 资料来源与方法
1.1 研究对象
2015-2017年对海南农村地区5个县35-64周岁女性进行宫颈癌检查。受检者须符合以下条件:非月经期内做检查;受检者于样本采集前3天内不能做阴道冲洗或使用阴道内药物;检查前24小时内不能同房或盆浴;孕期内检查需要咨询医生;采用妇科检查常用体位取样。
共60618名女性参与HPV初筛。后续细胞学检查失访率为20.16%(1041/5163)、阴道镜检查失访率为11.31%(321/2837)和病理组织学检查失访率为17.37%(209/1203),失访1571人,实际筛查完成59047人。
1.2 研究方法
1.2.1 HR-HPV检测。使用高危型人乳头瘤病毒核酸检测试剂盒,采用实时荧光定量PCR技术分型检测HPV-16、-18;不分型检测12种高危型,包括HPV-31、-33、-35、-39、-45、-51、-52、-56、-58、-59、-66、-68。
1.2.2 细胞学检查。细胞学检查诊断标准采用TBS系统分级判读,结果包括未见上皮内病变及恶性细胞、不明确意义非典型鳞状上皮细胞、低度鳞状上皮内病变、非典型鳞状上皮细胞-不除外上皮内高度病变、高度鳞状上皮内病变、鳞状细胞癌。
1.2.3 阴道镜检查。阴道镜所见:①正常;②异常,包括低度病变,高度病变,非特异性改变,可疑浸润癌,其他。
1.2.4 宫颈组织病理学诊断。宫颈组织病理学诊断结果分为正常组、低级别上皮内瘤变(CIN1)、高级别上皮内瘤变(CIN2/3)、宫颈癌(CA)。本研究将CIN2CIN3原位腺癌宫颈癌归为CIN2+。
1.2.5 计算指标。根据《子宫颈癌检查质量保障及质量控制指南》[8],确定计算指标如下:
子宫颈癌前病变=CIN2+CIN3+原位腺癌
子宫颈癌=浸润癌+微小浸润癌
早诊=CIN2+CIN3+原位腺癌+微小浸润癌

1.3 统计学方法
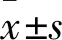
2 结果
2.1 调查对象基本情况
共筛查60618例农村女性。HR-HPV阳性组和阴性组民族和文化程度之间的差异不具有统计学意义,而HR-HPV阳性组的平均年龄大于阴性组,见表1。
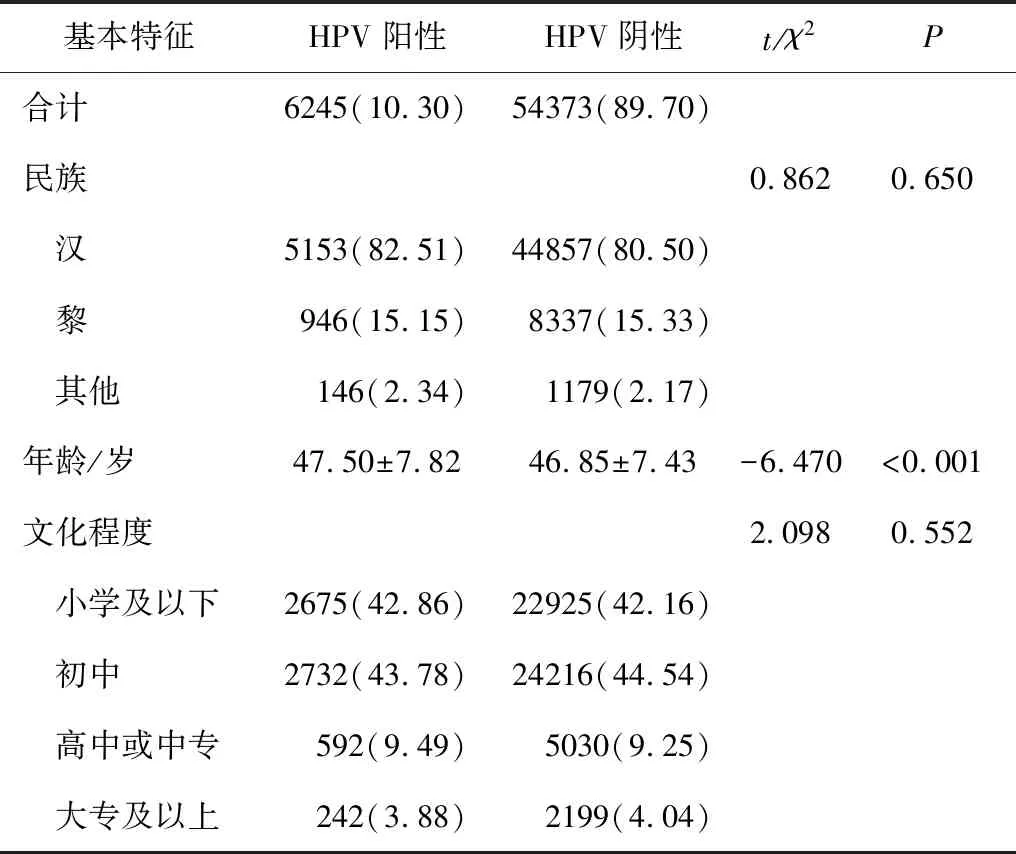
表1 两组筛查对象人口学特征比较 n(%)
2.2 HR-HPV筛查结果
HR-HPV阳性检出率为10.30%,其中HPV16/18检出率为1.61%,其他12种高危型检出率为8.73%。在6245例HR-HPV阳性中,阳性感染人次数为6284,其中HPV-16、HPV-18和其他12种高危型检出率分别占11.30%(710/6284)、4.49%(282/6284)和84.21%(5292/6284)。
不同年龄段研究对象HR-HPV检出率,35-50岁处于平稳期,从50岁开始逐渐上升,到65岁出现小高峰。见图1。

图1 HR-HPV年龄别检出率
2.3 不同特征女性细胞学检查和组织病理学结果
参加细胞学检查4133人,异常检出率为12.29%。细胞学检查结果发现≥ASC-US组汉族和其他民族的比例均高于NILM组,另其初中、大专及以上比例也高于NILM组;在年龄方面,两组之间不存在统计学差异(表2)。

表2 不同特征女性细胞学检查比较 n(%)
组织病理学检查结果发现≥CIN2+和CIN1在不同民族、年龄和文化程度方面的差异均不具有统计学意义,见表3。
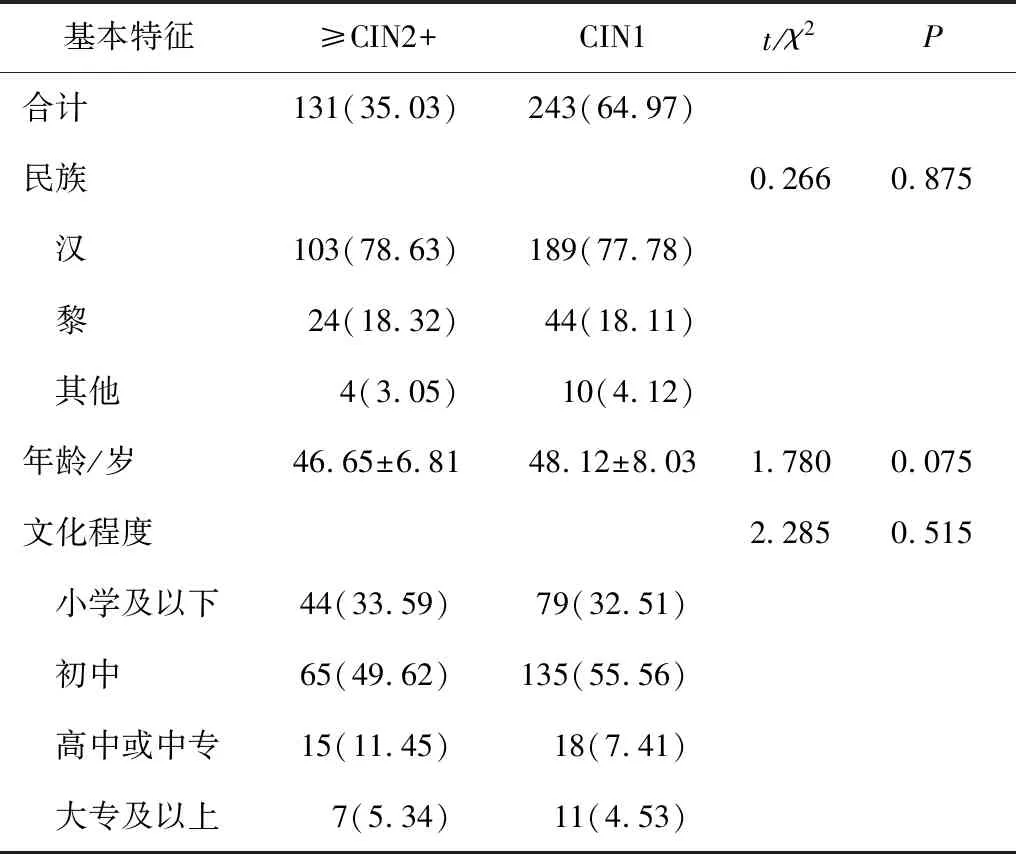
表3 不同特征女性组织病理学检查比较 n(%)
2.4 宫颈癌及癌前病变检出情况
实际筛查59047例,共检出宫颈癌8例,宫颈癌前病变123例,早期诊断人数126例;癌前病变检出率为208.31/10万;子宫颈癌检出率为13.55/10万;子宫颈癌及癌前病变检出率221.86/10万;早诊率为96.18%。CIN2+患者治疗率为88.70%。
CIN2+患者HR-HPV阳性中归因于HPV16/18感染为54.96%。HR-HPV阳性者宫颈癌和癌前病变检出率为2.10%,见表4。

表4 不同HPV分型宫颈癌及癌前病变检出情况 n(%)
不同型别HR-HPV的细胞学检查、阴道检查和组织病理学检查结果间均存在统计学差异。HPV-16/18型感染组细胞学≥ASC-US检出率、阴道镜异常率及组织病理学≥CIN2+检出率均大于其他12型HR-HPV感染组(表5)。
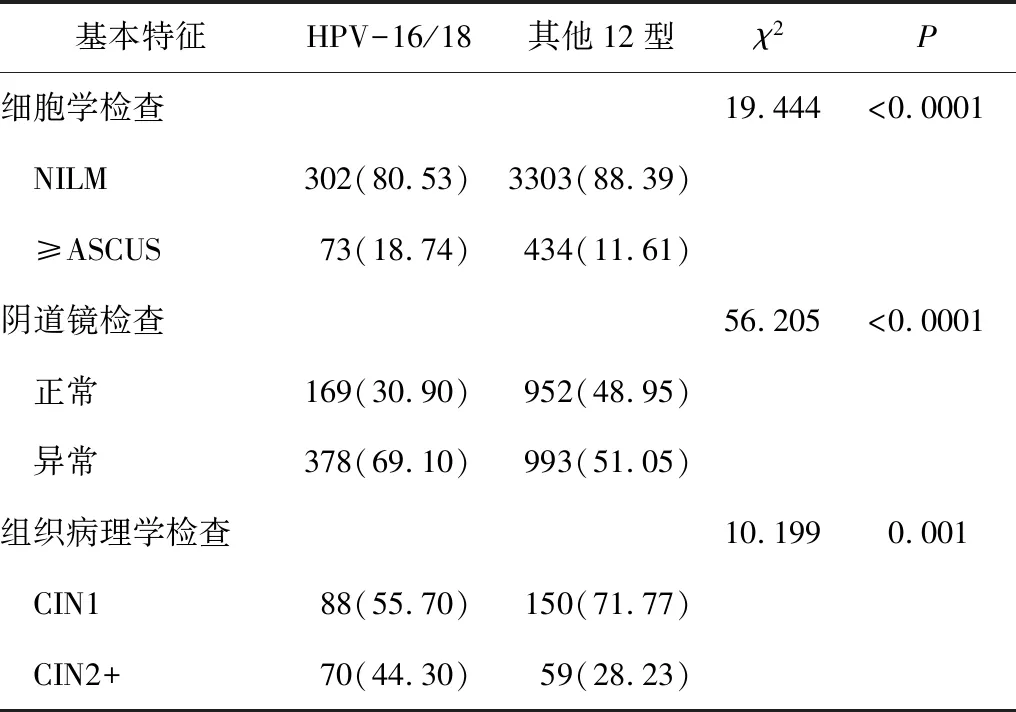
表5 不同HR-HPV分型各项筛查结果比较 n(%)
3 讨论
3.1 年龄是HR-HPV感染的主要影响因素
本研究中,海南农村女性HR-HPV感染率在35-50岁保持平稳,从50岁开始逐渐上升,到65岁出现小高峰。与Bruni L等人研究一致[9],但与赵方辉等人的研究中41-45岁组出现高峰的情况不同[10]。结合闫志强等人对海南地区HR-HPV持续感染的危险因素研究可知[11],年龄大于60岁是HR-HPV感染的影响因素。一方面是因为老年人往往具有在不良卫生行为习惯,营养不良及保健意识缺乏,且大年龄段女性免疫功能随着年龄下降,清除新发感染的能力下降。另一方面可能是60岁以上的女性多处于绝经期,由于激素分泌和宫颈鳞状细胞层较薄等原因,导致该年龄段的HPV感染率较高。HPV16/18感染率不同年龄段趋于平缓,与井立鹏等人研究相同[12]。海南黎族和汉族农村女性HR-HPV感染没有差异,与何金龙等人研究结果相同[7],显示HR-HPV感染在民族间没有差异。
研究表明年轻女性的HPV感染及其引起的子宫颈低级别病变的频率很高,但绝大多数都会在短期内自动消失[2]。而本次研究发现HPV16/18感染率不同年龄段趋于平缓,这可能提示高危型HPV-16/18感染后,即使在免疫力较强的低年龄段,其清除率仍较低。表明HPV-16/18感染后在各个年龄段的清除率均较低,且本次研究发现HPV16/18感染组的细胞学检查≥ASC-US检出率、阴道镜异常率及组织病理学≥CIN2+检出率均大于其他12型HPV感染组,因此建议对HPV-16/18感染人群进行早期干预和治疗,以降低后续子宫颈病变的发生率。
3.2 海南省HR-HPV初筛的检查项目总体执行情况较好
海南省农村35-64岁女性HR-HPV感染率为10.30%。低于既往系统评价和多中心研究报道的感染率(16.3%)[9-10],但高于北京同年龄段农村妇女阳性检出率(7.6%)[13]。本研究相对较低的感染率,可能是因为海南农村地区35-64岁女性基本处于已婚状态,且本研究不包含35岁以下感染率较高的性活跃人群。但目前的筛查项目覆盖率较小,应进一步扩大筛查覆盖人群,及早筛查出HR-HPV感染女性,进行长期随访,形成定期筛查随访机制。CIN2+HPV阳性妇女有71.4%归因于HPV16/18感染[14],本研究中归因于HPV-16/18阳性CIN2+为54.96%,高于其他高危12型。但其他高危12型中也筛查出较多的癌前病变和子宫颈癌,故以14种高危型HPV检测为初筛的方法是有效的。
本研究子宫颈癌及癌前病变检出率221.86/10万;早诊率为96.18%,CIN2+患者治疗率为88.70%。均接近于2015年国家HR-HPV的子宫颈癌筛查试点项目(早诊率为94.36%,治疗率为88.17%-95.9%;西部地区子宫颈癌及癌前病变检出率为221.8/10万)。但宫颈癌及癌前病变检出率远低于全国平均水平364.02/10万,且HR-HPV阳性者宫颈癌和癌前病变检出率为2.10%,低于全国平均水平3.1%。一方面可能是海南省子宫颈癌患病率低,所以检出率低于国家平均水平;也可能是基层市县妇幼保健机构技术水平有限,在细胞学检查、阴道镜检查方面存在不足,存在漏筛情况;另本研究失访人群中可能也存在宫颈癌或癌前病变妇女,导致检出率偏低。
4 结论
海南省宫颈癌筛查整体水平较弱,建议国家和省级卫生行政部门应进一步争取各级财政资金,建设符合国家认证要求的宫颈癌培训基地,加强规范培训,提高基层一线医务人员筛查能力。
在扩大筛查过程中,医务人员要同步开展健康教育和咨询,促进广大农村女性正确认识HPV及宫颈相关疾病,子宫颈癌定期筛查的目的和意义,从而主动建立安全性行为,积极预防和治疗生殖系统感染等[15-17],增加已筛查妇女的依从性。注重HPV疫苗对子宫颈癌预防作用的健康教育,对注射HPV疫苗提供补助。将宫颈癌筛查与青春期前宫颈癌疫苗接种结合,可大大降低未来的宫颈癌负担[18-19]。
本研究存在一些不足。研究数据数据来源于国家重大公共卫生系统,筛查对象为海南省部分县35-64岁农村女性,结果外推到海南省全部农村女性尤其是35岁以下人群受限。且本研究未对除HPV-16/18外的其他HPV高危型别进行具体划分,不能了解海南省其他高危HPV感染具体基因型别的情况。

