自体外周血单核细胞移植治疗重度下肢缺血早期预后的影响因素分析
陈 路 胡何节 方征东 王晓天 孙小杰 葛新宝 程 灿
安徽医科大学附属省立医院血管外科,安徽 合肥 230001
外周动脉疾病(peripheral arterial disease ,PAD)限制了血流,受影响区域的血供减少,导致四肢动脉缺 血[1-2]。而PAD 中的严重下肢缺血(critical limb ischemia,CLI)是由多种类型的炎性疾病引起,包括糖尿病、闭塞性动脉硬化(arteriosclerosis obliterans,ASO)和血栓闭塞性脉管炎(thromboangiitis obliterans,TAO),其特征是静息痛和下肢不愈合的溃疡[3]。国外研究显示,持续反复发生缺血性休息疼痛或溃疡,或足部或脚趾坏疽,并持续> 2 周即可诊断为CLI[1]。目前治疗CLI 的主要方法是动脉旁路手术或腔内治疗[4],但40%CLI 患者因为动脉硬化病变的位于远端流出道血管或病变过于广泛而无法接受外科或介入手术[5],需要进行截肢手术。而自体外周血单核细胞(auto-peripheral blood mononuclear cells,auto-PBMNCs)可缓解静息痛,促进溃疡愈合,挽救肢体的满意效果[4,6-8],可为不符合手术指标患者提供治疗新思路。然而auto-PBMNCs 移植后CLI 预后因素的变量国内外学者尚未达成统一意见,本研究探讨影响自体外周血干细胞移植治疗CLI 早期预后的影响因素,现报道如下。
1 资料与方法
1.1 一般资料
选取2004 年03 月 至2019 年06 月安徽医科大学附属省立医院收治移植auto-PBMNCs 82 例CLI 患者,66 例TAO,16 例ASO,男性75 例,女性7 例,16~88 岁,平均(45.98±14.52)岁。纳入CLI 患者Fontaine 分期为Ⅲ~Ⅳ期;术前下肢计算机体层血管成像(CT angiography,CTA)或其他影像学及实验室检查提示远端流出道差而考虑旁路手术或腔内手术效果不满意者甚至无法实施手术者;既往经过严格药物保守治疗而效果较差者;近5 年内无恶性肿瘤病史的患者。所有患者根据auto-PBMNCs 移植后视觉模拟评分(visual analogue scale/score,VAS),以及患者移植后早期的疼痛评分分为疼痛缓解组及疼痛加剧组,对两组患者以截肢作为评估移植后的最终疗效,其中截肢是指截除下肢肢体的任意部分。根据有无截肢分为预后良好亚组和预后不良亚组。
1.2 方法
(1) auto-PBMNCs 的动员和采集
所有患者于术前3 天均经粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)开始动员,并且在注射后的第3 天清晨空腹及在平卧制动状态下,立即采血复查血常规,采血前需测量体温,保证患者体温在正常体温波动范围内。待血常规结果回归以后,观察其中的单个核细胞计数,如果单个核细胞(marrow mononuclear cells,MNC)>30%时,携带患者前往输血科,使用血细胞分离仪3000 Plus,开始采集外周血单个核细胞,制备auto-PBMNCs 悬液。以每个手术肢体30~50 ml 浓缩成细胞悬浊液,浓缩完毕后的细胞悬液当中,MNC 为1×109/m1,细胞总数约为5×109/ml。
(2) auto-PBMNCs 移植
采集后的auto-PBMNCs 于3 h 内移植至患肢。术前先于患肢缺血部位取40~60 个注射点,各点间距2~3 cm, 深度1.0~0.5 cm,每点注射约0.7~1.0 ml 细胞悬液。术后当天即予以抗血小板、改善微循环处理,并根据每个患者不同情况予以个体化降压、降糖等处理,针对溃疡创面予以清创、换药,并随访。通过电话访问及门诊检查对患者进行随访,患者术后随访时间6 个月。所有auto-PBMNCs 移植患者在术后都严格接受了抗血小板(西洛他唑)治疗。
1.3 观察指标
统计所有患者入院时Fontaine 分期、吸烟史;移植 前的白细胞计数、血红蛋白计数、血小板计数、单核细胞计数、丙氨酸氨基转移酶计数、血肌酐、血尿素氮;入院后首次检测得到的空腹血糖、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白酶原;及注射后白细胞计数和单核细胞计数。
1.4 判定指标
各检查指标的正常参考范围:白细胞(3.50~9.50)×109/L; 血红蛋白(130.0~175.0)g/L;单核细胞(0.10~0.60)×109/L;血小板计数(125.0~350.0)×109/L;丙氨酸氨基转移酶(9~50)IU/L;血尿素氮(3.10~8.00)mmol/L;空腹血糖(3.9~6.1)mmol/L;PT(8.00~14.00)s;APTT(20.00~40.00)s;纤维蛋白原(1.70~4.00)g/L。
1.5 统计学方法
应用SPSS 21.0 统计软件对数据进行处理,计量资料采用()表示;计数资料采用n(%),组间比较采用χ2和Fisher 检验;移植后疼痛及预后不良的多因素分析采用Logistics 逐步回归分析,当P <0.05 时差异有统计学意义。
2 结果
2.1 临床疗效
术后3 d 无发热即出院,82 例患者术后1 个月未见明显并发症及不良反应。在术后1~6 个月内,通过门诊随访及电话回访,未见明显不良反应。
2.2 移植后疼痛及预后不良的单因素分析
移植前两组患者丙氨酸氨基转移酶比较,差异有统计学意义(P <0.05,表1);两亚组患者纤维蛋白原比较,差异有统计学意义(P <0.05,表2);移植后,疼痛加剧发生率14.63%(12/82);截肢率为15.85%(13/82)。其中9 例TAO 因疼痛加剧,截肢7 例;2 例ASO 疼痛加剧,截肢 6 例。移植后,两组及两亚组患者的白细胞和单核细胞计数比较,差异无统计学意义,见表1~2。
2.3 移植后疼痛及预后不良的多因素分析
将丙氨酸氨基转移酶和纤维蛋白原赋值后,纳入Logistics 逐步回归分析,移植前丙氨酸氨基转移酶> 50 IU/L 和纤维蛋白原≥4 g/L 是移植后疼痛加剧及预后不良的独立危险因素,见表3。
3 讨论
PAD 患者中1%~3%会进展至CLI[10],目前针对CLI 的治疗手段,血运重建是CLI 是治疗基础[10]。自2002 年,Tateishi 等[4]研究证明干细胞移植治疗CLI 有效以来。目前对无法接受手术的患者,多采取了外周血单个核细胞移植治疗这一简便、微创的方法。但针对早期患者术后出现预后不良的原因,国内外鲜有研究报告。本研究结果显示,移植前丙氨酸氨基转移酶>50 IU/L 和纤维蛋白原≥4 g/L 是移植后疼痛加剧及预后不良的独立危险因素。
丙氨酸氨基转移酶主要分布在肝细胞内,当肝细胞发生损伤或通透性受损的时候,丙氨酸氨基转移酶可由肝细胞内释放入血,有研究表示丙氨酸氨基转移酶异常的患者,心血管意外及代谢综合征的发生率升高[12-13]。目前多数代谢综合征患者的研究中均提示丙氨酸氨基转移酶异常为其危险因素,但其具体作用机制尚未明确。但当丙氨酸氨基转移酶升高时,患者的血脂已在血管内发生了沉淀。一项研究认为,冠脉狭窄与丙氨酸氨基转移酶呈相关性严重下肢缺血的研究中,天冬氨酸转移酶与丙氨酸氨基转移酶之比(AAR)>1.67 的患者,预后较其他AAR 低于此值者明显较差[14]。上述研究结果也引起了广泛关注,在本研究中丙氨酸氨基转移酶在疼痛分组中比较,差异有统计学意义,但本研究结果仅认为丙氨酸氨基转移酶>50 IU/L,可以对患者疼痛恢复产生影响。
纤维蛋白原是一种由肝脏细胞合成和分泌的糖基化蛋白,大多数情况下纤维蛋白原被认为单纯血栓形成因素,而目前越来越多的研究证明纤维蛋白原作为动脉粥样硬化的独立危险因素,纤维蛋白及其降解产物参与了血栓形成和动脉粥样硬化的发展过程[16]。其中,降解产物中的二聚体片段沉积于血管壁可使动脉发生硬化改变。另外,动脉硬化是缺血性事件常见的病理基础,其主要原因是由于内皮细胞损伤导致。研究认为增高的纤维蛋白原在一定程度上可以影响内皮细胞的功能,从而促进动脉硬化的发生和发展[17]。也有研究从TAO 动物模型中发现,坏疽症状时,内皮细胞损伤严重,从而形成血栓[16]。而外周血单核细胞移植的其核心主要是通过含有内皮祖细胞的单个核细胞进行移植进而让内皮祖细胞分化为内皮细胞促进新生血管,最终治疗缺血性疾病。这也证实了本研究结果。
纤维蛋白原在一定基础上对动脉管腔的再狭窄有着不可或缺的影响,也论证本研究中高纤维蛋白原为患者预后不良的危险因素可能。两预后亚组患者纤维蛋白原比较,差异有统计学意义。因此,纤维蛋白原>4 g/L 的患者在auto-PBMNCs 治疗后更需要严格的抗血小板和或抗凝治疗。综上所述,丙氨酸氨基转移酶>50 IU/L 是患者术后疼痛加剧的危险因素,纤维蛋白原>4 g/L 是患者术后发生截肢的危险因素。

表1 两组患者auto-PBMNCs 移植后疼痛加剧的单因素分析

表2 两亚组患者auto-PBMNCs 移植后预后不良的单因素分析
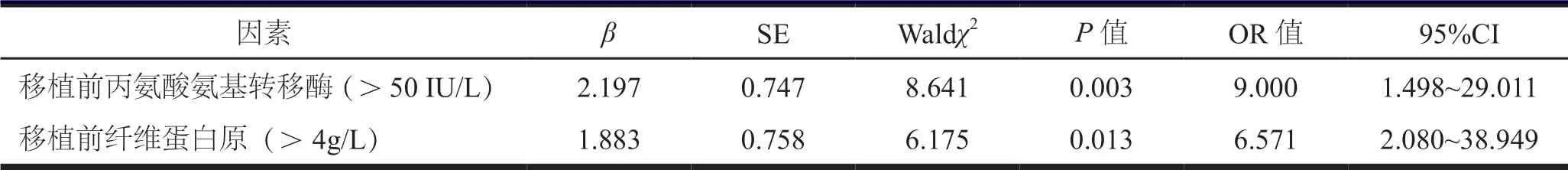
表3 移植后疼痛及预后不良的多因素分析

