香辛料食品安全风险因子研究进展
明 玥,梁志宏
(北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083)
香辛料是指来源于植物特定部位的天然调味料,可促进食品增香、调味,并突出风味特征。香辛料种类繁多,分类方法有多种,根据产品的存在形式,香辛料可分为完整型、粉碎型香辛料以及香辛料提取物等;也可根据产品的性能进行划分,分为以芳香为主的,以脱臭为主的和以促进食欲为主的香辛料。其中,最为常见的香辛料有辣椒、花椒、大蒜、胡椒等,它们被广泛应用于食品烹调与加工中。据相关行业统计,2016年我国的香辛料年进出口总量高达200万吨,近几年来复合香辛料更是受到了人们的追捧[1]。
在全球食品安全领域中,化学性和生物性污染仍然是值得关注的重点问题。香辛料作为常见的植物性原料,具备普遍作物的生长特征,能够从土壤中汲取重金属、农药等,这种生物富集的过程大大增加了化学污染的可能性[2]。另外,由于香辛料植物大多产自热带和亚热带地区,气候潮湿,再加上原料中含有大量的碳水化合物以及有机酸等,导致其在生长、运输、加工以及销售的过程中容易受微生物污染[3]。目前,国内关于香辛料的食品安全风险研究较少,主要原因在于香辛料种植面积小,种植较为分散,膳食消费量小。除此之外,由于香辛料具有水分活度低、蛋白含量少的属性,未被纳入微生物相关指标检测的范围之内,人们更加关注加工的过程性污染[4]。
随着香辛料的市场需求量不断增大,其食品安全风险因子以及有效的防控措施愈加重要。目前,香辛料的食品安全主要受真菌毒素和微生物、重金属污染、塑化剂污染、农药残留等四大风险因子影响,其中真菌毒素和微生物的污染、重金属污染是主要的污染形式,尤其生物性污染不仅会引起香辛料品质下降,食品风味改变,还会对人体健康造成严重损害[5],是影响食品安全的主要因素。本文通过对风险因子的污染途径、毒性以及产生情况展开论述,为香辛料的食品安全监控提出有效管理措施。
1 真菌毒素和微生物的污染
1.1 微生物的污染途径
真菌毒素是香辛料不可避免的污染物。与果蔬产品不同的是,香辛料在采收后不会通过水洗、浸泡、加热等常规操作进行清洗或减少微生物残留,因此在贮藏、加工以及流通环节,香辛料更易受到微生物的侵染[6-7]。另外,香辛料的产地多属于热带和亚热带气候,炎热潮湿,降雨量丰富,广泛分布在土壤和水环境中,特别适宜真菌生长,极易造成香辛料的污染。
ND:未检测出(低于检测限);有效数字来源于原文献。

表2 香料中赭曲霉分离株产毒率及赭曲霉毒素A污染水平Table 2 The yield of A. ochraceus and contamination levels of ochratoxin A in spices
1.2 主要真菌毒素的污染
1.2.1 黄曲霉毒素(Aflatoxins) 黄曲霉毒素是由黄曲霉和寄生曲霉菌株产生的杂环化合物,主要代谢产物包括B1、B2、G1、G2、M1、M2等,可造成免疫抑制、生殖毒性和神经毒性等。其中AFB1的毒性最强,具有二呋喃环并香豆素结构,化学性质稳定[8]。黄曲霉(Aspergillusflavus)为需氧微生物,最佳生长条件为25~40 ℃,相对湿度在80%以上,受环境因素影响较大[9]。陈莹[10]对黑胡椒中黄曲霉毒素的产生因素进行研究,发现温度、含水量以及贮藏时间对黄曲霉毒素的产生有显著性影响。
目前,关于香辛料中黄曲霉毒素污染的相关报道大多集中在各地市场调查(详见表1)[11-13]。另外,不同黄曲霉毒素在香辛料中的含量具有显著性差异。Bokhari[14]对产自沙特阿拉伯的香辛料进行黄曲霉毒素含量测定,未检出AFG1和AFG2,而AFB1为最主要的黄曲霉毒素;Potorti等[15]发现,产自意大利和突尼斯的香辛料大多数样品中检测出AFG2,几乎所有被污染的迭迭香中存在AFB2和AFG2,并且部分香料中AFB2和AFG2具有协同毒性。
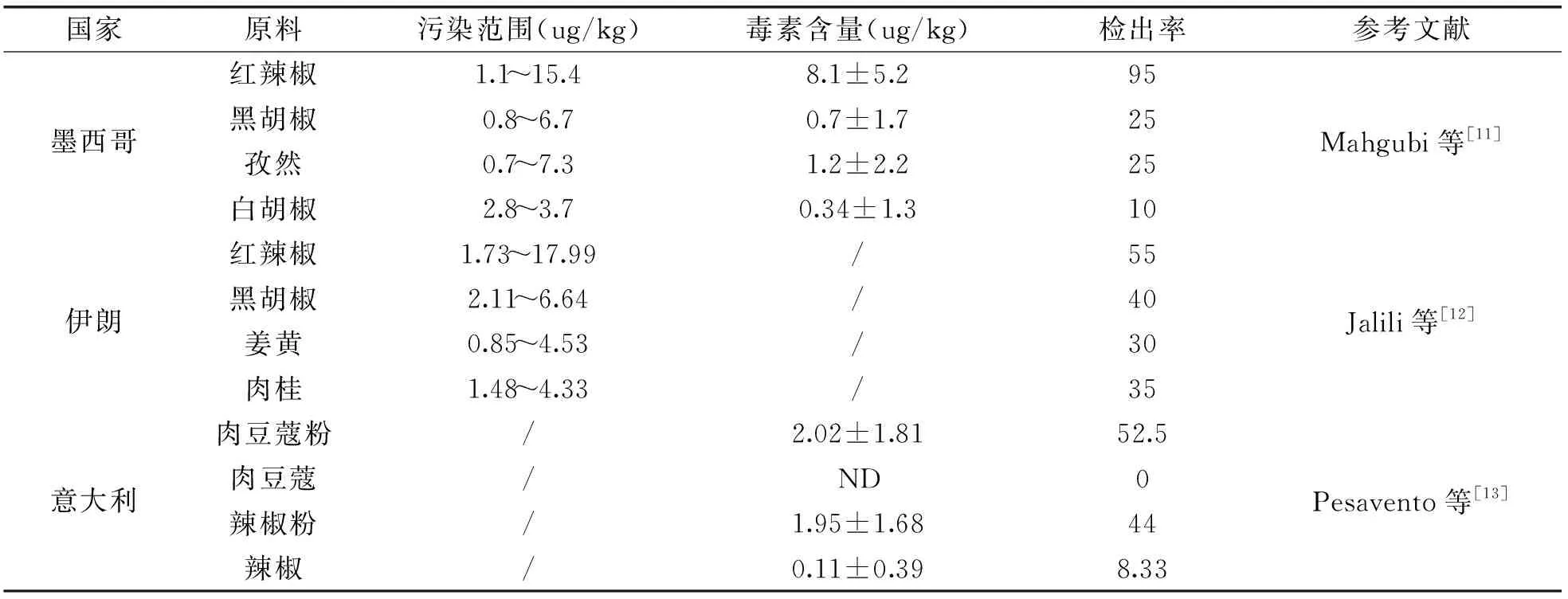
表1 不同国家香料中黄曲霉毒素B1污染水平Table 1 Contamination levels of AFB1 in spices for different countries
1.2.2 赭曲霉毒素(Ochratoxins) 赭曲霉毒素主要是由曲霉属和青霉属真菌产生的一类次生代谢产物,其中赭曲霉毒素A(OTA)毒性最大,具有肾毒性、致癌性、致畸性以及免疫抑制作用等,是除黄曲霉毒素之外最常见的一种真菌毒素。目前已有实验证明,赭曲霉(A.Ochratoxin)的生长温度范围较广,即便在低温条件下,也可缓慢生长及积累OTA,因此具有较为广阔的污染谱[16]。Nguegwouo等[19]选择黑胡椒和白胡椒作为研究对象,统计OTA的污染数据以及香辛料的日摄入量,计算出白胡椒中OTA的每日摄入量为0.70 ng/kg,黑胡椒为0.18 ng/kg,同时发现样品中40%的白胡椒受OTA污染,远高于黑胡椒。Makhlouf等[20]却认为,白胡椒与黑胡椒相比,去除果皮可实现减少真菌负荷的作用,污染程度会更低。
1.2.3 其它真菌毒素 除黄曲霉毒素和赭曲霉毒素之外,在香辛料中还存在其他真菌毒素,例如伏马毒素(Fumonisin)、T-2毒素等。伏马毒素主要由串珠镰刀菌(Fusariummoniliforme)产生,是一种水溶性的代谢产物,其中伏马菌素B1是发挥毒性作用的主要成分,具有神经毒性、细胞毒性以及生殖毒性等。Bokhari等[14]发现,OTA污染水平较高的样品中同时存在伏马菌毒素B1,污染样品在50%左右。另外,有研究表明,传统香辛料中伏马菌素B1和T-2毒素的脱除取决于真菌在籽粒表面上的定植和真菌毒素的积累,但毒素可能因为湿法去皮工艺,进入香辛料籽粒内部,扩大污染范围[21]。
目前,黄曲霉毒素是进出口食品的主要污染物之一。自2015以来,韩国对我国出口的辣椒产品口岸检查较为严格,从扣留的产品类型来看,辣椒粉中存在严重的黄曲霉毒素超标,主要原因在于辣椒干原料以及辣椒粉成品的储存条件和温湿度难以控制[22-23]。研究表明,香辛料的优势菌种为黄曲霉和黑曲霉(A.niger),污染的毒素主要为黄曲霉毒素和赭曲霉毒素[24]。根据国家农业部发布的《绿色食品 香辛料及其制品》(NY/T 901-2011)中规定,干制香辛料和香辛料调味粉中黄曲霉毒素(B1、B2、G1、G2总量)≤10 mg/kg,黄曲霉毒素B1≤5.0 mg/kg,赭曲霉毒素A≤3.0 mg/kg。而欧盟委员会条例(EU)2015/1137中规定,在辣椒属香料中赭曲霉毒素A的最大限量为20 μg/kg,在混合香辛料中的最大限量为15 μg/kg。
2 重金属污染
2.1 重金属的污染途径
重金属是指在土壤中浓度小于0.1%,或在生物体中小于100 mg/kg的金属[25]。通常重金属是一类微量元素,其中部分金属例如镉(Cd)、汞(Hg)、(砷)As、(铬)Cr、铅(Pb)等,具有显著生物毒性,可对人体的生理机制造成损害[26]。香辛料作为一类小宗作物,从土壤中吸收营养物质的同时,也受到重金属的污染。其污染途径主要体现在两个方面,一是重金属通过污水灌溉和填埋垃圾等方式进入到香辛料植物体中;二是大气污染和汽车运输会产生大量的粉尘,通过降雨和自然沉降的方式进入土壤,或通过叶片吸附,造成污染[27]。
香辛料对重金属的吸收是一个复杂的生理过程,有研究表明,重金属可以从根际土向香辛料植物迁移,其迁移能力和重金属、香辛料种类有关[28]。由于重金属在食物链的作用下可被人体摄入并积累,并且与大部分农作物相同的是,香辛料主要受铅、镉等重金属污染,因此控制香辛料中的重金属污染是十分必要的。
2.2 主要重金属的污染
2.2.1 镉 镉,在Cd、Hg、As、Cr、Pb五种重金属污染物中位于首位,是衡量香辛料重金属污染的重要指标。有研究表明[29-30],有效态的镉元素与植物体中镉含量密切相关,而在耕作土壤中,其主要以有机结合态、残渣态和铁锰结合态的形式存在,拥有较高迁移率,是镉富积的主要原因,其含量大概为镉总量的29%~42%。Adeyolanu等[31]研究发现,植物体根部的位置可能与土壤中镉含量分布有相同之处,这可能会有助于植物根部对镉的吸收。有效态镉对香辛料而言,具有一定的结合能力,镉元素对香辛料存在潜在的污染。
目前的研究主要集中于镉的污染特点和积累程度。杨晓磊等[32]通过对镉元素在土壤-辣椒系统中的变化形式进行研究,发现土壤中镉含量越低,辣椒对镉的富集效应越强,后期逐渐趋于平缓,并呈现根>茎>叶的形式。Baig等[33]发现巴基斯坦市场上的五香粉、茴香黑豆蔻、肉桂等镉含量菌超过WHO限量标准。而Chizzola等[34]认为,镉元素的分布与植物体种类有关,只在具有富集倾向的植物中过度积累。此外,有研究表明,镉处理能促进根、茎、果实对镉的进一步吸收,扩大污染程度。但同时,镉元素的吸收也会同其他金属元素产生拮抗或促进作用,例如镉和铅的复合处理可以增加两者的吸收量;而在对植物体进行单一的镉处理时,会显著提高铅、锌含量,并降低锰、铜含量[35-36]。
2.2.2 铅 铅,作为重金属污染的主要元素之一,可对香辛料植物的生理功能造成巨大影响。相关研究表明[31,37-38],植物体通过根部吸收和叶面吸附两种方式摄入铅,但由于铅元素在土壤中的存在形式主要为结合态,移动性较差,不易进入植物体内,即使进入植物体内,也易与根部组织中的Fe、Al、Mn氧化物和磷酸盐等结合形成共价键。因此,部分以根部吸收方式为主的香辛料,例如白芷、姜黄等,容易被铅污染。
在近年中,关于植物体中铅的吸收、转运及积累是研究热点之一。研究表明,香辛料植物的种类与铅污染水平存在相关性。在埃及出口的香料中,马郁兰的含铅量最高,达到14 μg/g,孜然、茴香的含铅量偏低,在1.5 μg/g左右[28]。另外,香辛料植物各部位对铅的吸收能力是不同的。黎佳佳等[36]发现铅在辣椒叶中的累计率高于茎、根和果实,可以推断叶面吸附对辣椒累计铅元素的贡献更大。Adeyolanu等[39]对罗勒叶研究也得到相反的结论:该香料叶、茎、根中铅离子含量依次呈上升趋势,说明罗勒叶根部的吸附能力更强。
目前研究资料表明,污染最严重的为铅、镉两种重金属元素。我国农业部发布的《绿色食品 香辛料及其制品》(NY/T 901-2011)中规定,干制香辛料和即食香辛料调味粉中铅的限量标准为≤1.0 mg/kg,镉的限量标准为0.10 mg/kg。
3 其它风险物质污染
3.1 塑化剂污染
塑化剂,是指一类常见的高分子材料助剂,能够添加至聚合物体系中,增强聚合物的塑性、柔韧性[40]。其中,邻苯二甲酸酯类是应用最为广泛的一类塑化剂,易溶于有机溶剂。
研究发现,邻苯二甲酸酯类的分子结构与生物体中内源性激素具有相似性,能影响人体激素水平,严重损害人体健康[41]。近期研究表明[40,42],塑化剂与聚合物基体一般以共价键的形式存在,稳定性较差,在贮藏和加工过程中,塑化剂会脱离聚合物基体,以固、液、气体的形式迁移至食品中。贮藏时间、温度以及包装材料的性质和材料均会影响塑化剂的迁移效果,例如邻苯二甲酸二异丁酯(DMP)、邻苯二甲酸二辛酯(DEHP)等可在较高温度或较长放置时间时被检出。而香辛料在贮藏过程中多采用塑料制品进行包装,随着时间延长,香辛料成为塑化剂的载体。另外,塑化剂可能存在于土壤中或在加工器具表面,对香辛料造成污染。
目前,欧洲国家比较重视塑化剂在香辛料中的污染情况。Giuseppa等[43]通过GC/MS测定了意大利和突尼斯的香辛料中塑化剂含量,发现邻苯二甲酸二丁酯(DBP)、对苯二甲酸二(2-乙基己)酯(DEHT)以及己二酸二甲酯(DMA)等是主要污染物(详见表3)除此之外,Turco等[44]对地中海地区多个国家的香辛料残留情况进行研究,通过估计香辛料中塑化剂的危害指数,发现产自阿尔及利亚的香辛料中,DBP的危害指数最大。
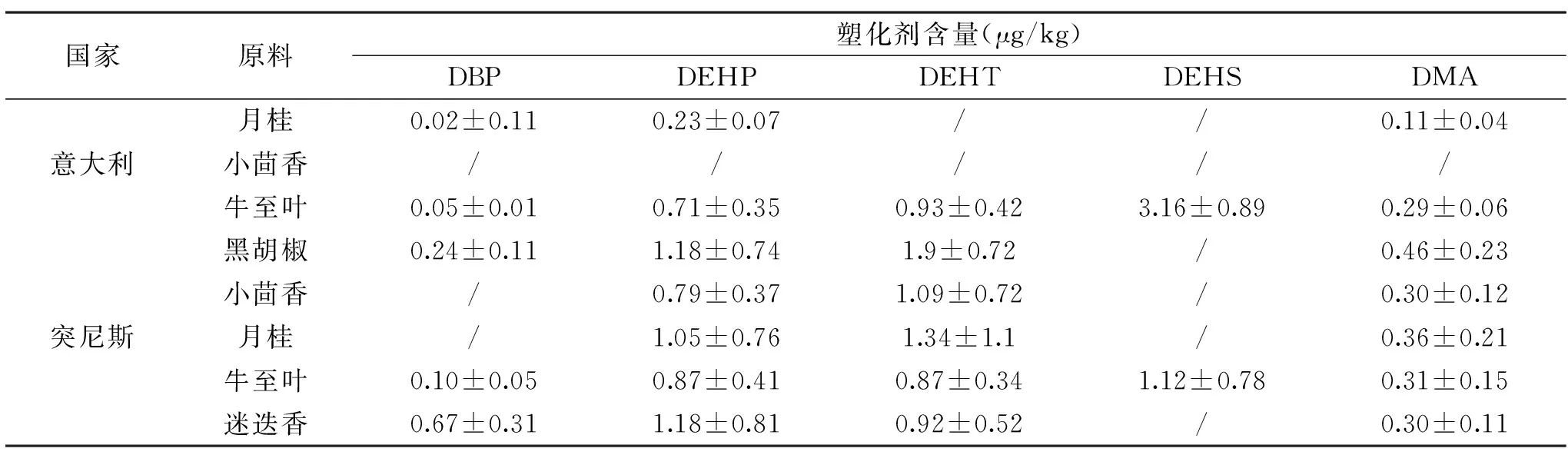
表3 不同国家香辛料中塑化剂污染水平[43]Table 1 Contamination levels of plasticizers in spices for different countries[43]
3.2 农药残留
我国的农药产量位居全球第一,国内大面积推广农药防治病虫害,这是导致香辛料制品农药残留超标的首要原因。另外在贮藏过程中,也常使用农药作为杀虫剂,增加了农药污染的风险。目前,广泛用于香辛料种植的农药主要包括有机磷、有机氯和氨基甲酸酯等,虽然其使用量较少,但农药残留具有累积效应,可通过多次摄入致毒。Azanu等[45]检测发现,香料的有机氯农药浓度均未超过WHO最大残留限量,但已接近于该限量。另外研究发现,85%的香料含有二氯二苯三氯乙烷(DDT),最高浓度可达90 μg/kg。而Sanhera等[46]研究发现在贮藏10 d之后,农药可降解至83.45%~78.65%,此外没有更多关于贮藏周期的数据可以证明农药污染必然降至安全限值以下。
4 相关风险物质的监控手段
4.1 真菌毒素和微生物污染监控
香辛料易受到产毒菌株的污染,造成毒素的积累,因此加工和贮藏过程为监控关键控制点。真菌毒素的产生不仅受到外界环境的影响,同时也与菌株本身存在关联。在香辛料中,产毒菌株的存在是造成真菌毒素污染的主要原因,因此对产毒真菌和潜在真菌毒素的监控是十分必要的。
4.1.1 有关微生物的监控
4.1.1.1 微生物的数量和类群监控 微生物的数量直接反映了香辛料受污染的程度。在生产加工方面,根据农业部颁布的《NY/T 2651-2014 香辛料辐照质量控制技术规范》中提到辐照前后要对香辛料中的微生物指标进行监测。目前,常用的监控手段包括:直接观察法和平板培养法,其中直接观察法是通过观察香辛料外观色泽、质地、菌斑的有无以及长毛等特征,判断霉变情况,但该类特征只有在微生物数量达到一定程度时才能反映出来,具有滞后性,并且也只能帮助监控人员进行粗略判断[47]。而平板培养法较为准确,可通过平板稀释倍数判断微生物的数量,但该种方法培养时间较长,也无法获得实时信息。
4.1.1.2 微生物的产毒能力监控 微生物的活性强弱与产毒能力具有一定的相关性,因此,可通过监控自由基以及中间代谢物质的含量变化,实现对产毒能力的预测。活性氧(ROS)在真菌毒素合成中起到了调控作用,Narasaiah等[48]发现产毒菌株的ROS含量高于不产毒菌株,可通过检测微生物体内ROS水平研究微生物的产毒能力,但该方法受外界环境影响较大,存在局限性。相较于ROS,中间代谢产物的含量变化易于监测。姚冬生等[49]考虑到杂曲霉毒素是黄曲霉毒素生物合成的前体,从而开发一种用于监测杂曲霉毒素的电化学生物传感器,可有效监测前体物质的含量变化,从而实现对香辛料中黄曲霉产毒活性的监控。
4.1.2 贮藏环境的监控 贮藏环境的变化可能诱导产毒菌株的萌发。通过对香辛料贮藏环境中温度、湿度的监控,可以避免各项参数对霉菌生长产生正向效应,同时也可作为香辛料品质变化的一种监测手段。目前常用的监测设备是温度、湿度传感器,可实现实时、远程监控,避免香辛料贮藏过程中局部含水量或局部温度偏高,从而引起霉变[50]。另外,贮藏环境内的气体成分也是重要的监测指标。据研究,在香辛料的贮藏期间,其本身的呼吸作用较弱,而黄曲霉、灰绿曲霉等霉菌拥有较强的生理代谢能力,可产生大量的二氧化碳。刘焱等[51]研究发现,黄曲霉菌可迅速提高贮藏容器中的CO2浓度,增速达4.6倍。因此通过使用二氧化碳监测仪,可判断干生性真菌、产毒性真菌的生长情况,但对于产气能力较弱的真菌而言,监测装置不能及时反映生长情况[52]。
4.2 重金属污染监控
4.2.1 土壤环境的监控 汞等重金属进入土壤后,会迅速被土壤吸附或固定,并在土壤表层累积,其含量直接反映了土壤的重金属污染状况,因此土壤环境质量监控是关键。考虑到传统测定方法复杂繁琐,且监测效率低下,近年来国内外在土壤快速监测领域寻求解决途径。目前使用最为频繁的快速监测仪器为X射线荧光光谱仪,该仪器具有前处理操作简便、检测范围广等特点,其原理在于各种元素会产生特征X射线,通过测定X射线的波长和能量,定性或定量判断样品中各物质的种类和含量[53],在土壤环境的监测中具有重大意义。
4.2.2 香辛料植物生长情况的监控 香辛料的生长情况是重金属监测的一个重要指标。据研究,重金属的胁迫作用可导致过量活性氧产生,引起超氧化物歧化酶、过氧化氢酶参与体内活性氧的代谢,从而引起酶的代谢失衡,同时也会影响植物体中叶绿素的含量[54-55]。因此,监测香辛料植物的物质含量,可间接反映重金属的污染情况。目前研究发现,植物辐射光谱会随着重金属胁迫发生变化,可作为重金属污染的监测对象之一。刘飞等[56]采用谐波分析红边光谱的技术,监测玉米生长过程中叶绿素含量以及Cu含量,实现对重金属污染的监控。
4.3 其他方面
4.3.1 塑化剂污染监控 对于塑化剂污染方面的研究,目前使用最多的测定方法有凝胶渗透色谱-高效液相色谱法、气相色谱质谱联用法等[57],但这类方法需要对样品进行较长时间的前处理,未能及时有效地监测。但目前已有研究表明,土壤中残留的塑化剂会抑制小麦幼苗植物体内的过氧化物酶、过氧化氢酶活性,也会造成辣椒体内的维生素C含量下降10.6%[58]。因此,香辛料的相关生理指标变化有望为塑化剂污染监控提供有效的途径。
4.3.2 农药残留的监控 为避免农药残留带来的影响,香辛料的产地环境是首要的监测对象。目前多采用具备电子捕获检测器的气相色谱法、气相色谱-串联质谱法等方法进行测定,但土壤基质复杂,灵敏度较低,在定性、定量方面存在缺陷[59]。除此之外,香辛料自身也可作为农药残留的监测对象。但相关研究表明,桂皮基质中含有的某些化合物经过色谱柱时未与农药分离,在农药残留的测定上具有误差[60],如何开发快速、有效的农药残留检测技术成为新的研究方向。
5 总结与展望
香辛料作为一种常见的植物性原料,主要受四大风险因子的影响:真菌毒素和微生物的污染、重金属污染、塑化剂污染以及农药残留。在微生物污染方面,黄曲霉菌和赭曲霉菌是真菌毒素的主要来源,其毒性的强弱与香辛料种类、毒素种类存在联系。在重金属污染方面,铅、镉元素在香辛料植物体内大量富集,不同部位的积累量有所差异,甚至镉元素与其他金属还存在着拮抗和促进作用,使重金属污染复杂化。除此之外,塑化剂的迁移、农残的累积效应也是造成香辛料污染的原因。本文总结了上述四大风险因子的污染途径、毒性及产生情况,期望为香辛料的风险防控提供参考。
香辛料风险监控技术的发展目前停留在实验室阶段,随着全球对食品安全风险评估的逐渐重视,香辛料的风险防控也将成为必然趋势。特别是在真菌毒素和微生物污染方面,由于真菌毒素的产生不可控,很难在香辛料的生产加工过程中实现零污染。在目前,真菌毒素的合成途径以及基因调控环节的探索相对薄弱,但一些研究表明,香辛料中含有的一些抑菌成分[61],抑菌成分的研究对未来真菌毒素的代谢具有重要意义。

